ScRNA-seq+免疫:前列腺癌淋巴结转移相关的免疫抑制
转移是导致前列腺癌(PCa)患者死亡的疾病进展的关键。本文旨在通过使用单细胞RNA测序(scRNA-seq)分析PCa中肿瘤微环境(TME)的异质性来探讨淋巴结转移(LNM)的机制。从四个PCa组织样本中获得32,766个细胞进行scRNA-seq,结果显示,在LNM中只有EEF2+和FOLH1+腔亚群存在,并且它们出现在腔细胞分化的初期阶段,这通过验证实验证实。MYC通路在EEF2+和FOLH1+腔亚群中富集,MYC与PCa LNM相关。此外,MYC不仅促进PCa的进展,还通过调节PDL1和CD47导致TME的免疫抑制。在LNM中,TME中CD8+T细胞的比例以及NK细胞和单核细胞中的比例较原发病灶中较低,而Th和Treg细胞相反。此外,TME中的这些免疫细胞经历了转录重编程,包括CCR7+和IL7R+的CD8+T亚群,以及表达肿瘤相关基因的M2样单核细胞亚群,如CCR7、SGKI和RPL31。此外,与肿瘤进展、肿瘤代谢和免疫抑制密切相关的STEAP4+、ADGRF5+和CXCR4+、SRGNC+纤维母细胞亚群表明它们在PCa转移中的贡献。同时,通过多色免疫荧光证实了PCa中存在CXCR4+纤维母细胞。总之,PCa LNM中腔细胞、免疫和间质细胞的显著异质性可能不仅直接促使肿瘤进展,还间接导致TME免疫抑制,这可能是PCa转移的原因,其中MYC发挥了作用。本文于2023年5月发表在《Experimental Hematology & Oncology》IF:10.9期刊上。
技术路线

主要实验结果:
1、原发病灶和淋巴结转移中的TME细胞组成
对两名患有PCa的患者的四个肿瘤样本进行scRNA-seq分析,以确定它们的细胞组成(图1A)。共获得32,766个细胞的单细胞转录组,其中16,717个细胞来自原发病灶,16,049个细胞来自淋巴结转移。UMAP分析基于细胞的基因型和典型标记基因,鉴定了14个主要细胞类群(图1B和D),包括:(1)具有GZMK、CD8A和IFNG高表达的CD8+T细胞;(2)特异性表达KRT18和EPCAM的腔细胞;(3)具有ACTA2和TAGLN高表达的纤维母细胞;(4)具有GZMB、NKG7和GNLY高表达的NK细胞;以及(5)特异性表达HLA-DRA、C1QA和C1QB的单核细胞,以及其他细胞类型的标记基因(图1D)。结果显示了每个细胞类型中前10个高表达基因的表达谱,以及每个细胞类型的细胞比例(图1C和E)。值得注意的是,每个原发病灶样本中都存在所有细胞类型,而在转移病灶中基底细胞和中性粒细胞几乎不存在(图1C)。TME细胞组成的显著差异暗示着原发病灶和淋巴转移之间明显的异质性。
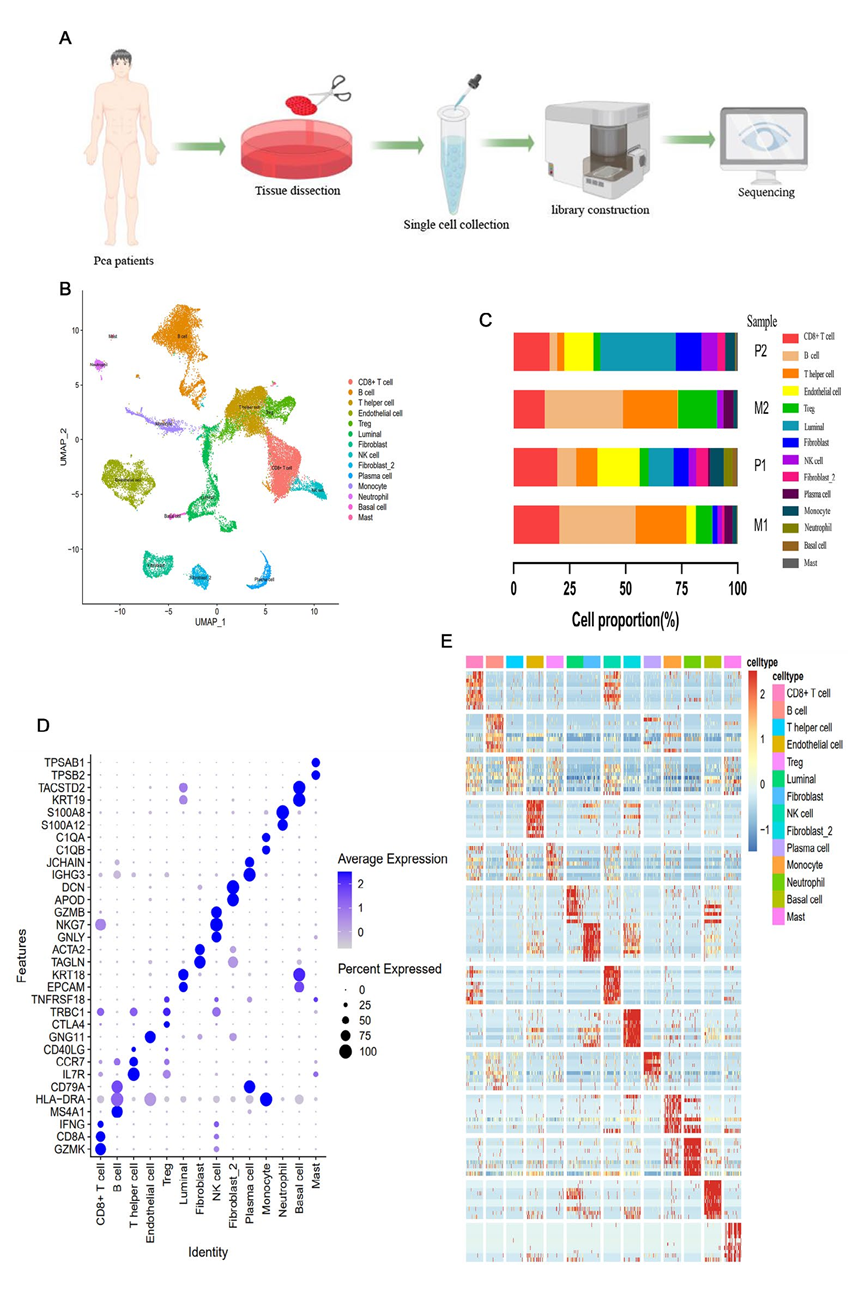
图1 通过scRNA-seq鉴定出PCa中的14种细胞类型
2、腔细胞的转录异质性和InferCNV
根据先前的研究,腔细胞和基底细胞是前列腺癌可能的起始细胞。对腔细胞的UMAP分析确定了总共七个亚群(图2A),并展示了不同腔细胞亚群的基因表达模式(图2B)。还展示了每个腔细胞亚群中前五个标记基因,分别是EEF1A2、HBB、IGKC、NPY和FOLH1在腔上1中高表达。在腔上5中HBB和IGKC高表达,而NPY和FOLH1在腔上7中高表达(图2C)。GSVA显示MYC和氧化磷酸化信号通路在腔上1亚群中富集,而TNF-α信号通路活性在腔上3亚群中增强。此外,腔上4亚群具有高的蛋白分泌和雄激素应答信号通路富集得分,而E2F和G2M信号通路在腔上6亚群中富集。腔上7亚群展示了在血管生成信号通路中的增强活性(图2D)。
InferCNV算法被用于识别染色体CNAs,以进一步验证七个腔上亚群中是否存在恶性细胞。根据先前的研究,该方法可以识别典型的PCa基因改变,包括染色体8q增益和染色体8p、13和16q缺失。此外,先前的DNA测序研究揭示0-50%的PCa基因组具有CNAs,并且CNAs也是PCa的预后因素。而且,在大多数PCa病例中,次克隆CNAs的负担远远超过克隆负担。本文的InferCNV结果显示在图2E中。腔上亚群1和5以及3和7中的所有细胞都被聚集在一起。其他亚群中的所有细胞都被单独分组(图2E)。在CNAs的热图中,红色和蓝色分别表示片段染色体中基因表达值过高和过低。这意味着红色颜色越深,染色体扩增的程度越高,而蓝色颜色越深,染色体丧失的程度越高。因此,研究结果显示腔上亚群1和5以及3和7中的染色体CNAs的程度远高于其他簇。因此,腔上亚群1和5以及3和7中的细胞可能是恶性细胞(图2E)。此外,腔上亚群1和5仅出现在转移病灶中,暗示这两个亚群可能在恶性细胞中包含有转移能力的细胞(图2G)。
进一步分析了原发病灶和淋巴结转移之间的差异表达基因(DEGs)及其功能富集,以揭示PCa淋巴结转移中的特定基因表达模式(图2H-I)。结果显示主要富集的功能性DEG途径与免疫相关,如白细胞和淋巴细胞活性的调控以及B细胞活性(图2I),表明肿瘤免疫可能对PCa的淋巴结转移产生影响。此外,还分析了腔细胞的转录调控因子在原发病灶和淋巴结转移之间的差异(图2F和J)。JDP2、IRF1、ENO1、HOXB2、IRF8、NELFE、ESRRA、SP8、KLF9、SF1、TFAP2A、IRF7、CREB3、GTF2F1、MXI1、CREB5、EGR3、FOXO3、NFATC3和CREM在淋巴结转移中都被激活,而在原发病灶中没有激活(图2F和J)。特别是NELFE在淋巴结转移中的表达显著高于原发病灶。有报道称NELFE在许多癌症中能促进侵袭和转移。因此,上述结果表明这些转录因子可能参与了PCa的淋巴结转移(图2J)。
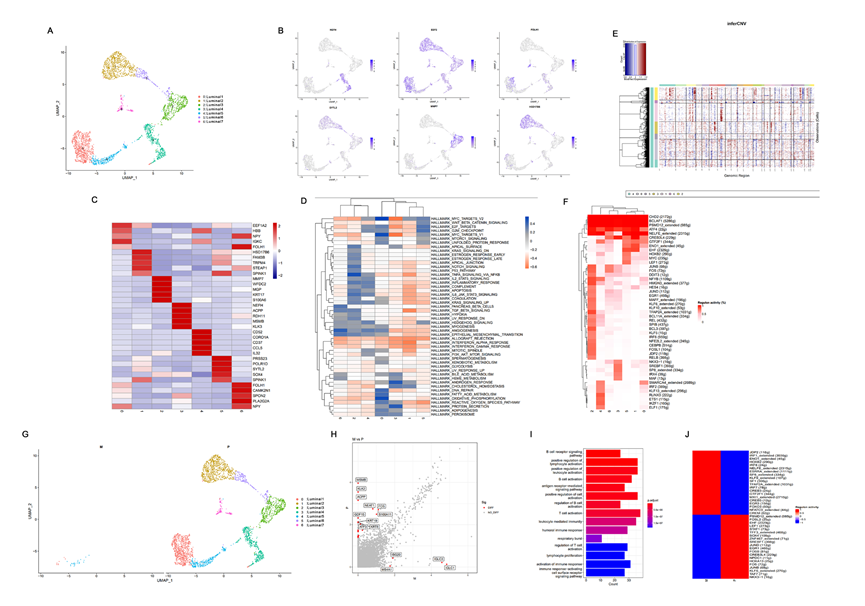
图2 腔室细胞的异质性和CNV分析
随后,选择在EEF2+和FOLH1+腔上亚群中具有特异性的标记基因EEF1A2和CCL5进行免疫组化染色在PCa组织芯片上,结果在正常组织中显示阴性结果。在原发病灶和淋巴结转移中的一些前列腺癌细胞呈现阳性表达,这表明在PCa中存在这两个亚群的细胞(图3A)。免疫荧光显示MEEF1A2和CCL5在LNCap细胞中均有表达(图3B)。在LNCap细胞中下调MEEF1A2和CCL5的表达可以显著降低细胞增殖和转移的能力(图3C-F)。
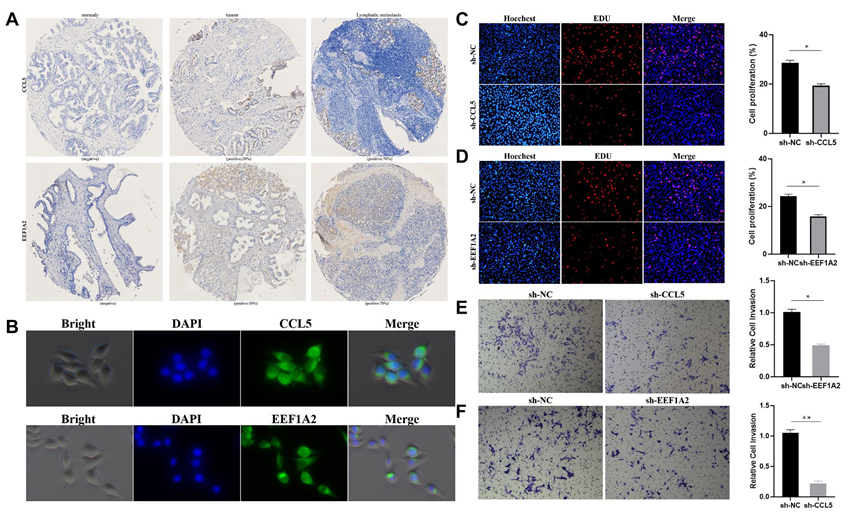 图3 PCa中存在EEF2+和FOLH1+腔上亚群细胞。
图3 PCa中存在EEF2+和FOLH1+腔上亚群细胞。
3、MYC可能通过促进肿瘤细胞进展和免疫抑制来促使淋巴结转移
腔上亚群1和5出现在淋巴结转移中。MYC通路在这些细胞中也显示富集,因此进行进一步的调查。芯片IHC结果显示MYC在细胞核和细胞质中表达,并且在PCa组织中的表达显著强于正常前列腺组织。重要的是,淋巴结转移中的MYC表达显著高于原发病灶(图4A),表明MYC与PCa转移有关。免疫荧光结果显示,LNCap细胞中MYC、PDL1和CD47均有表达,而PDL1和CD47主要表达在细胞质中(图4B)。从NCBI和JASPAR数据库获取的结果显示,PDL1和CD47的启动子区域有MYC的结合位点,证明PDL1和CD47是MYC的靶基因(图4C)。通过敲低LNCap细胞中MYC的表达后,发现PDL1和CD47的mRNA和蛋白水平显著下调(图4D-F)。此外,Transwell结果表明MYC表达下调显著降低了LNCap细胞的转移能力(图4G-H)。
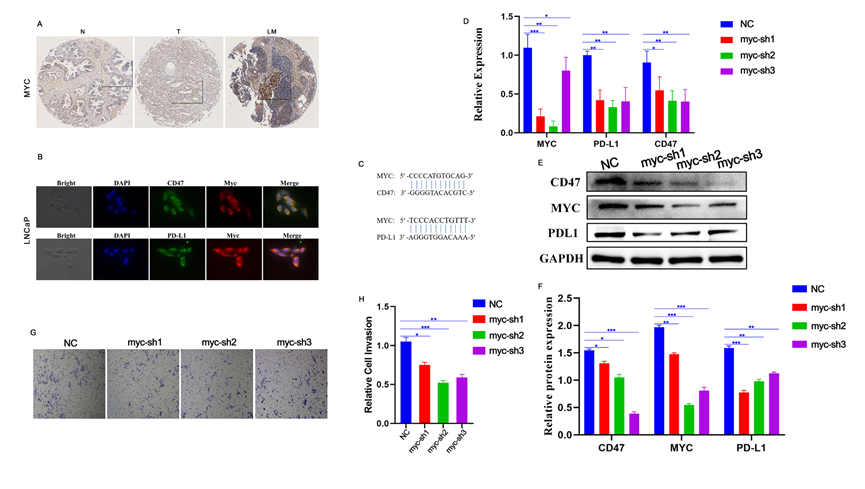
图4 MYC通过CD47和PD-L1驱动肿瘤进展
4、腔细胞轨迹分析
细胞轨迹结果显示在图4中,其中Monocle 2将所有腔细胞分为七个状态(图5B)。图4A显示了根据Seurat进行的降维聚类后,细胞根据其簇的分化轨迹。簇0和4分布在图的右侧,而簇2和6分布在图的左侧。另外的三个簇(1、3和5)位于图中部的下方(图5A)。此外,腔细胞的分化轨迹以第二分支点为重要的转折点,从图的右侧到左侧和下部(图5C)。因此,腔细胞的总体分化发生在簇0、1和4到簇2、3和6之间。InferCNV结果显示簇0、2、4和6是潜在的恶性细胞,而簇1、3和5是非恶性细胞。两个簇0和4是转移细胞,暗示具有转移能力的癌细胞早期发生(图5C)。此外,恶性细胞的分化方向与非恶性细胞不同。
接下来,探索了腔细胞分化过程中的转录组变化。选择具有不同表达特征的代表性基因,观察它们在细胞分化过程中的动态变化(图5C)。MYC相关的锌指蛋白(MAZ)在一些重要基因,包括MYC、RAS和CT-1中发挥转录调控作用。MAZ的表达在细胞分化时间内首先增加,然后急剧下降(图5D)。唾液酸蛋白(SPN),也称为LSN和CD43,是一种跨膜唾液酸糖蛋白。随着腔细胞的分化,SPN基因表达在基线处最初保持不变,然后急剧增加,稍有下降,最终迅速增加(图5D)。图5E显示了在腔细胞分化过程中特征基因表达变化的可视化和聚类结果。随后,根据分化过程,将腔细胞分为命运1、分支前和命运2子集。在腔细胞从命运1到命运2的分化过程中,所有变化的基因可以根据它们的表达水平分为四类(图5F)。
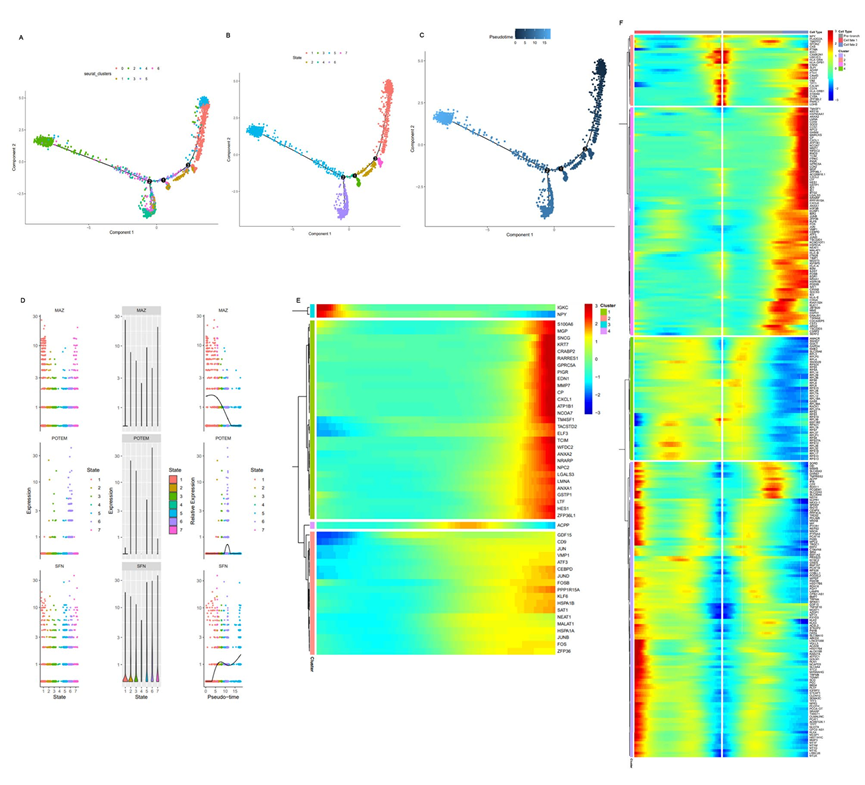
图5腔内细胞的轨迹分析
5、原发病灶和淋巴结转移病灶中CD8+ T细胞的异质性特征
在本研究中,鉴定了5,843个CD8+ T细胞(原发病灶中的3,069个,转移病灶中的2,774个)。通过CD8+ T细胞的UMAP分析鉴定了四个亚群(图6A)。此外,结果显示在转移病灶中,亚群0和3的比例显著高于原发病灶(图6B)。而且,在标记基因中,CCR7仅在亚群0和3中表达(图6C)。研究发现CCR7通过促进肿瘤细胞增殖和转移、鼓励蛋白酶分泌以及诱导血管生成和免疫抑制来促进肿瘤发展,与本文发现一致,即CD8+ T和其他肿瘤免疫细胞水平降低并经历转录重组,导致淋巴结转移中出现明显的免疫抑制。此外,GSVA结果显示,亚群0和3富集的通路包括Hedgehog信号、Notch信号、血管生成和MYC通路,与肿瘤增殖和发展相关(图6F)。这些结果表明,亚群0和3表达的标记基因具有肿瘤基因的特征,可以促进肿瘤增殖和转移,同时引起肿瘤免疫抑制。亚群2的比例在转移病灶中也显著小于原发病灶(图6B),NR4A3、DUSP4和RGS1是表达较高的标记基因(图6C)。亚群2富集的通路包括凋亡、上皮间质转化(EMT)、氧化磷酸化和DNA修复(图6F)。这些结果证实了亚群2中表达的标记基因,如NR4A3,可以通过介导MT-2信号通路抑制前列腺癌转移,显示了与CD8+ T细胞亚群0和3相反的功能。这些结果表明,TME中T细胞的异质性和免疫抑制可能是前列腺癌淋巴结转移的重要原因。对比之前的原发病灶和淋巴结转移病灶之间的DEGs的功能富集通路分析显示,这些基因主要集中在细胞质翻译、T细胞激活、正调控白细胞激活、免疫应答调节、白细胞黏附等与免疫相关的通路中(图6D和E)。这些结果进一步证明了前列腺癌淋巴结转移中CD8+ T细胞具有促使肿瘤进展并导致免疫抑制的特征。
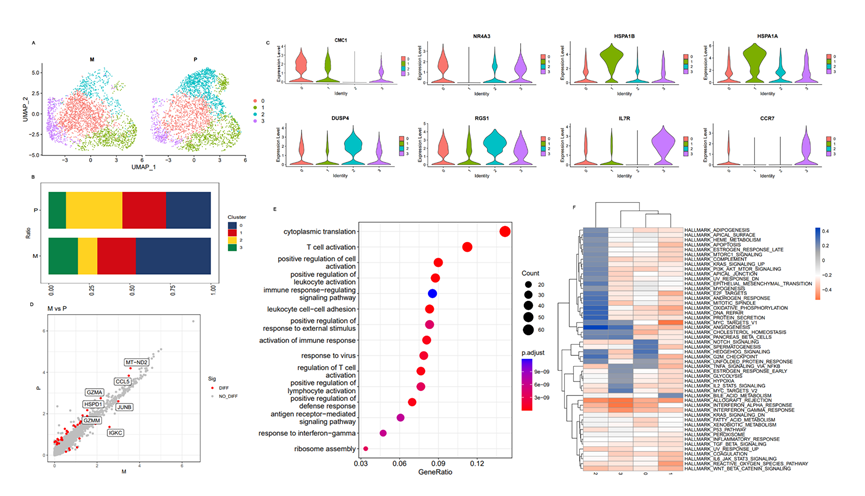
图6 原发性和转移性病变间CD8+T细胞的异质性分析
6、原发病灶和淋巴结转移样本中单核细胞的异质性
髓样细胞是除淋巴样细胞外TME中的另一个重要组成部分。在本研究中,共鉴定了1,203个单核细胞(原发病灶中的930个,转移病灶中的273个),而在淋巴结转移病灶中的单核细胞的数量和比例显著小于原发病灶。单核细胞的UMAP分析确定了共计六个亚群(图7A)。此外,在转移病灶中,亚群1、2、4和5的细胞比例高于原发病灶(图7B)。所有四个亚群中均发现BIRC3的过表达,而亚群1和2同时过表达M1特征基因CCL3(图7C)。此外,GSVA分析显示亚群1和2富集了TNF-α信号、炎症反应和TGF-β信号通路。除了BIRC3之外,促进肿瘤增殖和发展的特征基因,包括RPL31和EREG,均在亚群1和2中表达(图7C,F)。以上结果表明,亚群1和2可能是从M1到M2的过渡阶段,这与Azizi等人的研究结果一致,他们发现乳腺癌中一些TAM细胞群体高度表达了M1(如CCL3)和M2(如MARCO和NRP2)的特征基因。这意味着TME中的TAM分化也是一个连续和渐进的过程,而不是传统上认为的两个离散的状态。此外,GSVA显示亚群4和5富集了E2F、MYC、G2M、TNF-α信号和Hedgehog信号通路。以上结果表明,亚群4和5具有M2的特征。然而,在原发病灶中,亚群0和3的细胞比例显著高于淋巴结转移,暗示其可能具有抑制肿瘤的功能。GSVA结果表明蛋白分泌、氧化磷酸化、胆汁酸代谢等与代谢相关的通路主要富集在亚群0和3中(图7C,F),表明这些细胞可能通过调节免疫和代谢来干扰TME。此外,原发病灶和淋巴结转移病灶之间的单核细胞DEGs进一步调查。DEGs的功能富集通路分析显示,它们主要集中在免疫应答激活、白细胞迁移、正调控细胞激活等与免疫相关的通路中(图7D、E)。

图7 原发性和淋巴转移性前列腺癌TME中骨髓细胞的异质性分析
7、纤维细胞的异质性分析
除免疫细胞外,TME还包含癌相关的纤维细胞(CAFs)、血管内皮细胞、胞外基质等非免疫细胞组分,这些也影响肿瘤免疫微环境的功能状态。在本研究中,共鉴定了2,456个纤维细胞(原发病灶中的2,066个,转移病灶中的390个)(表2和3)。纤维细胞的UMAP分析揭示共计五个亚群(图8A)。在淋巴结转移病灶中,亚群3和4的细胞比例显著高于原发病灶,表明亚群3和4的细胞与肿瘤的进展和转移有关(图8B)。进一步研究这两个亚群中表达的特征基因揭示其他亚群中共同表达的基因,如DCN、ATF3和FLNA(图8C)。更重要的是,在亚群3和4中特异表达的STEAP4和ADGRF5显示了CXCR4和SRGN的显著过表达(图8C),这与TME中的肿瘤转移或免疫抑制密切相关。对13例带有淋巴转移的前列腺癌的石蜡切片进行的多色免疫荧光染色表明,CXCR4在原发肿瘤组织和淋巴结转移病灶中均为阳性,而在转移病灶中的阳性率高于原发病灶,这与单细胞测序的结果一致。这表明在前列腺癌TME中存在CXCR4 + 纤维细胞(图8D)。GSVA结果显示,亚群3和4的纤维细胞中Hedgehog信号通路、血管生成和G2M通路显著富集(图8G),而这些通路的激活可能导致肿瘤的进展。以上结果表明,表达STEAP4、ADGRF5、CXCR4和SRGN的纤维细胞亚群3和4经历了由转录重编程引起的显著功能改变,与肿瘤的进展和转移、肿瘤代谢和免疫抑制密切相关,暗示着这些纤维细胞具有促进前列腺癌转移和进展的能力。进一步分析前列腺癌原发病灶和淋巴结转移病灶之间的DEGs及其功能富集(图8E-F),特别是在淋巴转移灶中高度表达的DEGs,显示在转移灶中高度表达的DEGs包括与免疫相关的基因(CCL21、CCL19、CCL2和MYC)、与代谢相关的基因(STEAP4、FABP4、DPT和APOE)以及与肿瘤增殖和进展相关的基因(RGS、CCN和MYC)。DEGs的功能富集分析表明,这些DEGs主要富集在细胞质翻译、正调节细胞黏附、细胞外基质组织以及参与调控细胞外基质和免疫应答的淋巴细胞激活的正调节等过程中。总的来说,这些结果表明在PCa的TME中存在明显的成纤维细胞异质性。一些成纤维细胞亚群表达与肿瘤和免疫相关的基因,这可能影响肿瘤的进展并重塑TME中的肿瘤细胞和免疫细胞相互作用,从而促进PCa的转移。
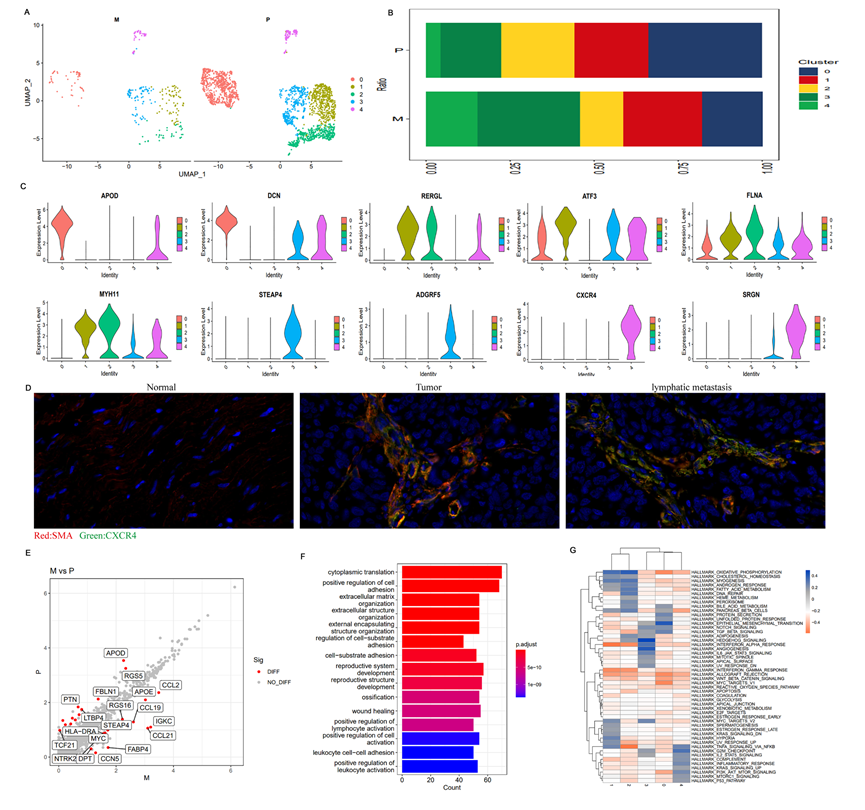
图8 原发性和淋巴转移性前列腺癌TME中成纤维细胞的异质性分析
8、PCa原发病变和淋巴转移灶的细胞间通信
为确定PCa原发病变和转移灶之间细胞间通信的差异,进行了CellChat分析。结果显示,淋巴转移灶中推断的相互作用数目大于原发病变,而相互作用强度则相反。此外,在淋巴转移灶中,间质细胞与免疫细胞之间的相互作用更为紧密,而与原发病变相比,腔细胞之间的通信减弱(图9A、B)。对PCa中的82个激活信号通路进行了分析和鉴定,其中63个在原发病变和淋巴转移灶中共享(图9C、D),有9个是原发病变特有的,包括GDF、PARs、CDH、CADH、BMP、TGFb、CX3C、DESMOSOME和WNT,其中GDF和PARs更为活跃。在淋巴转移灶中只存在的10个信号通路,包括CD22、CD45、IL16、SPP1、LIGHT、ANGPTL、GRN、ncWNT、PERIOSTIN和NEGR,除了经典的ncWNT通路可以促进肿瘤进展外,CD45和CD22最为活跃(图9C、D)。总体而言,这些结果表明淋巴转移灶中的细胞间通信可能导致TME中的免疫抑制状态和肿瘤进展。
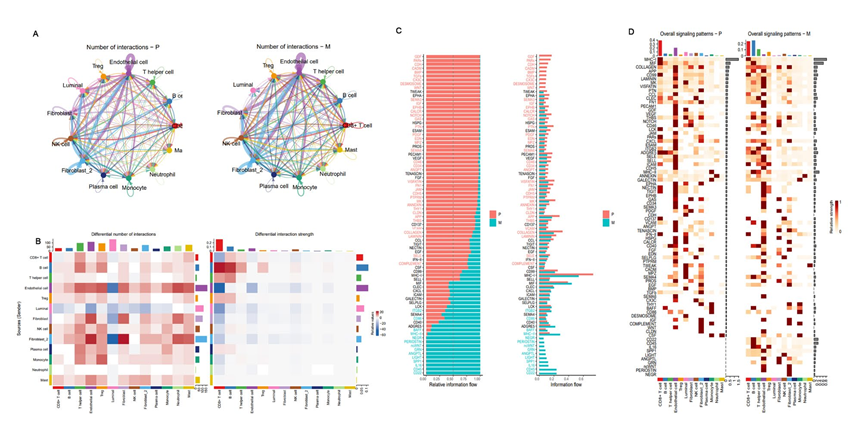
图9原发性和淋巴转移性前列腺癌TME的细胞间通讯
实验方法:
组织样本收集,细胞系培养,scRNA-seq分析,免疫组化(IHC),免疫荧光(IF),qRT-PCR,WB,Transwell实验,EDU
参考文献:
Xin S, Liu X, Li Z, Sun X, Wang R, Zhang Z, Feng X, Jin L, Li W, Tang C, Mei W, Cao Q, Wang H, Zhang J, Feng L, Ye L. ScRNA-seq revealed an immunosuppression state and tumor microenvironment heterogeneity related to lymph node metastasis in prostate cancer. Exp Hematol Oncol. 2023 May 23;12(1):49. doi: 10.1186/s40164-023-00407-0. PMID: 37221625; PMCID: PMC10204220.






