ZNF689缺乏促进三阴性乳腺癌肿瘤内异质性和免疫治疗耐药
三阴性乳腺癌(TNBC)是一种侵袭性疾病,其特征是显著的肿瘤内异质性(ITH),这给治疗带来了挑战。然而,TNBC中ITH的临床相关性和关键决定因素尚不清楚。在这里,作者使用多组学数据在作者中心的队列(n=260)、癌症基因组图谱队列(n=134)和四个免疫治疗队列(n=109)中全面表征ITH水平。作者的研究结果显示,高ITH与患者生存差和免疫治疗抵抗有关。重要的是,作者发现锌指蛋白689 (ZNF689)缺乏是ITH形成的关键决定因素。ZNF689-TRIM28复合物被发现直接结合到长穿插元件-1 (LINE-1)的启动子上,诱导H3K9ME3介导的转录沉默。ZNF689缺陷重新激活了LINE-1逆转录转位,加剧了基因组的不稳定性,从而促进了ITH。单细胞RNA测序、空间转录组学和流式细胞术分析证实,ZNF689缺陷诱导的ITH抑制抗原呈递和T细胞活化,赋予免疫治疗抗性。药物抑制LINE-1可显著降低ITH,增强抗肿瘤免疫,最终使体内缺乏ZNF689的肿瘤对免疫治疗增敏。在临床样本中,ZNF689的表达与良好的预后和免疫治疗反应呈正相关。总之,作者的研究揭示了ZNF689缺陷诱导ITH的机制,并建议LINE-1抑制联合免疫治疗作为TNBC的一种新的治疗策略。该文章于2024年1月发表在《Cell research》,IF:44.1。
技术路线:
 技术路线图
技术路线图
主要研究结果:
1. 在TNBC中,高ITH降低了患者的生存率,并赋予了免疫治疗耐药性
作者利用本中心队列(FUSCC队列,n = 260)和TCGA队列(n = 134)的多组学数据,全面表征TNBC的ITH,包括全外显子组测序(WES)结果、体细胞拷贝数变异(SCNV)数据、转录组RNA测序(RNA-seq)数据、H&E图像和临床数据(图1a)。为了推断遗传ITH,作者使用PyClone来估计每个肿瘤的亚克隆数量。为了研究ITH在TNBC中的临床相关性,作者进行了Kaplan-Meier生存分析。作者的研究结果表明,遗传或组织学ITH的增加与FUSCC队列中较低的总生存期(OS)、无复发生存期(RFS)和远端无转移生存期(DMFS)相关(图1b, c)。为了确定TNBC中ITH的下游通路,作者分析了FUSCC队列的转录组差异。基因集富集分析(GSEA)结果显示,高遗传ITH与典型免疫特征(如IFN应答和IL-6、JAK和STAT3途径)呈反相关(图1d)。此外,高ITH与CD8评分、肿瘤浸润淋巴细胞(TIL)评分和细胞溶解(CYT)评分呈负相关(图1e),表明高ITH可能导致免疫排斥肿瘤。以往的研究表明,ITH对免疫治疗的疗效有重大影响。因此,作者在四项基于抗pd -1的TNBC临床试验(n = 109)中探讨了ITH(通过H&E切片衍生的组织学ITH进行评估)对抗肿瘤免疫反应的影响(图1f)。新辅助试验NCT04613674和NCT04418154分别包括29例和16例患者的H&E图像,分析结果显示,高ITH肿瘤的病理完全缓解(pCR)率显著降低(图1g, h)。在第三个队列(NCT03805399)中,作者检查了29例患者的H&E图像,观察到高ITH肿瘤的ORR较低(图1i)。在最后一个队列(NCT04129996)中,作者评估了35例患者的H&E图像,发现高ITH肿瘤患者的ORR较低,无进展生存期(PFS)和OS较短(图1j)。总的来说,作者的研究结果表明,高ITH降低了TNBC患者的生存率,并赋予了免疫治疗耐药性。
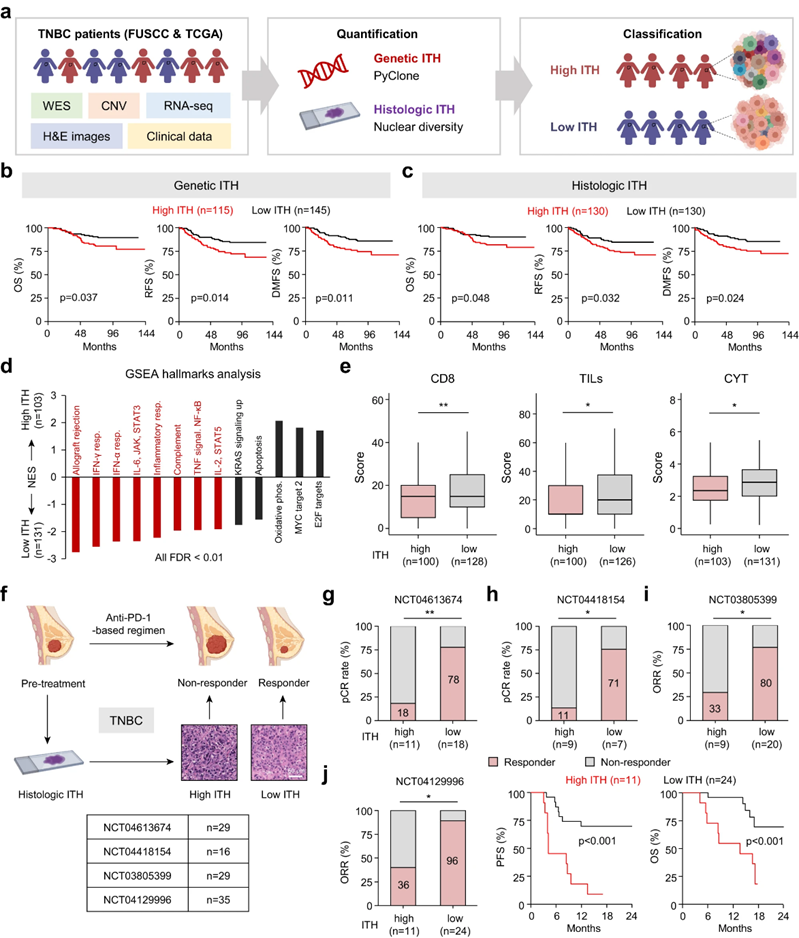
图1 高ITH降低了TNBC患者的生存率,并导致免疫治疗抵抗
2. 缺乏ZNF689可促进TNBC的ITH
为了探索TNBC中ITH的关键决定因素,作者使用队列数据分析了拷贝数改变、体细胞突变和转录组。由于高遗传ITH或组织学ITH肿瘤表现出与低ITH肿瘤相似的SCNVs和突变景观,作者专注于转录组学分析。分别在遗传水平和组织学水平上获得高ITH组和低ITH组的差异表达基因后,作者发现共有6个差异表达基因(MUC19、PGC、DHRS2、ZNF689、TDRD12和C20orf114)(图2a)。接下来,作者设计实验确定了诱导TNBC ITH的最关键基因(图2b)。LM2球体的h&e染色图像显示,使用短发夹RNA (shRNAs)敲除ZNF689显著增加组织学ITH(图2c, d)。具体来说,与低ITH组相比,高遗传和组织学ITH组ZNF689的平均表达分别降低了3倍和2.6倍。综上所述,这些发现表明ZNF689可能是TNBC中ITH调节的关键因素,需要更深入的实验探索。
为了研究ZNF689是否能在体内影响TNBC ITH,作者设计了一系列实验,使用免疫缺陷和免疫正常的小鼠(图2e)。(1)作者选择了一个TNBC患者来源的异种移植(PDX)标本,该标本具有低遗传ITH(由两个亚克隆证明)和低组织学ITH,同时ZNF689表达升高。在该PDX模型建立后,作者进行了针对ZNF689的siRNA瘤内注射。值得注意的是,ZNF689的缺失显著增加了遗传ITH和组织学ITH水平(图2f)。用siZNF689处理的PDX肿瘤也显示出比对照组更快的生长速度。(2)将稳定表达shNC和shZNF689的LM2细胞皮下注射到NOD/SCID小鼠的乳腺脂肪垫(mfp)中。作者发现ZNF689敲低显著增加免疫缺陷小鼠异种移植物的遗传和组织学ITH水平(图2g)。(3)将稳定表达载体和ZNF689的LM2细胞皮下注射到NOD/SCID小鼠的mfp中。作者观察到ZNF689过表达限制了LM2肿瘤异种移植物的遗传ITH和组织学ITH(图2h)。 (4)将过表达ZNF689或ZNF689的4T1细胞皮下注射到BALB/c小鼠的mfp中。作者发现ZNF689缺失导致4T1同基因移植物的组织学ITH显著升高(图2i)。相比之下,ZNF689过表达导致组织学ITH程度较低(图2j)。综上所述,这些结果表明,ZNF689缺乏在体内和体外都能促进TNBC中的ITH。
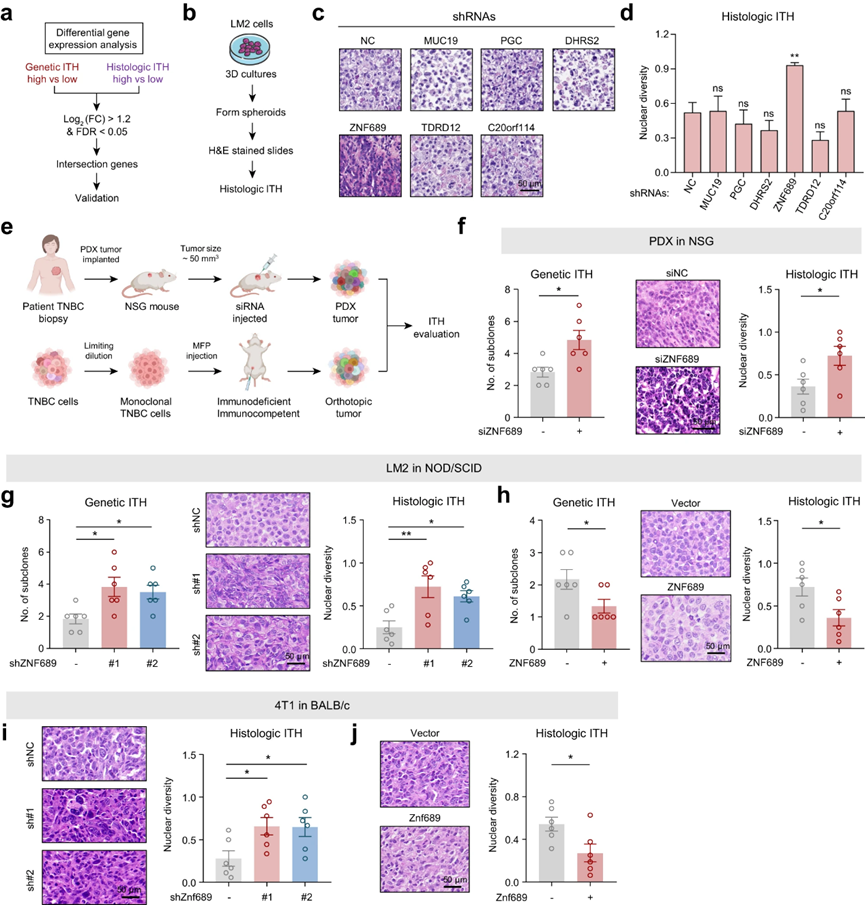
图2 ZNF689缺失促进TNBC中ITH
3. ZNF689通过TRIM28复合体抑制LINE-1逆转录
为了分析ZNF689缺乏如何促进TNBC中ITH的潜在机制,作者应用基于细胞培养(SILAC)的氨基酸稳定同位素标记定量蛋白质组学来筛选ZNF689相互作用蛋白。作者选择了排名最高的蛋白TRIM28进行进一步的结合验证。TRIM28是kr<s:1> pel-associated box domain zinc finger protein (KRAB-ZFP)转录因子的通用辅因子。内源性ZNF689和TRIM28的共免疫沉淀(co-IP)实验以及western blotting表明,这两种蛋白可以在LM2、Hs578T和HEK293T细胞中以内源性水平相互作用(图3a)。利用重组ZNF689和TRIM28蛋白进行的体外下拉实验进一步表明,这种相互作用可能是直接的(图3b)。
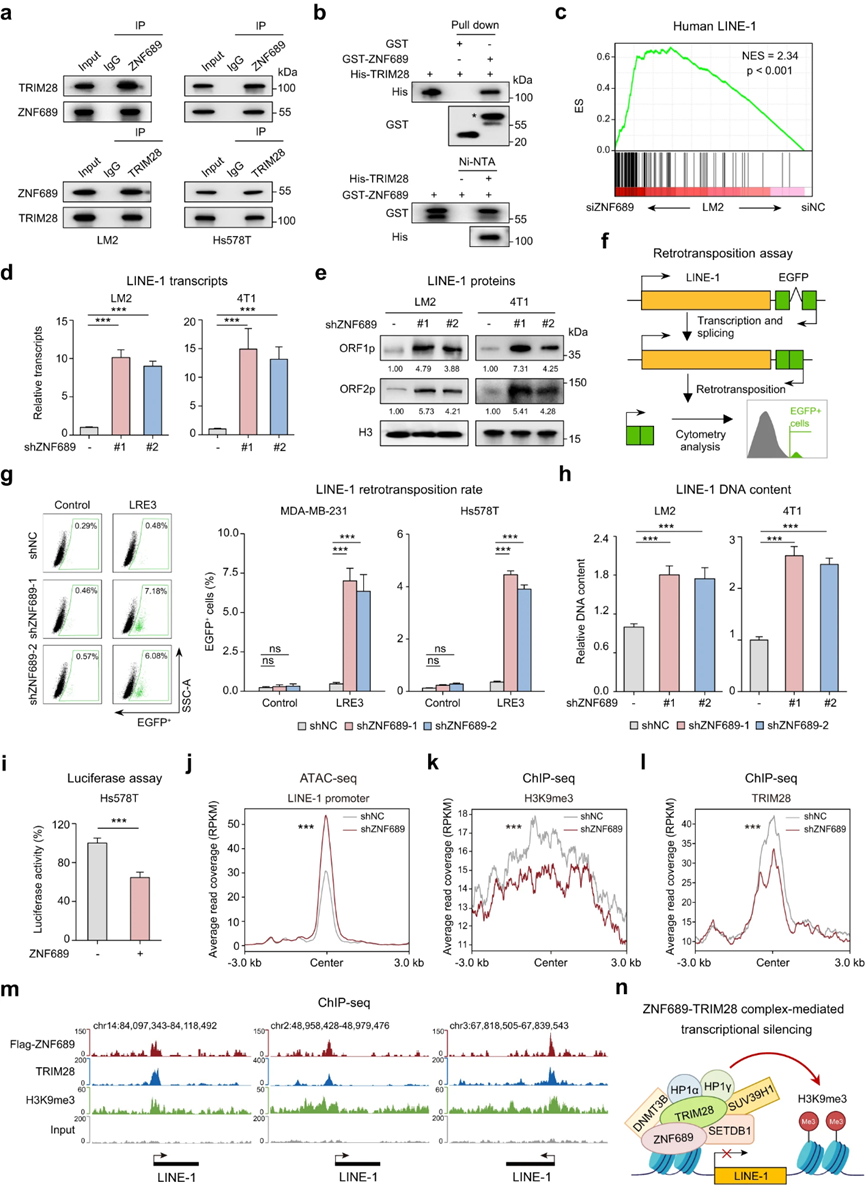
图3 ZNF689通过TRIM28复合体介导的转录沉默抑制LINE-1逆转录转位
KRAB-ZNFs的主要作用是通过招募转录调节因子TRIM28和组蛋白H3 Lys9三甲基化(H3K9me3)依赖性异染色质形成和DNA甲基化的相关介质来沉默重复元件(REs)。由于REs是遗传变异和基因组进化的主要参与者,作者推测ZNF689可能通过调控REs抑制TNBC ITH。为了研究是否有任何已知的REs受到ZNF689缺失的调控,作者对siNC-和siZNF689处理的LM2细胞进行了RNA测序。使用RepEnrich软件对数据进行分析,量化RE表达。GSEA还显示,在siZNF689处理的细胞中,人LINE-1基因标记显著上调(图3c)。为了验证转录组学分析,作者进行了实时定量聚合酶链反应(RT-qPCR)和western blotting来定量LINE-1。作者观察到,ZNF689缺陷显著上调了人(LM2和Hs578T)和鼠(4T1和AT3) TNBC细胞系中LINE-1 mRNA及其编码蛋白ORF1p和ORF2p(图3d)。为了检查在没有ZNF689的情况下LINE-1的逆转录转位活性是否会增加,作者使用工程的LINE-1报告系统对ZNF689敲除细胞(MDA-MB-231和Hs578T)进行了逆转录转位分析(图3f)。值得注意的是,在敲除ZNF689的细胞中,LINE-1的反转录频率高于对照细胞(图3g)。作者还通过RT-qPCR检测到在ZNF689敲除的人和鼠TNBC细胞系中LINE-1的基因组DNA含量升高(图3h)。LINE-1的转录是由LINE-1 5 '-非翻译区(UTR)的内部启动子驱动的为了验证ZNF689是否直接调控LINE-1的转录,作者将人LINE-1的5′-UTR克隆到荧光素酶报告质粒中。ZNF689过表达强烈抑制Hs578T和HEK293T细胞的荧光素酶活性(图3i)。使用测序(ATAC-seq)对转座酶可接近的染色质进行分析,支持了ZNF689缺陷导致全长LINE-1启动子的抑制和染色质可接近性增加的观点(图3j)。
TRIM28作为沉默复合体的支架,沉默复合体包括组蛋白甲基转移酶SETDB1、核小体重塑和去乙酰化(NuRD)复合体、异染色质蛋白1 (HP1)和DNA甲基转移酶通过联合ip分析,作者鉴定出SETDB1、DNMT3B、HP1α、HP1γ和SUV39H1是额外的ZNF689相互作用蛋白。LINE-1的启动子选择性富集于组蛋白变体H3.3和组蛋白标记H3K9me3中,这对维持LINE-1.30的抑制状态至关重要。因此,作者假设ZNF689可能将这些酶招募到LINE-1启动子中,以增强H3K9me3介导的转录沉默。ChIP-seq分析显示,ZNF689基因敲低后,全长LINE-1启动子上的H3K9me3修饰减少(图3k)。随后的分析显示,在缺乏ZNF689的情况下,TRIM28在该位点的募集减弱(图31)。这些数据支持ZNF689和TRIM28协同结合介导LINE-1启动子上的H3K9me3修饰(图3m)。综上所述,这些结果表明ZNF689通过TRIM28复合体介导的转录沉默抑制LINE-1逆转录转位(图3n)。
4. ZNF689缺陷诱导的LINE-1逆转录转位加剧了基因组不稳定性并促进ITH
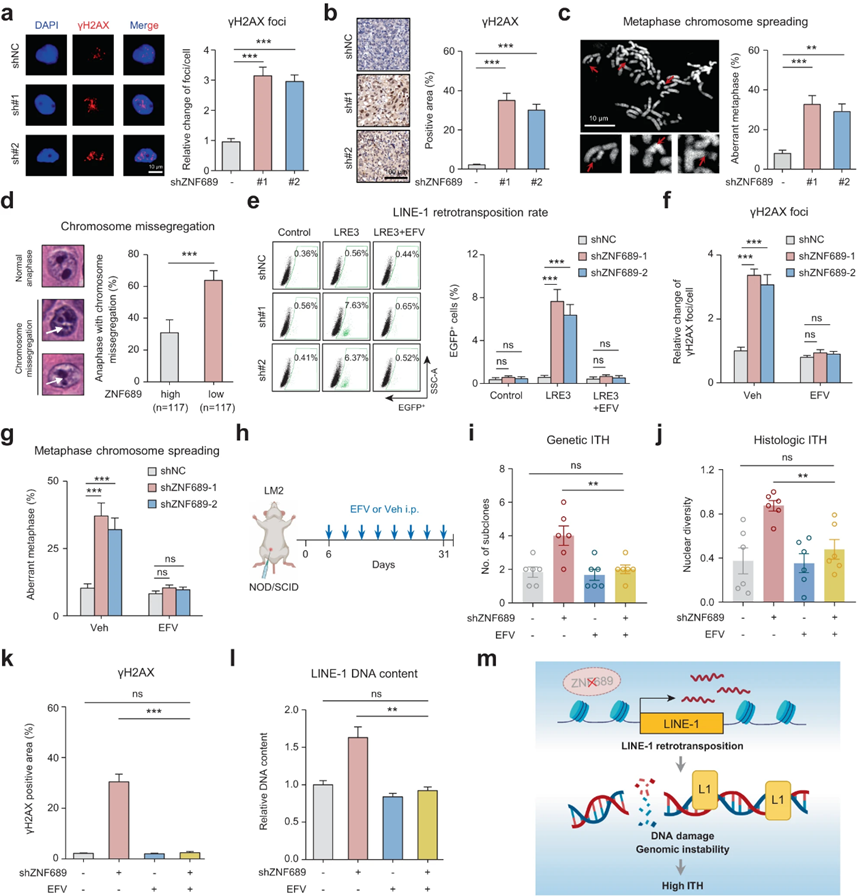
图4 ZNF689缺陷诱导的LINE-1逆转录转位加剧了基因组不稳定性并促进ITH
LINE-1逆转录转位是基因组不稳定性的主要来源,表现为双链DNA断裂增加和染色体不稳定性(CIN)。因此,作者假设ZNF689缺陷可能通过抑制LINE-1逆转录转位来促进ITH,从而导致基因组不稳定性增加。首先,作者检测了磷酸化组蛋白H2AX (γH2AX),这是一种用于评估基因组不稳定性的DNA双链断裂标记IF检测(图4a)显示,ZNF689敲低可增强γ - h2ax水平,这与ZNF689敲低原位LM2肿瘤的结果一致(图4b)。接下来,作者探讨了ZNF689缺乏在CIN中的潜在作用。中期染色体扩散试验显示,ZNF689敲低细胞中染色体畸变明显增加(图4c)。H&E切片的组织学检查也证实了ZNF689缺陷与后期染色体错分离增加之间的显著相关性(图4d)。这些结果表明,ZNF689缺陷导致TNBC基因组不稳定性增加。
逆转录酶抑制剂如EFV可以有效阻断内源性逆转录酶的酶活性,被认为是LINE-1逆转录转位的潜在特异性抑制剂。作者观察到EFV有效地减轻了ZNF689敲低诱导的LINE-1反转录转位和基因组DNA含量改变(图4e)。随后的IF测试(图4f)显示,EFV处理减弱了ZNF689敲低诱导的γ - h2ax上调。EFV还减少了ZNF689缺失细胞的染色体畸变(图4g)。这些结果表明,ZNF689缺陷通过LINE-1逆转录转位加剧了基因组的不稳定性。接下来,作者在体内研究了ZNF689缺陷诱导的ITH是否可以通过抑制LINE-1逆转录转位来逆转。作者用shNC或shZNF689 LM2细胞构建MFP异种移植模型。1周后,NOD/SCID小鼠随机分组,每天给药(Veh)对照或腹腔注射EFV (图4h)。值得注意的是,EFV显著降低了ZNF689缺失肿瘤的遗传ITH(图4i)和组织学ITH(图4j),这表明ZNF689缺失的ITH促进作用依赖于LINE-1逆转录转位。原位肿瘤免疫组化(IHC)分析显示,EFV可有效降低ZNF689缺陷肿瘤中γ - h2ax阳性区域(图4k)。此外,EFV显著下调了ZNF689缺陷肿瘤中LINE-1的DNA含量(图41)。总之,结果支持ZNF689缺陷通过抑制LINE-1逆转录转位加剧基因组不稳定性以促进ITH(图4m)。
5.ZNF689缺陷诱导的高ITH损害抗原呈递和T细胞活化
作者发现,高ITH赋予TNBC免疫治疗耐药性(图1f-j)。为了直接评估ITH诱导下的肿瘤微环境重塑,作者进行了单细胞RNA测序(scRNA-seq)来表征shZNF689或shNC 4T1同基因移植物收获的细胞转录组的变化(图5a)。最后,作者从shZNF689组收集了10,913个细胞,从shNC组收集了14,788个细胞。整合所有获得的细胞的转录组学数据后,统一流形近似和投影(UMAP)可视化显示了六种细胞类型,包括癌细胞、骨髓细胞、B细胞、T细胞、癌症相关成纤维细胞(CAFs)和内皮细胞。值得注意的是,T细胞在ZNF689缺陷肿瘤细胞中的比例下降(补充信息,图S8d)。为了准确地定义T细胞,作者将T细胞分为7个亚型:活化的CD8+ T细胞、调节性T细胞(Treg)、Tcf7+ T细胞、效应T细胞(Teff)、增殖T细胞(Tpro)、Isg+ T细胞和CD4+ naïve T细胞(图5b)。ZNF689缺陷组活化的CD8+ T细胞、Teff、Tpro和Isg+ T细胞减少,而Tregs、Tcf7+ T细胞和CD4+ naïve T细胞增加(图5c)。这一发现也通过BALB/c小鼠4T1肿瘤免疫细胞谱的流式细胞分析得到了验证,其中ZNF689敲除降低了肿瘤CD4+ T细胞浸润、CD8+ T细胞浸润以及颗粒酶B+ (GZMB+)和IFN-γ+ CD8+ T细胞的百分比(图5d)。同样,scRNA-seq数据显示,ZNF689缺陷肿瘤中的T细胞表达细胞毒性T细胞标志物(Ifng、Nkg7、Prf1和Gzmb)水平降低,但抑制性T细胞标志物(Ctla4和Btla)和Treg标志物(Foxp3、II2ra和Ikzf3)水平升高(图5e)。
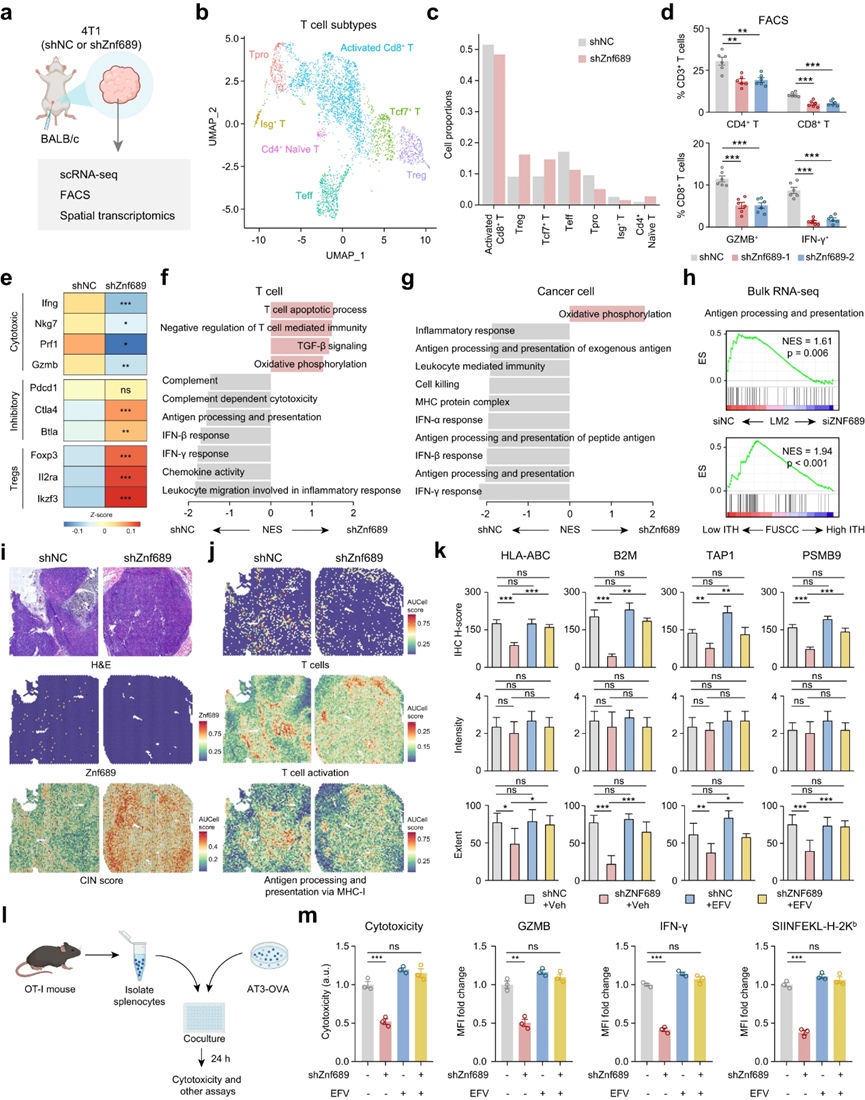
图5 ZNF689缺陷诱导的ITH损害抗原呈递和T细胞活化
接下来,作者研究了ZNF689缺陷诱导的ITH调控T细胞介导的抗肿瘤免疫的详细机制。来自scRNA-seq的T细胞和癌细胞通路分析显示,在ZNF689缺陷组中,IFN反应和抗原加工和递呈(APP)下调(图5f, g)。Bulk RNA-seq证实,在siZNF689处理的LM2细胞和高ITH肿瘤中,APP通路明显缺失(图5h)。为了揭示ZNF689缺陷是否影响单细胞的空间分布和基因表达,作者对BALB/c小鼠的4T1肿瘤进行了空间分辨转录组学研究。与之前的研究结果一致,ZNF689缺陷肿瘤在CIN评分中显示出明显且强烈的活性(图5i)。如图5j所示,在ZNF689缺陷点的肿瘤中,T细胞(包括CD4+和CD8+ T细胞)的特征评分、T细胞活化以及通过MHC-I进行的APP均较低且具有异质性。这些特征主要在ZNF689缺陷肿瘤的瘤周区域观察到,表明免疫排斥的微环境更多。此外,原位LM2肿瘤中HLA-ABC、B2M、TAP1和PSMB9的免疫组化分析表明,ZNF689敲除后,MHC-I app相关标志物的下调主要是由于染色细胞百分比的降低,而不是染色强度的降低(图5k),表明ITH也诱导了MHC-I app相关蛋白表达的空间异质性。然而,使用LINE-1抑制剂EFV治疗显著消除了原位LM2肿瘤中ZNF689敲低导致的MHC-I app相关蛋白表达空间异质性的增加(图5k)。
为了进一步阐明ZNF689调控MHC-I app相关基因的具体机制,作者对Flag-ZNF689 ChIP-seq数据的分析显示,ZNF689并不直接结合这些关键基因的启动子。这与假设一致,即这种抑制与缺乏ZNF689时LINE-1逆转录转位升高有关。为了评估ZNF689缺陷是否会由于MHC-I表达受损而限制CD8+ T细胞的细胞毒性活性,作者将小鼠卵白蛋白(OVA)特异性CD8+ T细胞(OT-I)与表达OVA的shNC和shZNF689 AT3肿瘤细胞一起培养(图51)。肿瘤细胞中ZNF689的缺乏导致CD8+ T细胞的细胞毒活性和CD8+ T细胞活化的降低,如GZMB、IFN-γ和CD137的表达降低(图5m)。这些数据对应于与shNC细胞相比,shZNF689 AT3肿瘤细胞中SIINFEKL (OVA肽)-H-2Kb复合物的表达减少(图5m)。然而,当用LINE-1抑制剂EFV处理肿瘤-免疫细胞共培养系统时,作者发现肿瘤细胞的抗原呈递和T细胞活化得到了恢复(图5m)。综上所述,这些数据表明,ZNF689缺陷诱导的ITH减少了抗原呈递,抑制了T细胞的浸润和活化,从而促进了TNBC的免疫逃逸和免疫治疗抵抗。
6. LINE-1抑制使ZNF689缺陷诱导的高ITH肿瘤对免疫治疗增敏
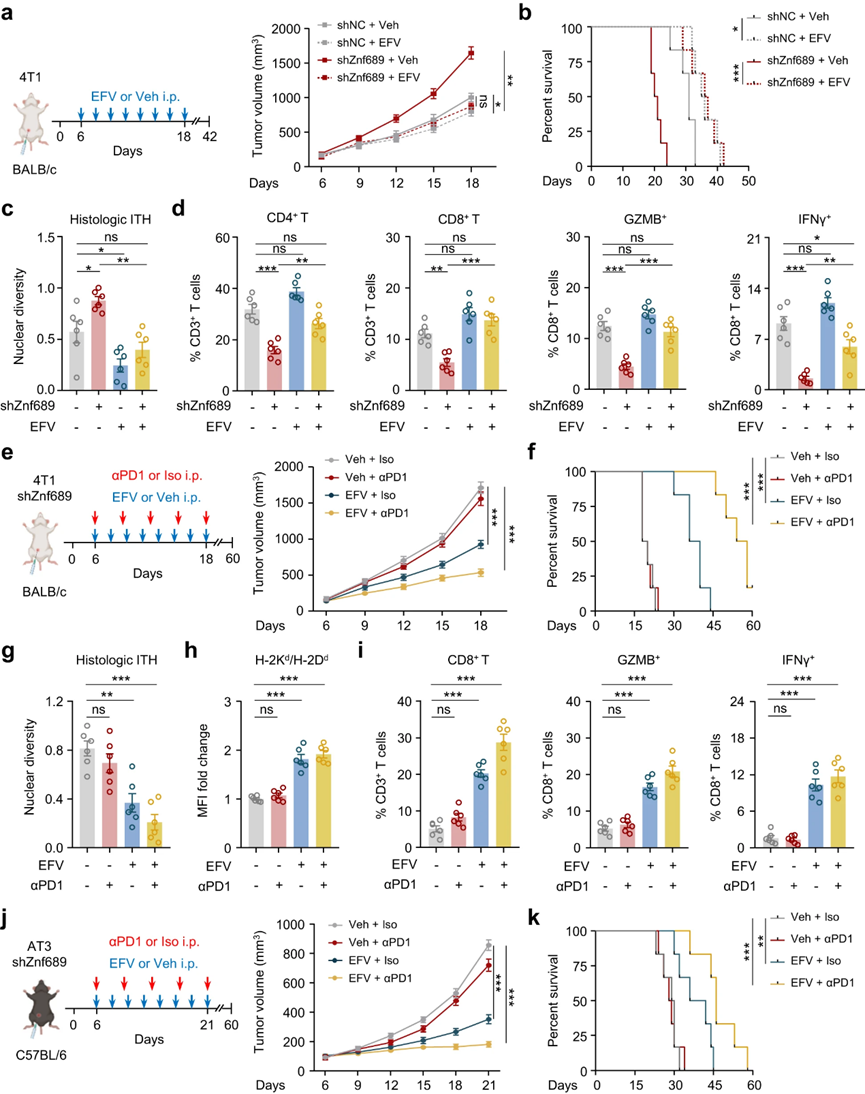
图6 LINE-1抑制使ZNF689缺陷诱导的TNBC高ITH肿瘤对免疫治疗增敏
鉴于LINE-1抑制在调节ITH和抗原提呈中的重要性,作者进一步探索LINE-1抑制剂EFV是否可以逆转免疫抑制的肿瘤微环境。然后将4T1细胞植入BALB/c小鼠的mfp中。在ZNF689缺乏组中,EFV显著抑制肿瘤生长(图6a)并延长存活时间(图6b),而不影响小鼠体重或食物消耗。EFV可有效降低ZNF689缺陷肿瘤的组织学ITH(图6c)。通过流式细胞术,作者发现EFV处理的ZNF689缺陷肿瘤比Veh对照组有更多的CD4+ T细胞、CD8+ T细胞、GZMB+和IFN-γ+ CD8+ T细胞(图6d)。这些观察结果表明,结合LINE-1抑制和免疫治疗具有潜在的协同抗肿瘤作用。因此,作者在BALB/c小鼠中原位MFP移植了ZNF689敲低的4T1细胞,以研究靶向LINE-1是否能使高ITH肿瘤对抗pd-1治疗增敏。虽然shNC组和shZNF689组之间的抗pd-1反应变化很,但与对照组相比,通过肿瘤体积评估,联合治疗在shZNF689组中显示出协同抗肿瘤作用(图6e)。此外,EFV联合抗pd -1治疗可显著延长小鼠存活时间(图6f)。原位4T1肿瘤显示,联合治疗可显著降低ZNF689缺陷肿瘤的组织学ITH(图6g)。此外,作者检测了联合治疗小鼠的微环境重塑;相关变化包括H2d MHC-I同种异体抗原水平(图6h)、CD4+ T细和CD8+ T细胞的浸润以及GZMB+和IFN-γ+ CD8+ T细胞的百分比(图6i)的显著增加。
为了排除细胞系或小鼠株特异性效应,作者将AT3细胞原位注射到C57BL/6小鼠的mfp中,建立了AT3乳腺癌模型。作者再次观察到,在使用LINE-1抑制剂EFV联合抗pd-1治疗的ZNF689缺陷组中,肿瘤生长延迟(图6j),生存时间延长(图6k)。此外,联合治疗显著降低了ZNF689缺陷肿瘤的组织学ITH,增强了抗原呈递,并协调了CD8+ T细胞的浸润和激活。这些数据表明,药物抑制LINE-1结合免疫治疗,通过阻断ITH和增强抗原呈递,促进肿瘤微环境中CD8+ T细胞的募集和激活,从而诱导有效的抗肿瘤免疫。
7. 在TNBC中,ZNF689的表达与良好的预后和免疫治疗反应呈正相关
为了进一步验证作者在人类TNBC样本中的临床前发现,作者通过组织微阵列(n = 283)的免疫组化分析,研究了ZNF689、LINE-1和CD8在TNBC患者队列中的表达水平。与作者的发现一致,免疫组化结果显示,在TNBC组织中,ZNF689的表达与LINE-1 ORF1p水平呈负相关,但与CD8+ T细胞浸润呈正相关(图7a)。此外,作者的分析显示,基于H&E染色,ZNF689的表达与组织学ITH水平呈负相关(图7a),这表明ZNF689是TNBC中与ITH相关的负相关因素。对于生存分析,作者观察到低ZNF689水平在TNBC患者中的预后明显差于相应的高ZNF689表达,这可以通过更短的OS、RFS和DMFS来证明(图7b)。来自公共数据库(Kaplan-Meier Plotter)的结果也显示,低ZNF689表达与基底样乳腺癌患者预后差相关。
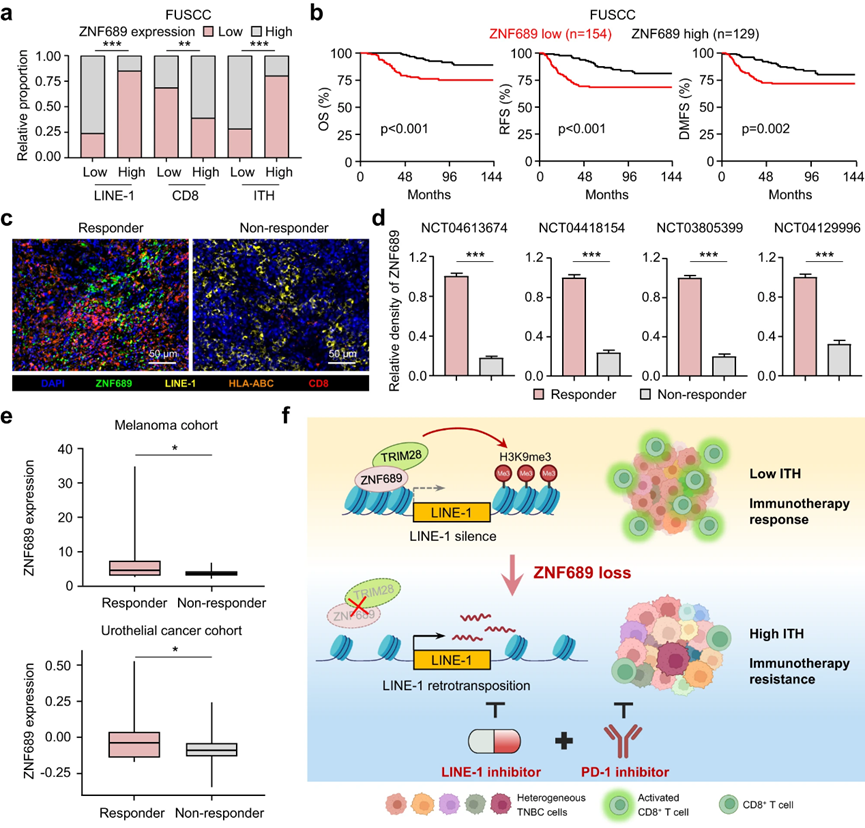
图7 在TNBC中,ZNF689的表达与良好的预后和免疫治疗反应呈正相关
此外,作者通过多色IF进一步评估了ZNF689、LINE-1、HLA-ABC和CD8在4个接受抗pd -1治疗的TNBC试验中肿瘤的蛋白表达水平(n = 100)。IF染色结果显示,在抗pd -1治疗应答者中,ZNF689与HLA-ABC和CD8表达呈正相关,而ZNF689与LINE-1 ORF1p表达呈负相关(图7c)。重要的是,作者发现肿瘤中ZNF689的高表达与免疫治疗的阳性反应相关(图7d)。这些结果与作者的体外和体内研究一致。为了评估这些观察结果是否也适用于其他类型的癌症,作者检查了接受抗pd -1治疗的黑色素瘤数据集(GSE91061)和尿路上皮癌数据集(GSE176307),观察到应答者中ZNF689水平较高(图7e)。与ZNF689损失的影响类似。总之,这些发现表明,ZNF689的表达与TNBC患者的预后和免疫治疗反应呈正相关。
总之,作者的研究阐明了潜在的机制,并揭示了一种靶向LINE-1的治疗策略,通过与免疫疗法的协同作用,可以使高ITH肿瘤被根除,为联合使用LINE-1抑制剂和免疫疗法进行TNBC精确治疗提供了基础。
实验方法:
遗传ITH的定量, 组织学ITH定量, 质粒构建、转染和慢病毒shRNA载体, DNA和RNA分析, Western blotting和co-IP, IF和多重IF,三维肿瘤球分析及组织学分析,小鼠肿瘤的WES,流式细胞术,SILAC标记和质谱,RNA测序和数据分析,逆转录转位报告试验,ChIP和ChIP-seq,免疫细胞与肿瘤细胞共培养试验,scRNA-seq
参考文献:
Ge LP, Jin X, Ma D, Wang ZY, Liu CL, Zhou CZ, Zhao S, Yu TJ, Liu XY, Di GH, Shao ZM, Jiang YZ. ZNF689 deficiency promotes intratumor heterogeneity and immunotherapy resistance in triple-negative breast cancer. Cell Res. 2024 Jan;34(1):58-75. doi: 10.1038/s41422-023-00909-w. Epub 2024 Jan 2. PMID: 38168642; PMCID: PMC10770380.






