由于WT1在小鼠颗粒细胞中积累,EPG5缺乏导致原发性卵巢功能不全
原发性卵巢功能不全(POI),也称为卵巢早衰,是人类的一种卵巢缺陷,其特征是40岁之前卵巢卵泡过早耗竭。然而,POI背后的机制在很大程度上仍然未知。在这里,作者表明敲除EPG5(异位P颗粒自噬蛋白5同源物)导致雌性小鼠的生育能力低下,雌性小鼠表现出POI样表型。单细胞RNA测序分析显示,敲除EPG5影响颗粒细胞(GCs)的分化。进一步的研究表明,敲除EPG5阻断巨自噬/自噬通量,导致WT1(WT1转录因子)的积累,WT1是GC的必需转录因子,表明WT1需要通过自噬途径选择性降解。作者发现,WT1在窦卵泡期的降解不足导致类固醇生成相关基因的表达减少,从而破坏GC分化。综上所述,作者的研究表明,EPG5促进GC中WT1的降解,表明GC中EPG5的失调可以触发POI发病机制。该研究于2022年7月发表于《Autophagy》上,题为“Epg5 deficiency leads to primary ovarian insufficiency due to WT1 accumulation in mouse granulosa cells”,影响因子13.3。
技术路线
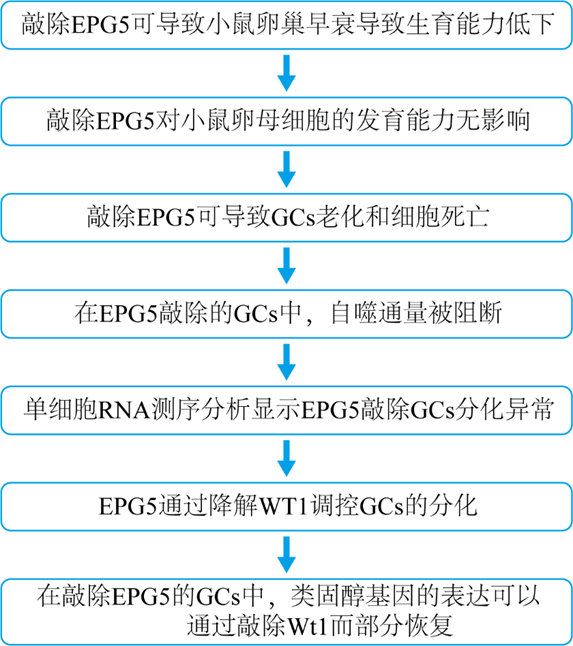
研究思路
1. 敲除EPG5可导致小鼠卵巢早衰导致生育能力低下
与许多其他自噬相关基因不同,最近发现的自噬相关基因EPG5的敲除不会导致小鼠的婴儿死亡,因此可以研究其在生育中的作用。作者初步检测了EPG5在小鼠各种组织中的表达,发现它在卵巢中显著表。蛋白水平上,经WB证实EPG5在GCs中高表达。卵巢免疫组织化学染色显示,在原始、原发、继发和窦卵泡的GCs中,EPG5信号强烈。这些结果提示EPG5可能参与了GC的某些功能。
为了进一步研究EPG5在生殖中的潜在功能,作者对EPG5基因敲除小鼠进行了实验。首先通过卵巢样本的免疫印迹证实了基因敲除效率(图1a)。8周龄EPG5基因敲除小鼠的卵巢形态检查显示,与对照组小鼠相比,卵巢大小明显减小(图1b)。此外,作者发现EPG5基因敲除小鼠的卵巢重量:体重比也显著降低(图1c)。为了研究EPG5基因敲除对雌性生殖能力的影响,研究人员进行了一项育种试验,将对照组或敲除EPG5的雌性小鼠与具有生育能力的雄性小鼠交配6个月。与对照组相比,EPG5基因敲除雌性小鼠的生育能力降低(图1d)。EPG5基因敲除组每窝幼崽数量少于WT对照组;EPG5基因敲除小鼠的平均产仔数为2.1±0.59,而WT为7.6±1.41(图1e)。最后,作者使用苏木精和伊红(H&E)染色对16周龄小鼠卵巢横切面进行观察,发现与对照组相比,敲除EPG5的卵巢有异常的卵泡发育(图1f,g)。
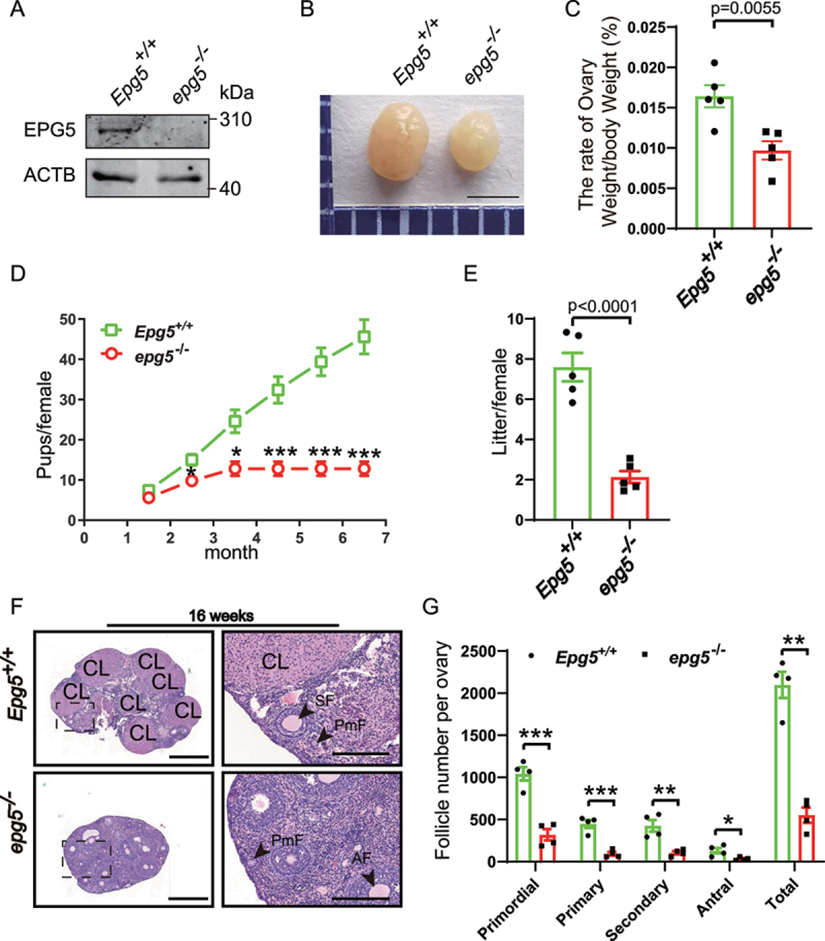
图1 敲除EPG5的雌性小鼠不育
为了研究EPG5的缺失如何阻碍生育,作者比较了不同年龄的卵巢形态。作者发现EPG5基因敲除和3周大的对照卵巢没有明显的形态学差异:两种基因型的卵巢都有相似数量的不同分期的卵泡,包括被扁平的颗粒前细胞包围的小卵母细胞,以及含有增大卵母细胞的激活卵泡。然而,当作者检测6周大的小鼠时,有明显的差异,在EPG5基因敲除的卵巢中,原始卵泡、初级卵泡和窦卵泡的数量显著减少。这些结果共同表明,EPG5基因缺失导致雌性卵巢卵泡发育功能障碍和生育能力低下。
2. 敲除EPG5对小鼠卵母细胞的发育能力无影响
在哺乳动物中,雌性的生殖能力是通过卵母细胞和卵泡的调节发育来维持的。鉴于作者已经在EPG5基因敲除小鼠中发现了与年龄相关的低生育能力和卵巢形态异常,作者探讨了卵母细胞功能障碍是否有助于解释作者的观察结果。与对照组小鼠相比,EPG5基因敲除小鼠的MII卵母细胞数量减少(图2a);然而,EPG5基因敲除组和对照组的极体-1(PB1)挤压程度没有差异(图2b)。
为了评估EPG5缺失的卵母细胞的发育潜力,作者在体外培养了3周龄EPG5敲除小鼠和对照组的生发囊泡(GV)卵母细胞。与体内成熟结果相似,敲除EPG5的卵母细胞的MII率与对照卵母细胞没有差异(图2c,d)。免疫荧光和共聚焦显微镜也显示,敲除EPG5的卵母细胞能够成功挤出PB1(图2e),并且敲除EPG5的卵母细胞与对照卵母细胞的异常MII比例没有变化(图2f)。为了进一步研究EPG5基因敲除小鼠卵母细胞的发育潜力,按照先前的描述进行了体外受精。作者发现,在EPG5基因敲除小鼠和对照组之间,双细胞胚胎和囊胚的形成率没有显著差异。这些结果表明,EPG5基因敲除小鼠的低生育能力是由于卵泡发育和排卵缺陷造成的,而不是由于卵母细胞发育改变。
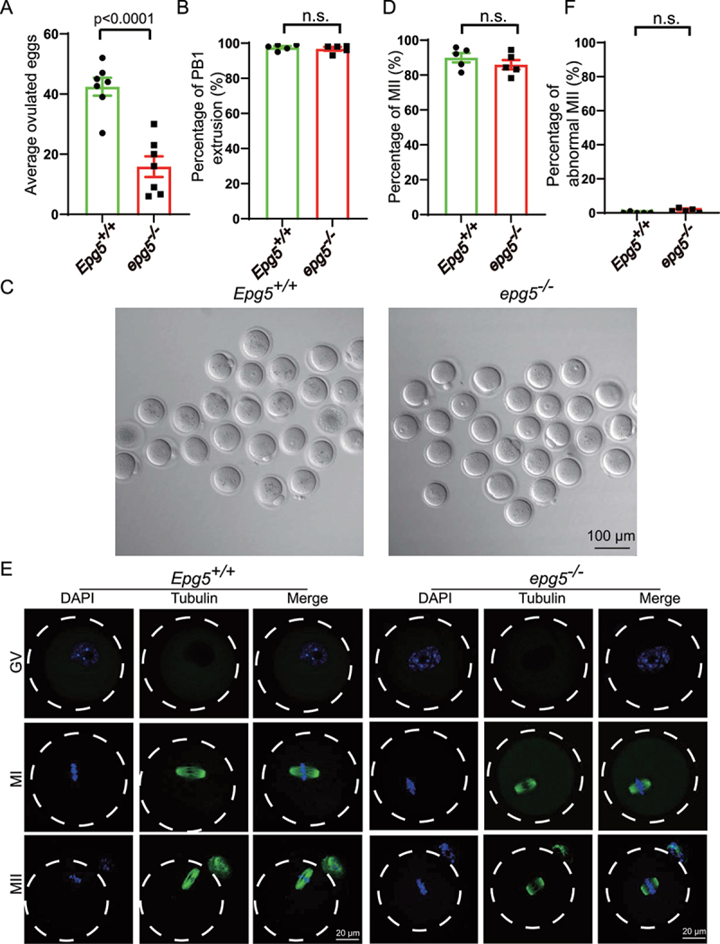
图2 来自EPG5基因敲除小鼠的卵母细胞能够完成减数分裂成熟。
3. 敲除EPG5可导致GCs老化和细胞死亡
GCs为卵母细胞提供必需的营养和类固醇,在卵泡发育中起着至关重要的作用。作者评估了GC功能失调是否可能是EPG5基因敲除小鼠poi样表型的基础。衰老相关GLB1/β-半乳糖苷酶(SAGLB1/β-gal)检测显示,与对照组相比,EPG5基因敲除的GCs中SAGLB1/β-gal活性显著增加(图3a,b)。作者还分别采用增殖细胞核抗原(PCNA)和末端脱氧核苷酸转移酶(dUTP)缺口末端标记(TUNEL)染色法检测了发育卵泡GCs的增殖率和细胞死亡率。6周龄EPG5基因敲除组卵巢中tunel阳性细胞明显多于对照组(图3c-g),EPG5基因敲除组卵巢细胞增殖明显降低(图3d-h)。同时,细胞死亡标志物cleavedCASP3(caspase3)的免疫染色信号在继发性和窦性卵泡的GCs中非常强(图3e-i)。此外,考虑到已知GCs在细胞死亡的后期阶段表现出核变化(包括DNA断裂),作者想知道EPG5的丢失是否会导致GCs中的DNA损伤。在EPG5基因敲除的GCs中,γ-H2AX水平显著升高,表明DNA双链断裂积累(图3f-j)。这些结果表明,EPG5的缺失减少了GC的增殖并诱导GC死亡,表明GC功能失调(即甾体生成)可能驱动了EPG5基因敲除卵巢中观察到的卵泡发育缺陷。
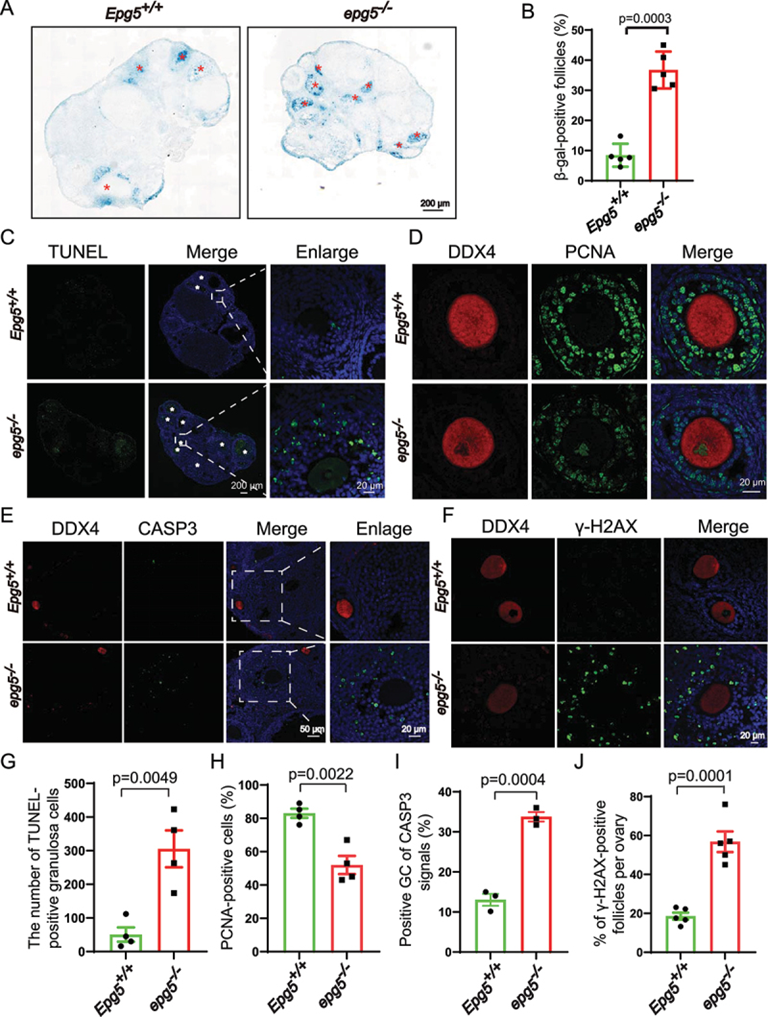
图3 敲除EPG5可导致GCs老化和细胞死亡
4. 在EPG5敲除的GCs中,自噬通量被阻断
EPG5通过与RAB7的直接相互作用以及与晚期内体/溶酶体上的VAMP7(囊泡相关膜蛋白7)-VAMP8复合物结合而被招募到自噬体中[41]。接下来,作者研究了EPG5是否对小鼠卵巢的基础自噬活性至关重要。与EPG5敲除小鼠脑和肌肉细胞一致,6周龄卵巢免疫印迹显示,与对照组相比,EPG5敲除卵巢中自噬标志物MAP1LC3/LC3-II和SQSTM1/p62水平显著升高,表明自噬通量被阻断(图4a-c)。与免疫印迹结果一致,抗lc3b抗体免疫染色显示,在6周龄EPG5基因敲除卵巢的所有卵泡期,lc3阳性GCs的数量均显著增加(图4d)。作者还在EPG5基因敲除的中央卵泡GCs中检测到明显的SQSTM1点信号积累,这在对照组中并不明显(图4e)。作者进一步研究了EPG5基因敲除卵巢的自噬通量受损是否导致了EPG5基因敲除GCs中LC3点数量的增加。6周龄卵巢分离GCs的免疫印迹显示,与对照组相比,EPG5敲除GCs中LC3和SQSTM1水平显著升高(图4f-h)。为了进一步研究EPG5敲除对自噬通量的影响,作者通过延时显微镜监测了EPG5敲除的GC的自噬通量。作者发现自噬体在对照GCs中以LC3点的形式与溶酶体融合(图4i,k,1),而LC3点在EPG5敲除的GCs中显著积累,尽管离溶酶体很近(图4i,k,1,j)。这些结果证实,在EPG5基因敲除的GCs中,自噬通量被阻断。
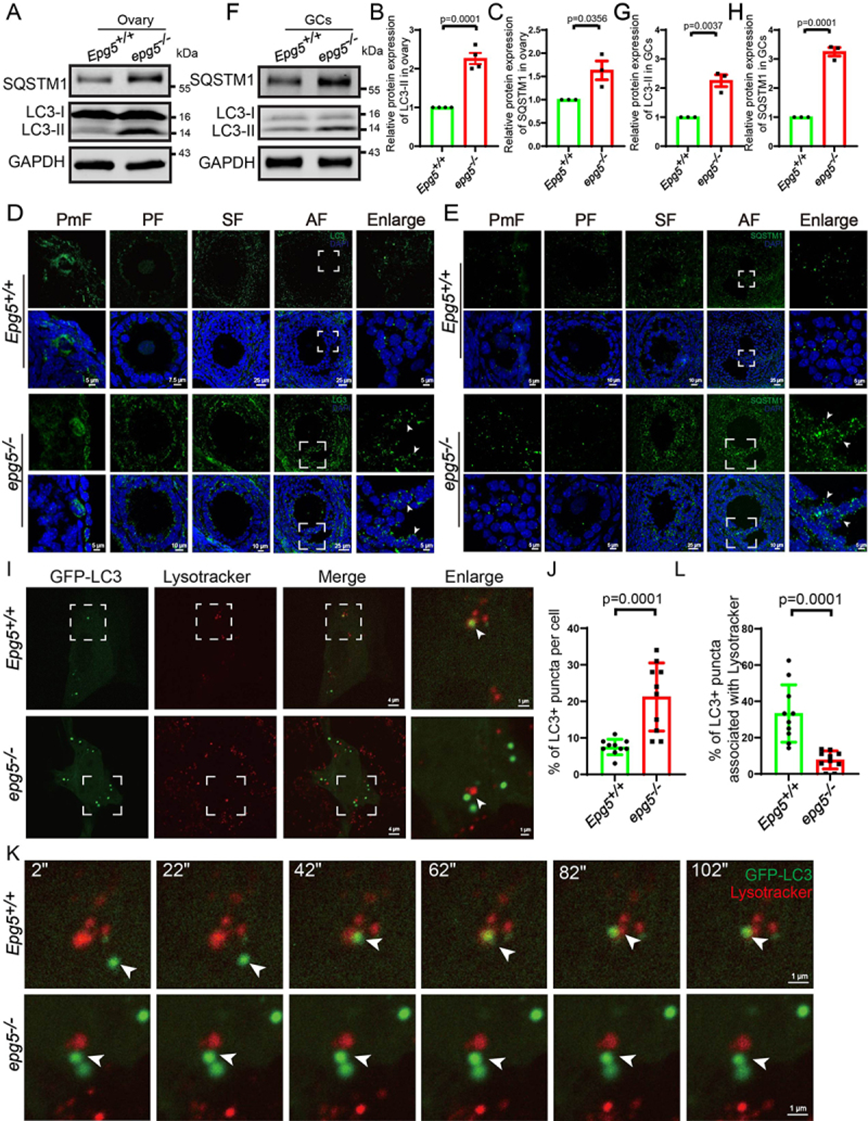
图4 EPG5基因敲除小鼠卵巢中自噬制造因子LC3-II和SQSTM1聚集物的积累
5. 单细胞RNA测序分析显示EPG5敲除GCs分化异常
为了研究EPG5在卵泡发生过程中的调控机制,作者对6周龄EPG5基因敲除小鼠和对照组小鼠全卵巢的游离细胞进行了单细胞RNA测序(scRNA-seq)分析(图5a)。质量控制后,作者在对照组和EPG5敲除小鼠卵巢体细胞中分别获得6328和4950个单细胞转录组。使用统一歧形近似和投影(UMAP)对10×基因组学数据进行无监督聚类分析,发现了7种主要的细胞类型,作者计算了每种细胞类型中排名前30位的差异表达基因(deg),过滤了平均loge变化>0.5的基因,按调整后的p值进行排序(Wilcoxon秩和检验)。为了可视化,作者为每个集群绘制了一个代表性的DEG。
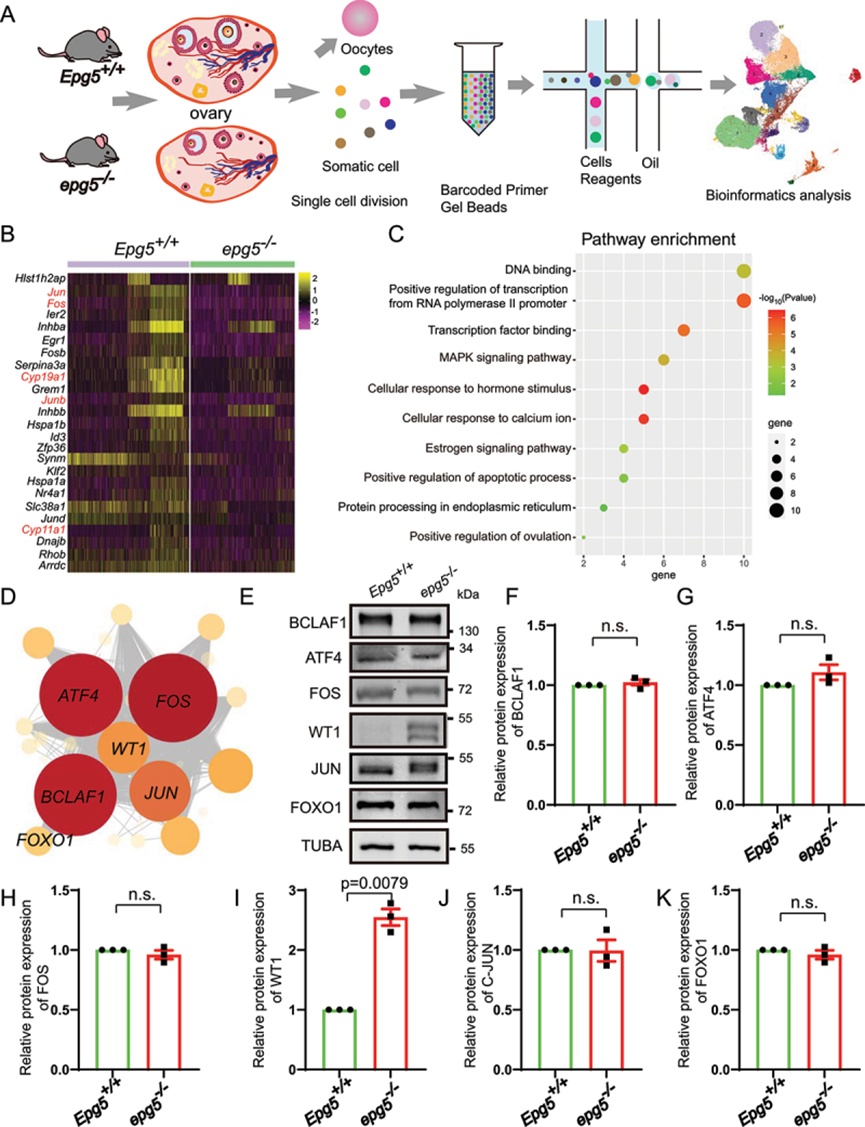
图5 单细胞RNA-seq分析揭示了EPG5敲除GCs的功能改变
接下来,作者根据每簇50个最易表达的基因对数据进行聚类,并能够区分五种主要的细胞类型:GC(四簇)、膜和基质细胞(六簇)、平滑肌细胞(一簇)、内皮细胞(一簇)、免疫细胞(三簇)和黄体细胞(一簇)。为了确认UMAP中这些细胞类型的身份,作者根据预期标记基因的表达水平对单个细胞进行了染色:Amh,Hsd3b1,Fshr,Wt1用于GCs;Pdgfrb,Lum为基质细胞;平滑肌细胞的Tagln和Rgs5;内皮细胞的Pecam1和Cdh5;Cd68和Ptprc用于免疫细胞;以及黄体细胞的Epdr1和Avpl1。
鉴于之前的结果,作者选择GCs进行进一步分析,以进一步阐明EPG5丢失对卵巢细胞反应的影响。两种基因型中GCs占总细胞百分比的相对比例显示,EPG5敲除小鼠卵巢中GCs的比例从对照组的44.68%下降到33.07%。EPG5敲除小鼠的GCs中有25个差异表达基因(1个上调基因,24个下调基因),包括编码性激素生物合成酶的Cyp11a1和Cyp19a1(图5b)。基因本体(GO)分析显示,下调基因富集了“转录正调控”、“转录因子结合细胞”、“激素刺激应答”、“雌激素信号通路”、“凋亡过程正调控”、“内质网蛋白加工”等功能注释(图5c)。为了确定GC中的主调控因子,作者通过单细胞调控网络推断和聚类(SCENIC)分析,构建了包含转录调控因子及其靶基因的转录调控网络。将GCs集群中的deg输入到SCENIC以建立监管网络。作者确定了包含868个基因的20个重要调控(图5d和表S3)。值得注意的是,调控网络中的关键调控显示高表达的调控包括Bclaf1、Atf4、Fos、Wt1、Jun和Foxo1调控,这些调控在维持GCs分化和卵泡闭锁过程中都是明确的调控因子。而WB结果显示,与对照组相比,BCLAF1、ATF4、FOS、JUN/c-JUN和FOXO1的蛋白水平没有变化(图5e、f、g、h、j、k)。其中,在敲除EPG5的卵巢中,WT1的蛋白水平显著升高(图5e、i)。总之,scRNA-seq分析显示,敲除EPG5显著干扰了GC分化基因的表达。
6. EPG5通过降解WT1调控GCs的分化
众所周知,WT1作为多种类固醇基因的转录抑制因子,在卵泡发生过程中抑制GCs的分化。为了研究自噬缺陷如何影响GC分化,作者进一步通过免疫荧光检测WT1蛋白水平,发现与对照组相比,6周龄EPG5基因敲除的GC中WT1明显积累(图6a)。此外,免疫印迹显示,在EPG5基因敲除的GCs中,WT1的数量显著增加(图6b,c)。作者推测在EPG5基因敲除的GCs中观察到的强WT1积累可能是由于WT1蛋白降解被破坏的结果。
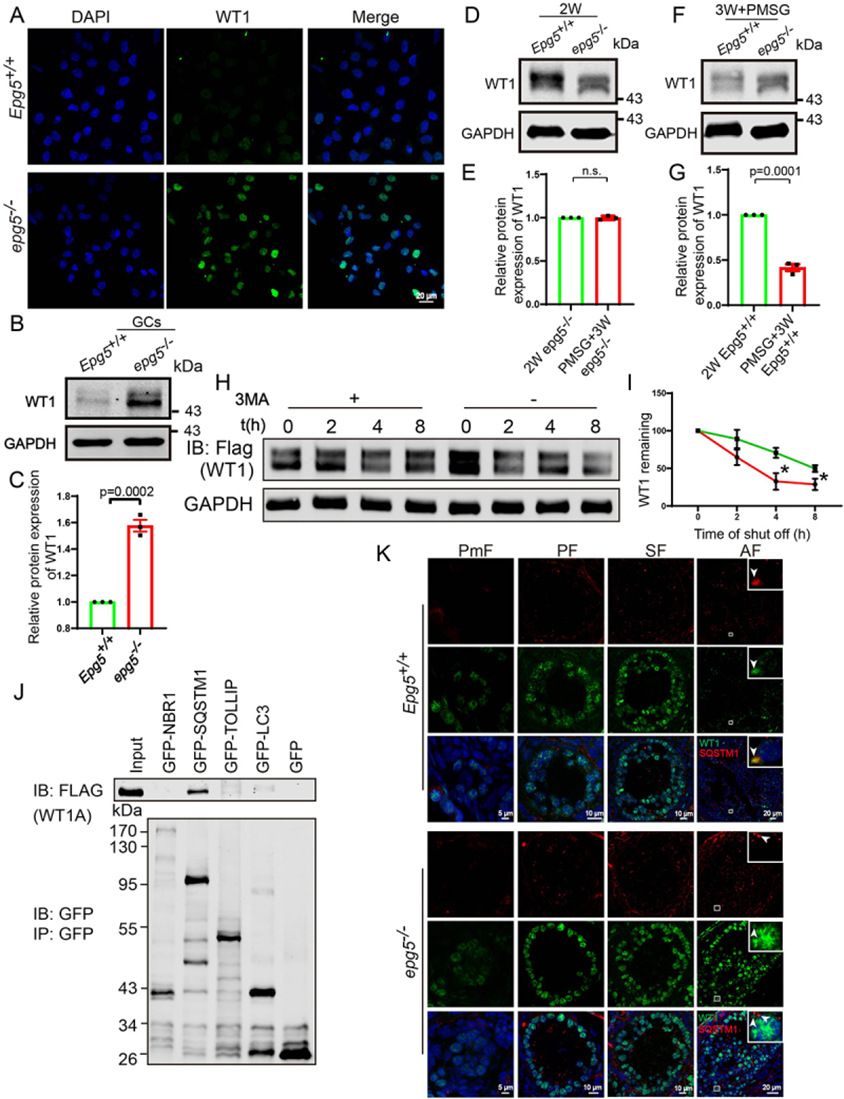
图6 GCs中WT1的降解依赖于自噬
就其背景而言,2周龄小鼠卵巢中的大多数卵泡是原发性或继发性的,其中WT1蛋白水平较高。随后,WT1水平开始从原发卵泡向窦卵泡和排卵前卵泡逐渐降低。作者构建了一个卵泡同步模型来检测敲除EPG5后WT1水平的变化。用马绒毛膜促性腺激素(eCG)/妊娠母马血清促性腺激素(PMSG)治疗的3周龄雌性小鼠卵巢中出现了排卵前卵泡。在eCG/pmsg处理的3周龄EPG5基因敲除小鼠卵巢中观察到WT1蛋白的积累,这与WT卵巢中观察到的WT1水平急剧下降明显不同(图6d,e,f,g)。此外,作者观察到EPG5基因敲除小鼠的心房卵泡中WT1没有降解。这些结果表明,EPG5基因敲除小鼠的初级和次级卵泡具有正常的WT1积累,但WT1降解受损导致WT1在中央区和排卵期前的积累异常高。
考虑到研究结果显示EPG5基因敲除GCs的自噬通量被阻断,这一现象破坏了WT1蛋白在心房和排卵前卵泡中的降解,作者对HEK293T细胞进行了一系列体外实验。将自噬/溶酶体抑制剂3-甲基腺嘌呤(3-MA)加入转染Wt1表达质粒的HEK293T细胞培养基中。在环己亚胺(CHX)追逐实验中,WT1的降解在3-MA处理后明显延迟(图6h,i)。此外,HEK293T细胞的共免疫沉淀实验表明,WT1可以与SQSTM1物理相互作用,但不能与NBR1、LC3和TOLLIP(toll相互作用蛋白)相互作用(图6j)。作者还发现,在对照小鼠中,WT1和SQSTM1在窦卵泡GC细胞细胞质中相对较大的点上相互共定位(图6k)。而在EPG5基因敲除的GCs中,SQSTM1没有与WT1共定位(图6k),这表明在EPG5基因敲除的GCs中,WT1降解存在缺陷。总的来说,这些结果表明WT1是通过自噬-溶酶体途径降解的。
7. 在敲除EPG5的GCs中,类固醇基因的表达可以通过敲除Wt1而部分恢复
WT1功能的丧失已被证明会导致颗粒前细胞向甾体生成细胞转化,因此作者检测了EPG5敲除GC中已知的甾体生成蛋白的水平。Gao等人(2014)证实Wt1抑制GCs中FSHR(卵泡刺激素受体)、hsd3b1/3β-羟基类固醇脱氢酶(羟基-δ-5-类固醇脱氢酶,3β-和类固醇δ异构酶1)、Cyp11a1和Cyp19a1等基因的表达。此外,Chen等人(2017)证明WT1通过直接结合Sf1启动子区域抑制Sf1表达,并表明WT1失活导致Sf1上调,进而激活类固醇生成程序。作者的免疫印迹显示,与eCG/pmsg处理的3周龄对照卵巢相比,eCG/pmsg处理的3周龄EPG5敲除卵巢中FSHR、HSD3B1、CYP11A1和CYP19A1水平降低(图7a-e)。为了探讨自噬对GC分化的影响,作者从5~6周龄的EPG5敲除小鼠和对照小鼠中分离培养GC。氯喹(Chloroquine,CQ)用于抑制GCs的自噬。cq处理的GCs免疫印迹显示LC3-II和WT1水平显著升高,与EPG5敲除的GCs相似(图7f,g,h)。此外,作者观察到EPG5敲除和cq处理的GCs中GC分化相关蛋白水平明显降低(图7f,i,j,k)。这些结果表明阻断自噬显著影响GC分化。为了验证EPG5敲除GCs中类固醇基因的下调是否与WT1积累有关,作者使用siRNA下调了EPG5敲除GCs中WT1的表达(图7l,m)。正如预测的那样,WT1的下调部分挽救了GC分化相关基因的表达(图7l,n,o,p,q),表明WT1是GC分化的主要自噬靶点。综上所述,这些结果支持阻断EPG5敲除GC的自噬导致WT1的异常积累,导致GC分化相关蛋白水平异常低。
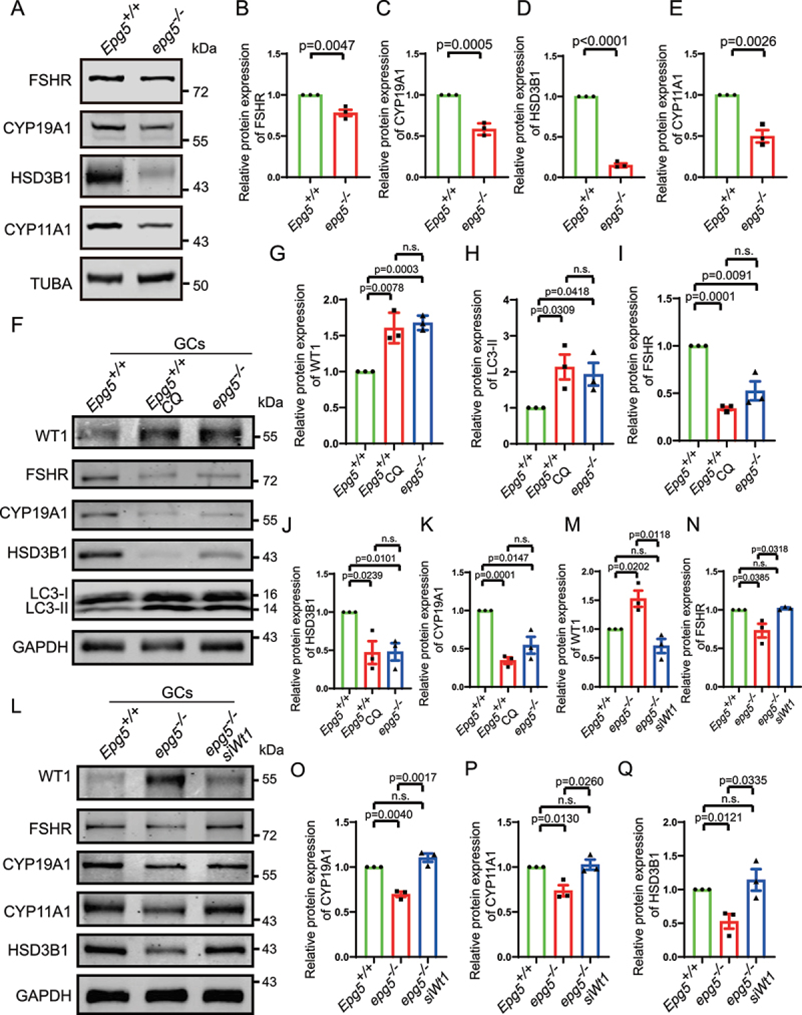
图7 Wt1敲低部分恢复了EPG5敲除GCs中类固醇基因的表达
实验方法
单细胞悬液制备、RNA测序和分析、超排卵和生育能力测试、组织采集和组织学分析、卵巢卵泡的定量、原代气相色谱分离、培养、转染和敲低、活细胞成像、免疫荧光染色、免疫组化染色、蛋白质印记分析、免疫沉淀、TUNEL检测
参考文献
Liu W, Chen M, Liu C, Wang L, Wei H, Zhang R, Ren Z, Chen Y, Luo M, Zhao J, Jiang H, Gao F, Li W. Epg5 deficiency leads to primary ovarian insufficiency due to WT1 accumulation in mouse granulosa cells. Autophagy. 2023 Feb;19(2):644-659.






