HNEAP通过抑制Atf7 mRNA的m5C甲基化调节心肌细胞坏死性凋亡
piRNA在多种心血管疾病中高表达。然而,它们在缺血/再灌注(I/R)损伤引起的心肌细胞死亡中的作用,特别是坏死性凋亡,仍然是未知的。在这项研究中,发现心脏坏死性凋亡相关的piRNA (HNEAP)通过靶向DNMT1介导的m5C甲基化激活Atf7 mRNA转录物来调节心肌细胞坏死性凋亡。缺氧/再氧化(H/R)暴露的心肌细胞和I/R损伤的小鼠心脏中HNEAP表达水平显著升高。缺失HNEAP可抑制小鼠心肌细胞坏死性凋亡,改善心脏功能。机制上,HNEAP直接与DNMT1相互作用,减弱Atf7 mRNA转录物的m5C甲基化,从而增加Atf7的表达水平。ATF7可进一步下调坏死性凋亡抑制剂Chmp2a的转录,导致Chmp2a水平降低,心肌细胞坏死性凋亡进展。研究结果表明,piRNA介导的m5C甲基化参与心肌细胞坏死的调控。因此,HNEAP-DNMT1-ATF7-CHMP2A轴可能是减轻缺血性心脏病坏死性凋亡引起的心脏损伤的潜在靶点。本文于2023年10月发表于“Advanced Science”(IF=15.1)上。
技术路线
 结果
结果
1)心肌坏死性凋亡相关piRNA的鉴定和表征
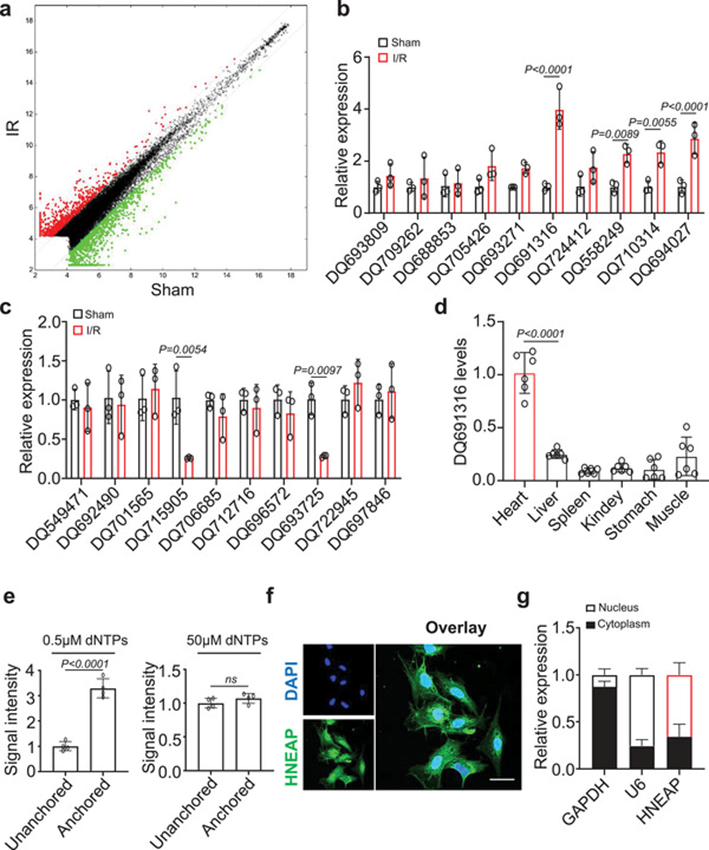
为了系统地识别和研究参与心肌细胞坏死性凋亡的piRNA的功能,我们首先进行了piRNA微阵列分析(图1a)。我们随机选择了20个piRNA(10个上调,10个下调),这些piRNA在微阵列结果中与假手术心脏的表达存在差异,并通过qRT-PCR验证了它们的表达水平。我们发现,与假手术组相比,4个piRNA显著上调,2个下调(图1b,c)。我们还检测了缺氧/再氧化(H/R)处理的心肌细胞中这些piRNA的水平(补充图)。其中,H/R损伤心肌细胞中piRNA DQ691316水平显著升高。接下来,我们检查了DQ691316在各种组织中的水平,发现它在心脏中更丰富(图1d)。与心脏成纤维细胞相比,DQ691316主要在心肌细胞中表达(补充图)。基于这些结果,我们假设DQ691316可能在再灌注性心脏损伤中具有潜在的调节功能,并选择DQ691316进行进一步研究。我们将这种未知的piRNA命名为心脏坏死相关piRNA (HNEAP),并发现HNEAP在3 '端由2’-O-甲基化组成(图1e)。随后,我们观察到HNEAP分布在细胞核和细胞质中(图1f, g)。
2)抑制HNEAP可阻断H/R诱导的心肌细胞坏死性凋亡
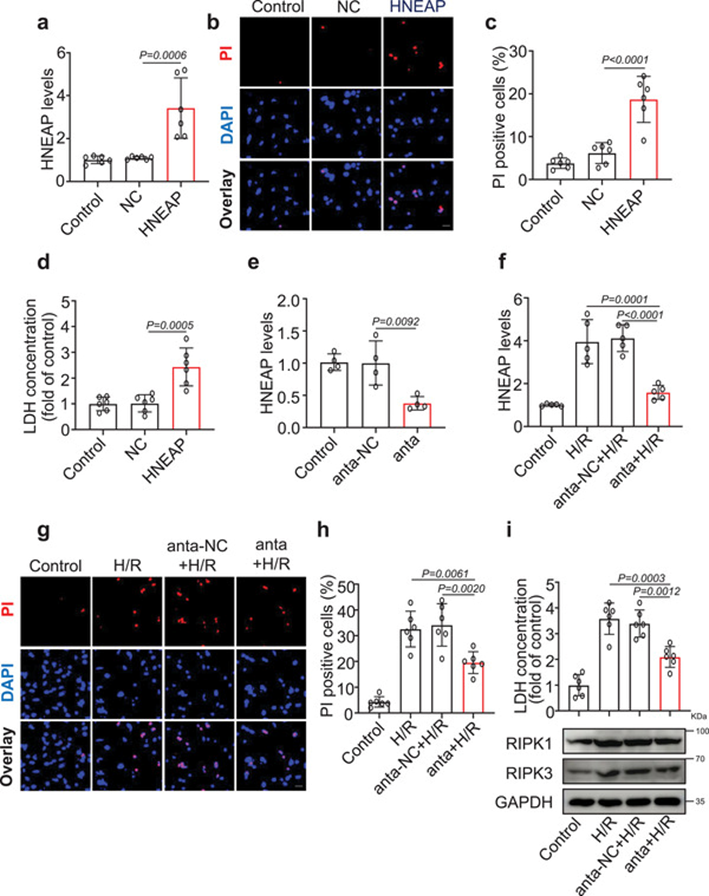
采用H/R诱导心肌细胞损伤模型,评价HNEAP在心肌细胞坏死性凋亡中的作用。HNEAP的强制表达(图2a)导致心肌细胞坏死性凋亡,表现为PI阳性心肌细胞数量增加(图2b, c),LDH活性增加(图2d)。相反,使用抑制剂敲低HNEAP(图2e, f)可减轻H/R诱导的心肌细胞坏死性凋亡(图2g-i)。综上所述,这些结果表明HNEAP参与心肌细胞坏死性凋亡的调节。
3)敲除HNEAP可减轻I/R损伤下的心脏损伤和坏死性凋亡
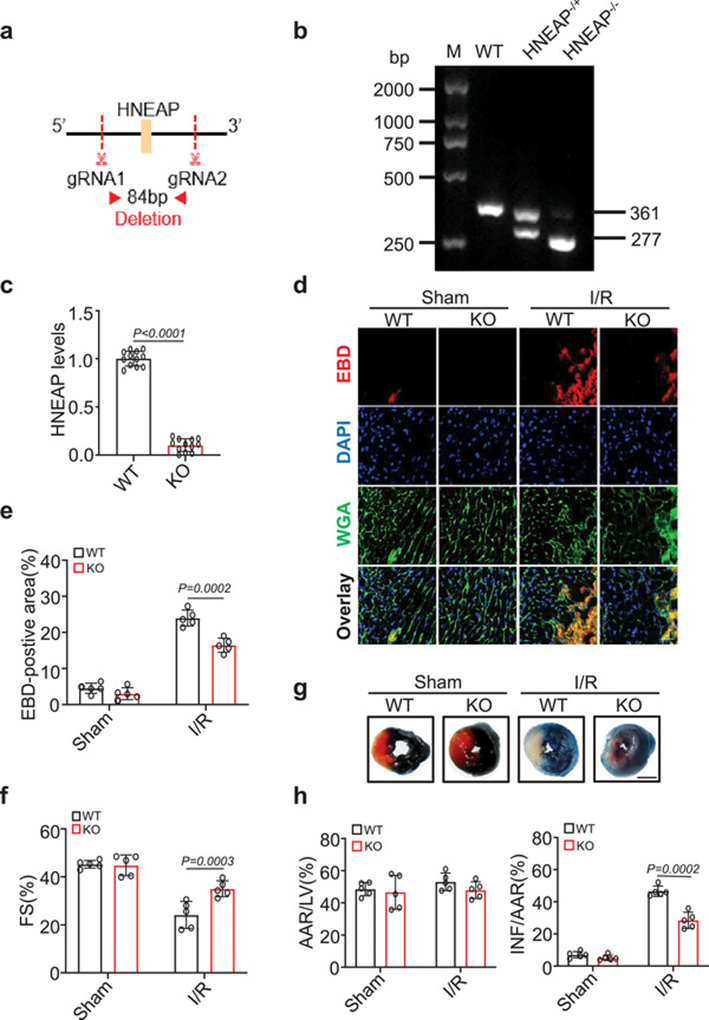
为了研究HNEAP是否与心肌损伤有功能相关性,我们使用CRISPR技术生成了HNEAP基因敲除(HNEAP-KO)小鼠(图3a)。基因分型(图3b)和qRT-PCR分析(图3c)证实KO小鼠中HNEAP缺失。为了全面了解HNEAP在I/R损伤中的作用,我们对小鼠心脏进行缺血1小时,再灌注3小时。在I/R损伤期间,HNEAP-KO小鼠心脏的心肌细胞坏死性凋亡明显减少(图3d, e),与I/R损伤的WT小鼠相比,HNEAP-KO小鼠的心室功能得到改善(图3f),梗死面积减少(图3g, h)。综上所述,这些数据表明HNEAP缺乏可减轻心肌细胞坏死性凋亡,减轻I/R损伤引起的心功能障碍。
4)HNEAP结合DNMT1并调控其m5C甲基化活性
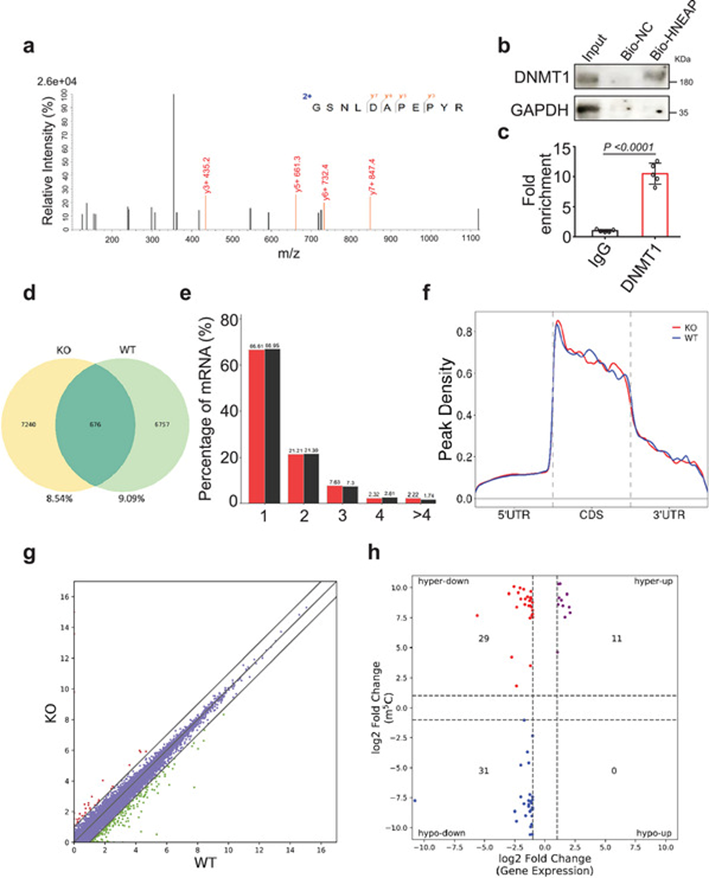
我们探讨了HNEAP调控心肌细胞坏死性凋亡的分子机制。我们使用生物素化的HNEAP进行了RNA下拉实验,并检测了心肌细胞中与HNEAP相互作用的表观遗传相关分子。采用LC-MS/MS对HNEAP结合蛋白进行鉴定。在这些蛋白中,我们选择了DNA甲基转移酶1 (DNMT1)(图4a)。使用生物素化的HNEAP进行体外RNA拉下实验,随后进行免疫印迹,证实HNEAP与DNMT1结合(图4b)。RIP后,我们进行qPCR,观察到HNEAP在DNMT1组中富集(图4c),表明HNEAP和DNMT1在体内相互作用。这些结果表明HNEAP与DNMT1相互作用,参与m5C甲基化的调控。为了研究HNEAP调控m5C修饰的机制,我们在HNEAP-KO和WT小鼠心脏中进行了m5C甲基化RNA免疫沉淀测序(meRIP-seq)。在所有检测到的m5C mRNA转录本中(图4d),超过一半包含一个m5C峰(图4e)。在WT和HNEAP-KO小鼠中,m5C峰主要出现在起始和停止密码子附近的编码序列(CDSs)中(图4f)。接下来,我们对HNEAP KO和WT小鼠心脏进行RNA-seq分析,探索m5C修饰与基因表达的关系(图4g),并将m5C峰值数据与基因表达的RNA-seq数据进行对比,将基因表达水平与m5C修饰水平进行关联(图4h)。
5)HNEAP抑制DNMT1介导的m5C修饰,促进Atf7 mRNA表达
接下来,我们分别对差异甲基化和差异表达基因进行MeRIP-qPCR和qPCR。其中,HNEAP-KO心脏中Atf7的m5C修饰水平显著升高,其表达水平显著降低(图5a-d)。相反,在HNEAP过表达的心肌细胞中,Atf7处的m5C富集减少(图5e),同时Atf7 mRNA和蛋白水平显著增加(图5f, g)。基于这些数据,我们选择Atf7作为m5C调控心肌细胞坏死性凋亡的候选靶点。接下来,我们研究了HNEAP上调Atf7表达的机制。在HNEAP-KO小鼠心脏中,与WT小鼠心脏相比,DNMT1与Atf7 mRNA的结合明显增加(图5h)。此外,心肌细胞中DNMT1的强制表达增加了Atf7 mRNA的m5C修饰水平,降低了Atf7 mRNA和蛋白水平,当HNEAP过表达时,这种作用被抑制(图5i-k)。综上所述,这些观察结果表明HNEAP通过DNMT1介导Atf7 mRNA的m5C修饰,这种甲基化修饰影响Atf7 mRNA的表达。
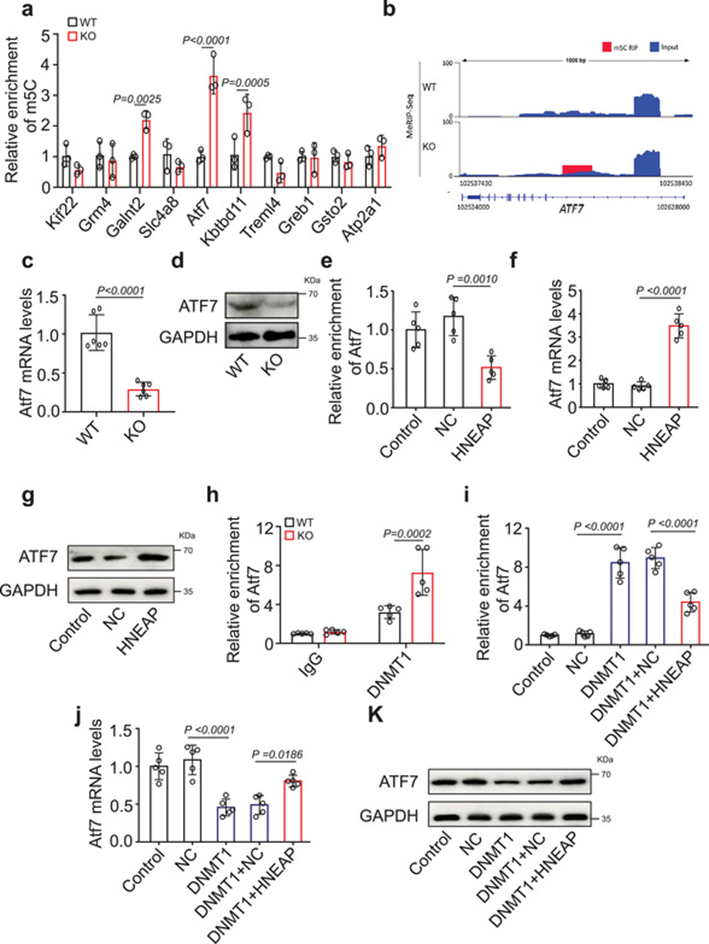
6)敲低Atf7可减轻心肌细胞坏死性凋亡
为了证实ATF7在心肌细胞坏死性凋亡中的调控作用,我们敲低了心肌细胞中的ATF7。Atf7敲低可阻断H/R诱导的心肌细胞坏死性凋亡(图6a-d)。在体内,I/R手术后Atf7 mRNA和蛋白水平显著升高(图6e)。Atf7敲除(图6e)减少心肌细胞坏死性凋亡(图6f, g),改善心室功能(图6h),缩小梗死面积(图6i, j)。综上所述,这些数据表明Atf7在心肌细胞坏死性凋亡的调控中起着至关重要的作用。
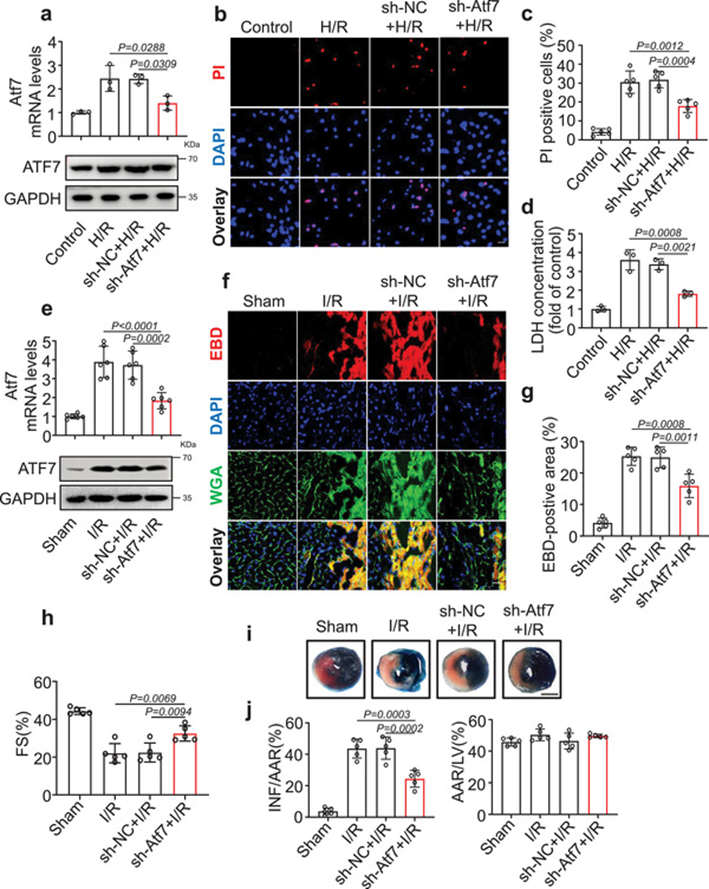
7)Atf7调节心肌细胞坏死性凋亡中CHMP2A的表达
为了研究Atf7的下游效应,我们评估了与坏死性凋亡相关的关键因子的表达水平。具体而言,心肌细胞中Atf7沉默后,关键坏死性凋亡分子CHMP2A的表达水平升高(图7a,b)。相反,Atf7过表达降低了Chmp2a的mRNA和蛋白水平(图7c),表明Atf7与Chmp2a呈负相关。接下来,我们评估Atf7是否直接靶向Chmp2a。我们构建了一个含有Atf7结合位点的Chmp2a启动子(图7d),并使用荧光素酶报告基因试验测试了Atf7对其活性的影响。Atf7敲除增加了Chmp2a结构体的荧光素酶活性(图7e)。H/R诱导的Chmp2a转录减少在心肌细胞中Atf7敲除后减弱(图7f)。这些结果表明Atf7通过直接结合其CHMP2A的启动子区域抑制CHMP2A的表达。此外,我们研究了HNEAP是否通过靶向CHMP2A调节心肌细胞坏死性凋亡。结果显示,与WT小鼠相比,HNEAP-KO小鼠心脏中Chmp2a mRNA和蛋白的表达水平显著升高(图7g)。HNEAP降低心肌细胞Chmp2a表达水平,诱导心肌细胞坏死性凋亡,而这些作用可通过敲除Atf7而逆转(图7h-j)。这些数据表明Atf7和CHMP2A是HNEAP调节心肌细胞坏死性凋亡的直接下游分子。
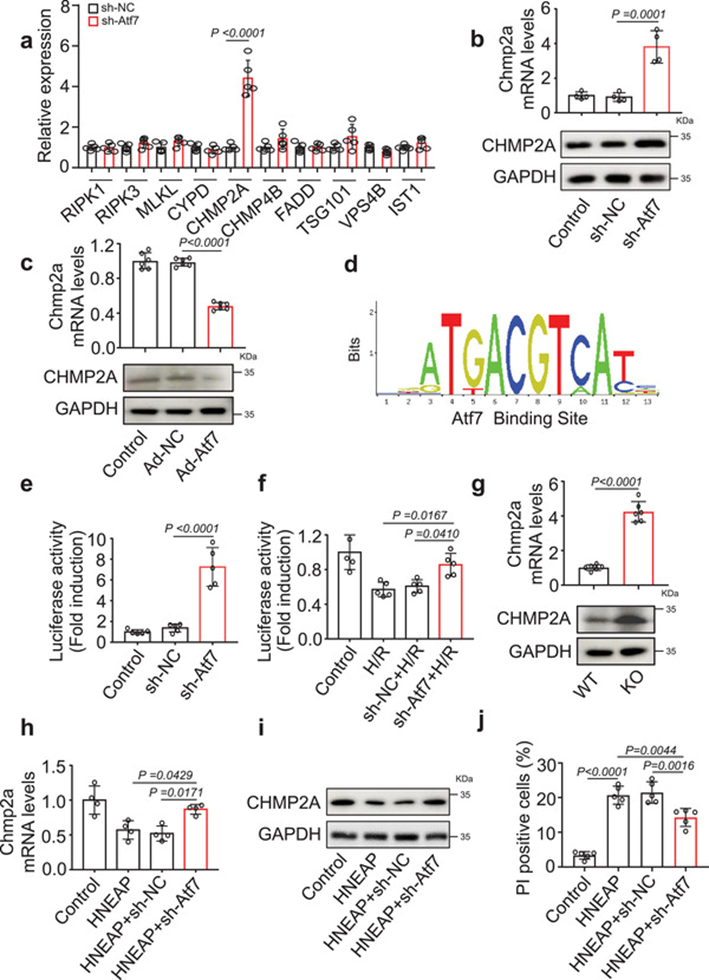
结论:
我们的研究表明,HNEAP介导的RNA m5C修饰显著有助于心肌细胞坏死性凋亡和心肌损伤。HNEAP可能是减轻I/R损伤后梗死面积和改善心功能的潜在靶点。
实验方法:
心肌缺血再灌注(I/R)损伤模型构建,Evans蓝色染料测定法,PI染色,LDH活性测定,TUNEL,RNA pull down,m5C-IP-qPCR,FISH,Western Blot,qRT-PCR。
参考文献:
Wang K, Li FH, Zhou LY, Zhao XM, Gao XQ, Liu CY, Li XM, Chen XZ, Zhao Y, Cheng XL, Wang RQ, Li RF, Zhang YH, Gao F, Tian JW, Wang K. HNEAP Regulates Necroptosis of Cardiomyocytes by Suppressing the m5 C Methylation of Atf7 mRNA. Adv Sci (Weinh). 2023 Dec;10(34):e2304329. doi: 10.1002/advs.202304329.






