摘要分享——巨噬细胞极化近期文献
巨噬细胞是一种极具异质性和可塑性的细胞,不仅在生理条件下具有重要作用,而且在炎症过程中也具有重要作用(包括引发炎症和消除炎症)。20 世纪 90 年代初,人们描述了巨噬细胞的两种不同表型:一种称为经典活化(或炎症)巨噬细胞(M1),另一种称为替代活化(或伤口愈合)巨噬细胞(M2)。目前已知,将巨噬细胞功能极化为两类是对巨噬细胞异质性和可塑性的过度简化描述;事实上,有必要考虑功能状态的连续性。总之,现有数据表明,巨噬细胞极化是一个多因素过程,其中可能涉及大量因素,从而产生不同的活化情况。一旦巨噬细胞采用了一种表型,它仍有能力继续变化以应对新的环境影响。极化的可逆性具有重要的治疗价值,尤其是在M1/M2失衡起致病作用的疾病中。
最新相关文章摘要:
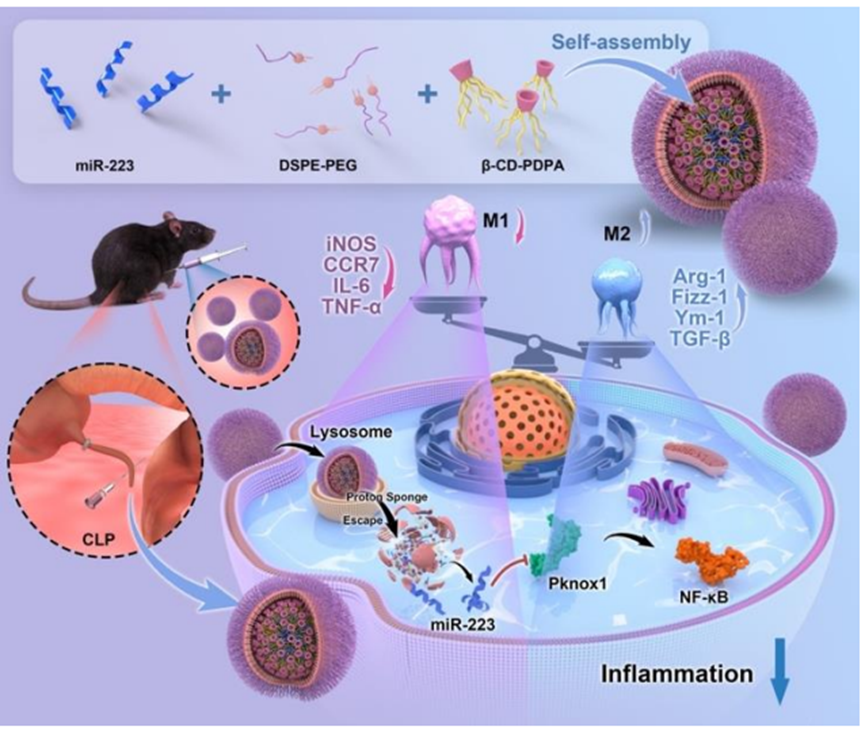
1. 一种基于环糊精的pH响应型micro RNA递送平台,以M1 到M2巨噬细胞极化为目标,用于败血症治疗

尽管抗感染治疗和输液复苏等对症和支持疗法在诊断和治疗败血症方面有所改进,但败血症的死亡率仍然很高。基于核酸的药物具有治疗潜力,但其稳定性差和输送效率低阻碍了其广泛应用。本研究证实,miR-223能将促炎的 M1 巨噬细胞极化为抗炎的 M2 巨噬细胞。研究人员合成并开发了一种 pH 值敏感的纳米给药系统,该系统由 β-环糊精-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯)/二硬脂酰磷脂酰乙醇胺-聚乙二醇(β-CD-PDPA/DSPE-PEG)组成,可靶向 M1 巨噬细胞,并将 miR-223 包封到纳米颗粒(NPs)中用于败血症治疗。NPs/miR-223 具有良好的生物安全性、稳定性和高输送效率,体外 pH 值响应性良好。体内研究表明,NPs/miR-223 能优先在炎症部位积聚和保留,从而减轻炎症,提高败血症小鼠的存活率,同时表现出理想的生物安全性。在机制上,NPs/miR-223 通过靶向 Pknox1 和抑制 NF-κB 信号通路的激活来调节巨噬细胞的极化,从而达到抗炎效果。综上所述,本文所述的 miRNA 递送载体为败血症治疗提供了一种新方法,并加速了核酸药物的发展。
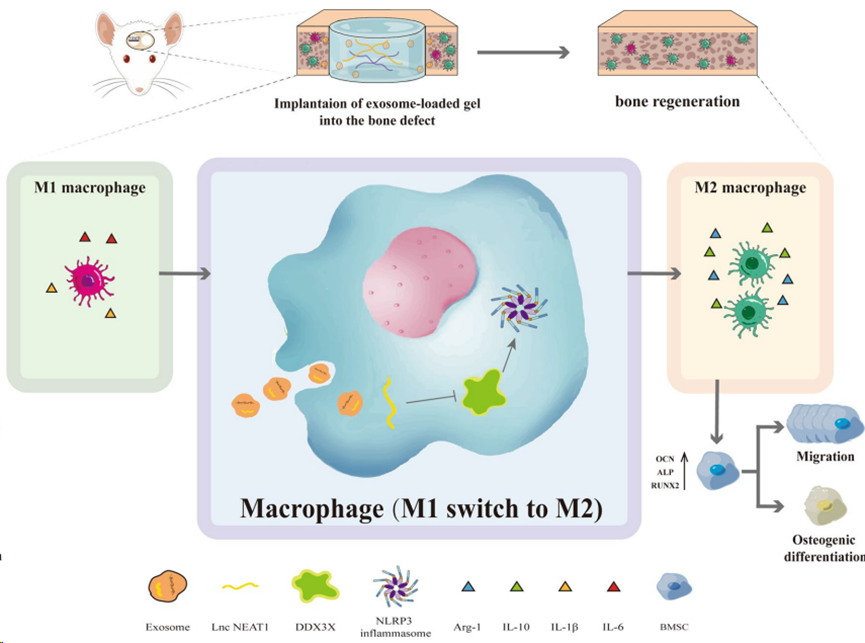
2. 内皮细胞外泌体Lnc NEAT1 通过DDX3X/NLRP3轴调节巨噬细胞极化,促进骨再生

背景:骨再生是一个复杂的过程,涉及骨生成和炎症之间的相互作用。微环境中的巨噬细胞在骨代谢中起着重要作用。大量证据表明,外泌体传递的 lncRNA 是各种生物过程,尤其是骨生成过程中细胞相互作用的关键纳米载体。然而,外泌体与巨噬细胞之间调控关系的内在机制尚待澄清。本研究旨在探讨人脐静脉内皮细胞(HUVECs)衍生的携带核富集转录本1(NEAT1)的外泌体在M2极化巨噬细胞介导的成骨过程中的作用,并阐明其潜在机制。
结果:我们证实,表达 NEAT1 的 HUVECs 衍生外泌体可显著增强 M2 极化,并减轻脂多糖(LPS)在体外诱导的炎症反应。此外,外泌体诱导的巨噬细胞条件培养基间接促进了骨髓间充质干细胞(BMSCs)的迁移和成骨分化。从机理上讲,携带 NEAT1 的外泌体显著降低死盒解旋酶 3X 链接(DDX3X)和类结核受体蛋白 3(NLRP3)的表达。RAW264.7细胞转染 DDX3X 过表达质粒后,NLRP3 蛋白水平明显升高。此外,外泌体中 NEAT1 的敲除在一定程度上抵消了 Exos 的上述作用。气囊大鼠模型的结果表明,HUVECs衍生的外泌体在体内显著增加了抗炎细胞因子(IL-10),降低了促炎细胞因子(IL-1β和IL-6),有助于改善LPS诱导的炎症。在大鼠腓骨缺损模型中,包裹在海藻酸盐/甲基丙烯酸明胶(Gelatin Methacrylate,GelMA)互穿聚合物网络(IPN)水凝胶中的 HUVECs 衍生外泌体可以促进骨再生、促进血管生成、增加 M2 极化巨噬细胞的浸润以及降低 NLRP3 的表达。
结论:HUVECs衍生的外泌体通过DDX3X/NLRP3调控轴诱导巨噬细胞M2极化,从而传递NEAT1缓解炎症,最终在体内借助藻酸盐/凝胶MA IPN水凝胶促进骨生成。因此,我们的研究为借助 HUVECs 衍生的外泌体包封复合水凝胶进行骨愈合提供了见解,在可预见的未来,这种水凝胶在骨组织工程中应用具有潜力。
3.FBXO38 调节巨噬细胞极化,控制癌症和结肠炎的发展

巨噬细胞是一种可塑性很强的细胞,可对癌症和自身免疫性疾病等多种病理情况进行不同的调节。为了应对各种刺激,巨噬细胞会激活不同的内在信号通路,并极化为不同的巨噬细胞亚群。我们的目标是找出可控制巨噬细胞极化并影响癌症或结肠炎发展的关键新效应因子。经肿瘤细胞上清液处理后,巨噬细胞的 Fbxo38 表达出现上调。随后,我们进一步发现,FBXO38在不影响m1型巨噬细胞极化的情况下,通过MAPK和IRF4信号通路上调m2型基因的表达,从而促进巨噬细胞的免疫抑制功能。研究发现,在巨噬细胞中缺失 Fbxo38 可阻止肿瘤发生,并防止 DSS 诱导的结肠炎。考虑到 FBXO38 在 T 细胞和巨噬细胞中对肿瘤发生的不同调控作用,我们认为全面了解 FBXO38 在不同细胞类型中的功能对其进一步转化应用至关重要。
4. M2巨噬细胞衍生的sEV可调节促炎性CCR2+巨噬细胞亚群,促进急性心肌梗死后的心脏修复

组织驻留的心脏巨噬细胞亚群介导急性心肌梗死(AMI)后的心脏组织炎症和修复。表达CC趋化因子受体2(CCR2)的巨噬细胞与M1极化巨噬细胞表型相似,具有促炎作用,并能将CCR2+循环单核细胞招募到梗死的心肌中。来自CCR2-巨噬细胞的细胞外小泡(sEV)表型类似于M2极化巨噬细胞,可促进抗炎活性和心脏修复。在本文中,作者从骨髓衍生的 M2 极化巨噬细胞中获得了 M2 巨噬细胞衍生的 sEV(M2EV),用于心肌内注射和重现 sEV 在缺血再灌注(I/R)损伤心脏中介导的抗炎活性。大鼠和猪分别接受了假手术、未经治疗的 I/R,或经过自体 M2EV 治疗的 I/R。M2EV 挽救了心脏功能,减轻了损伤标志物、梗死面积和疤痕面积。M2EV抑制了CCR2+巨噬细胞的数量,减少了单核细胞衍生的CCR2+巨噬细胞向梗死部位的招募,诱导了M1到M2巨噬细胞的转换,并促进了新生血管的形成。对M2EV micro RNA含量的分析发现了丰富的miR-181b-5p,它能调节巨噬细胞的葡萄糖摄取、糖酵解并减轻线粒体活性氧的生成。对 miR-181b-5p 进行功能性阻断不利于 M2EV 发挥有益作用,并导致其无法抑制 CCR2+ 巨噬细胞的数量和梗死面积。综上所述,这项研究表明,M2EV 可挽救心肌功能,改善心肌修复,并通过 miR-181b-5p 依赖性机制调节 CCR2+ 巨噬细胞,为无细胞疗法治疗 AMI 提供了一种选择。
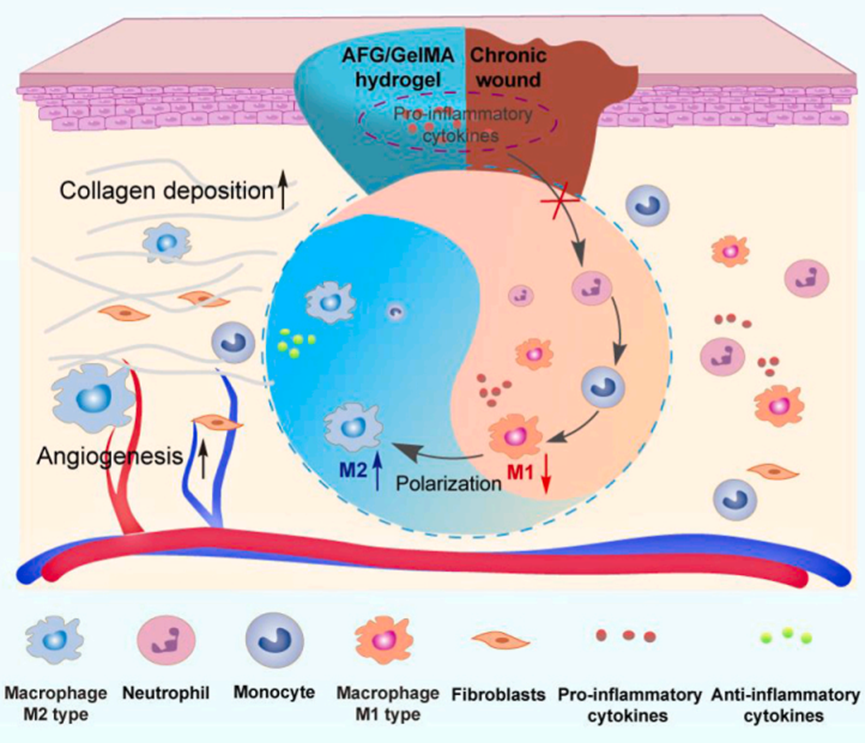
5. 蜗牛启发的 AFG/GelMA 水凝胶通过炎症细胞因子抑制和巨噬细胞极化加速糖尿病伤口愈合

糖尿病足溃疡(DFUs)是一种严重且快速增长的糖尿病并发症,但治疗糖尿病足溃疡仍是一项挑战,因为现有的疗法费用昂贵且反应不灵敏。最近,我们发现一种来自蜗牛粘液的天然粘合剂可以促进皮肤伤口愈合。其中,AFG 是蜗牛粘液中的主要生物活性成分,而 GelMA 则是模拟蜗牛粘液中蛋白质的支架。这种仿生物水凝胶具有很强的组织粘附性、强大的抗炎活性和良好的生物相容性。在 STZ 诱导的 1 型糖尿病大鼠和 db/db 小鼠模型(自发性Ⅱ型糖尿病小鼠)中,可生物降解的 AFG/GelMA 水凝胶在单次处理后可明显促进慢性伤口愈合。进一步的机理研究表明,该水凝胶能吸附促炎细胞因子,显著减轻炎症反应,并通过抑制 NF-ĸB 信号通路下调促炎细胞因子的表达,促进巨噬细胞向 M2 表型极化。综上所述,生物启发水凝胶能有效促进慢性伤口从炎症阶段向增殖阶段过渡。这些数据表明,AFG/GelMA 水凝胶是一种很有前景的治疗慢性糖尿病伤口的生物材料。
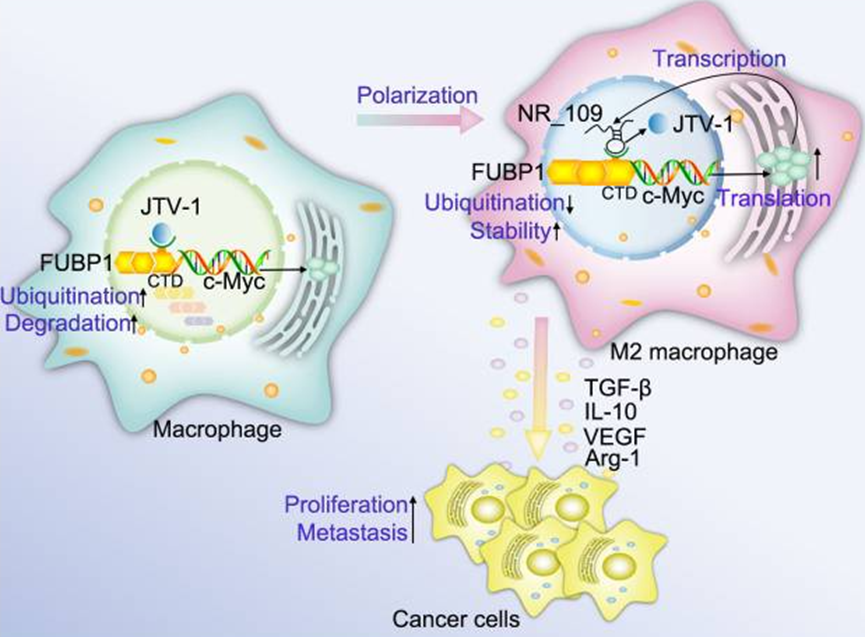
6. NR_109/FUBP1/c-Myc轴调控TAM极化并重塑肿瘤微环境以促进癌症发展

背景:肿瘤相关巨噬细胞(TAMs)是肿瘤微环境(TME)的主要组成部分,在肿瘤进展中发挥着重要作用。由于 TAMs 的异质性和可塑性,调节 TAMs 的极化状态被认为是一种潜在的肿瘤治疗策略。长非编码 RNA(lncRNA)与各种生理和病理过程都有关联,但 lncRNA 如何操纵 TAMs 极化状态的内在机制仍不清楚,有待进一步研究。
方法:微阵列分析用于描述参与THP-1诱导的M0、M1和M2样巨噬细胞的lncRNA谱。在这些差异表达的lncRNA中,我们进一步研究了NR_109在M2样巨噬细胞极化中的功能,以及NR_109介导的条件培养基或巨噬细胞在体外和体内对肿瘤增殖、转移和TME重塑的影响。此外,我们还揭示了NR_109如何与远上游元件结合蛋白1(FUBP1)相互作用,通过与JVT-1竞争性结合,阻碍泛素化修饰,从而调节蛋白的稳定性。最后,我们检测了肿瘤患者的切片,探究了NR_109与相关蛋白表达的相关性,显示了NR_109的临床意义。
结果:我们发现lncRNA NR_109在M2样巨噬细胞中高表达。敲除NR_109会阻碍IL-4诱导的M2样巨噬细胞极化,并显著降低M2样巨噬细胞在体外和体内支持肿瘤细胞增殖和转移的活性。从机理上讲,NR_109与JVT-1竞争结合FUBP1的C端结构域,阻碍泛素介导的FUBP1降解,激活c-Myc转录,从而促进M2样巨噬细胞极化。同时,作为一种转录因子,c-Myc 能与 NR_109 的启动子结合,增强 NR_109 的转录。临床上,在肿瘤组织的 CD163+ TAMs 中发现了 NR_109 的高表达,并且与胃癌和乳腺癌患者的临床分期呈正相关。
结论:我们的研究首次发现,NR_109通过NR_109/FUBP1/c-Myc正反馈环路在调节M2样巨噬细胞的表型重塑和功能方面发挥着关键作用。因此,NR_109在癌症的诊断、预后和免疫治疗方面具有巨大的转化潜力。