解码人类脊髓发育过程中转录因子的时空调控
脊髓是中枢神经系统的重要组成部分,促进感觉处理和运动表现。尽管它很重要,但人类脊髓发育的时空密码仍然难以捉摸。在这项研究中,作者引入了一种基于图像的单细胞转录因子(TF)表达解码空间转录组方法(TF-seqFISH)来研究TF在人类脊髓发育过程中的空间表达和调控。通过结合TF-seqFISH的空间转录组学数据和单细胞RNA测序数据,作者揭示了以组合TF为特征的神经祖细胞沿背腹侧轴的空间分布,以及沿中外侧轴控制神经元产生、迁移和分化的分子和空间特征。值得注意的是,作者观察到一个三明治状的兴奋性和抑制性中间神经元短暂出现在发育中的人脊髓背角。此外,作者整合了10x Visium的数据,确定了背角神经发生的早期和晚期波,揭示了脊髓背角的形成。作者的研究还揭示了运动神经元(MN)多样化的空间差异和分子线索,以及MNs和小胶质细胞中肌萎缩侧索硬化症(ALS)风险基因的富集。有趣的是,作者在发育中的人类脊髓中检测到疾病相关的小胶质细胞(DAM)样小胶质细胞群,这些小胶质细胞被预测易受ALS的影响,并参与TYROBP因果网络和对未折叠蛋白的反应。这些发现为人类脊髓的发育提供了时空转录组学资源,并为脊髓损伤修复和ALS治疗提供了潜在的策略。该文章于2024年1月发表在《Cell research》,IF:44.1。
技术路线:

主要研究结果:
1. 发育中的人类脊髓的时空转录组图谱
作者在这里提出了一个全面的时空细胞图谱的发展中的人类脊髓,基于两个来源的转录组数据在单细胞分辨率。第一个数据集是通过对发育中的人类脊髓的单个细胞进行scRNA-seq获得的,涵盖了妊娠早期至晚期早期(GW7-27),得到了217,636个单细胞的转录谱。第二个数据集由两组空间分解的转录组数据组成,分别使用10x Visium和单细胞转录组学方法获得,该方法量化了1085个TF的表达水平(TF-seqFISH)(图1a)。为了创建更全面的细胞景观,作者将scRNA-seq数据与先前研究的数据整合在一起,产生了横跨GW7至GW25的912,514个单细胞的转录普查(图1b)。作者的分析显示,在细胞分裂周期中存在三种细胞类型,分别标记为细胞周期-1、-2和-3,以及神经祖细胞(NPC)和In-INs、Ex-INs和MNs的神经元类型(图1b)。此外,作者在少突胶质细胞谱系中检测到不同的细胞类型,包括少突胶质细胞祖细胞(OPCs)、定向少突胶质细胞祖细胞(COPs)、髓鞘形成少突胶质细胞(MFOLs)和成熟少突胶质细胞(MOLs)(图1b)。在UMAP包埋中,作者还发现了星形胶质细胞和星形胶质细胞祖细胞(APCs),以及一组位于星形胶质细胞和少突胶质细胞谱系之间的胶质祖细胞(GPCs)(图1b)。此外,作者还发现了小胶质细胞、内皮细胞、周细胞、神经嵴细胞、中胚层细胞和室管膜细胞(图1b)。
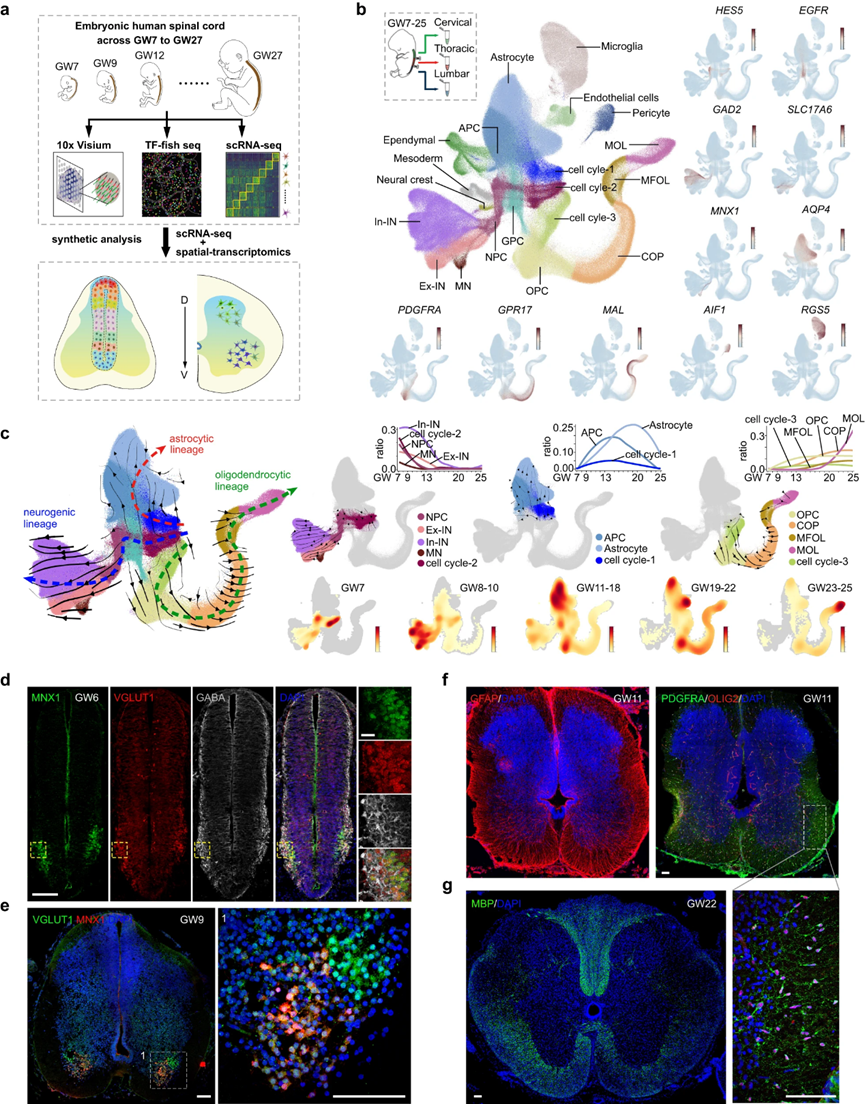
图1 人类脊髓发育过程中转录组变化的全面时空视图
接下来,作者采用RNA速度分析来推断导致神经元、星形胶质细胞和少突胶质细胞分化的谱系(图1c)。有趣的是,分化轨迹显示,细胞分裂(细胞周期-1/2/3)中的三个细胞组分别涉及星形细胞,神经元和少突胶质细胞谱系,具有明显的差异表达基因(DEGs)(图1)。这些发现表明,指导神经源性、星形胶质细胞或少突胶质细胞命运的遗传线索出现得很早,甚至在分裂细胞中也是如此。为了阐明发育中的人类脊髓中神经发生和胶质发生事件的时间,作者分析了GWs中涉及神经元、星形胶质细胞和少突胶质细胞谱系的细胞比例动力学(图1c)。作者的结果表明,发育中的人类脊髓的神经发生很早就开始了,因为神经源性分裂细胞(细胞周期-2)和NPC在GW7(作者的数据集中包含的最早阶段)的比例很高(图1c)。因此,丰富的神经元子代,包括MNs, Ex-INs和In-INs,根据其神经递质性质分类,早在GW7就可以检测到(图1c)。
相比之下,胶质源性事件则更具有滞后性。在星形细胞谱系中,星形细胞分裂细胞和APC在GW10左右可检测到,并在GW15达到峰值,而星形细胞在GW10左右逐渐增加,并在GW20达到峰值(图1c)。在少突胶质细胞谱系中,低分化状态的细胞类型,如少突胶质分裂细胞(细胞周期-3),OPCs和COPs,在GW10左右出现,此后逐渐增加(图1c)。分化良好的MFOLs和MOLs产生于GW18,并在GW20后显著增加(图1c)。免疫荧光染色进一步支持了发育中的人脊髓神经发生和胶质发生事件的这些时间规律,其中MNX1+ MNs, VGLUT1+ Ex-INs和GABA+ In-INs早在GW6就可以检测到,特别是在腹角,这表明人脊髓的神经发生可能比GW6更早发生(图1d)。此外,作者还探测了GW9时MNX1+细胞和VGLUT1+细胞的空间组织特征(图1e)。此外,作者对胚胎人脊髓胶质细胞分化相关基因进行了免疫染色。虽然在GW8时缺失,但在GW11时可以检测到丰富的GFAP+星形细胞和PDGFRA+OLIG2+ OPCs(图1f)。此外,在GW22时,脊髓白质中检测到MBP+少突胶质细胞(图1g)。综上所述,作者的研究结果表明,在GW6前后,人类脊髓神经发生的早期开始,而在GW10前后,神经胶质发生的迟滞性发生。
2. 利用TF-seqFISH揭示神经祖细胞的空间组织
为了研究人胚胎脊髓神经发生的分子特征和空间组织原理,作者对提取的神经细胞和神经元进行了scRNA-seq分析。通过实施无监督聚类、RNA速度分析和随后使用UMAP的可视化,作者确定了具有独特分子特征的不同神经元谱系(图2a)。发现每个谱系中的NPC具有较低的伪时间值,并充当起始细胞(图2a)。作者根据认可的TF标记物的特征表达对这些谱系进行了注释,定义了不同的NPC池dp1、dp2、dp3-6、p0、p0/1、pMN和p2/3,以及相应的神经元类型dI1、dI2、dI3、dI4、dI5、dI6、V0、V1、MN、V2和V3(图2a-c)。例如,dp1(例如MSX1, MSX2)和dI1(例如LHX2, LHX9和BARHL1)的小鼠TF标记物被发现在谱系1的人类NPC和神经元中特异性富集,因此作者将其分别定义为dp1和dI1(图2a-c)。作者在发育中的人类脊髓中鉴定了六种神经元谱系,每一种都具有独特的细胞组成。谱系1由dp1和dI1组成;谱系2描述了从dp2向dI2的分化;谱系3包括不同类型的dp3-6和dI3、dI4、dI5、dI6;谱系4显示p0-1向V1和V0分化;谱系5演示了pMN到MN的规范;和谱系6表明p2-3向V2和V3分化(图2a)。值得注意的是,由于分子特征的相似性,在小鼠中很容易区分的某些细胞类型在人胎儿脊髓中很难识别,例如dp3-6、p0-1和p2-3(图2a-c)。此外,作者观察到具有相同神经递质性质的神经元一致聚集在一起,在UMAP中,谷氨酸能dI3和dI5神经元紧密聚集在一起,GABA能dI4和dI6也是如此(图2a)。此外,作者在已知的遗传标记之外发现了新的基因表达模式。例如,作者发现在dI1中特异性表达CRABP1、LHX2和BARHL2,在dI5中特异性表达EBF1、EBF3和AJAP1,在dI6中特异性表达THSZ2、SST和CHL1,在MNs中特异性表达SLIT3、ISL1和ISL2(图2c)。对CRABP1和经典dI1标记物LHX2进行免疫染色,对SLIT3和MN特异性CHAT进行免疫染色。
在发育过程中,TF在调节神经祖结构域、细胞规格和脑区域的模式方面是必不可少的。在这项研究中,作者引入了一种基于图像的单细胞TF-seqFISH技术,在空间背景下检测1085个TF在发育中的人脊髓中的表达谱。作者的重点是解读心室区(VZ)驻留NPC内TF的空间分布。因此,作者进行了全面的分析,以确定适合进行TF-seqFISH的脊髓组织。作者首先对SOX2和NEUN进行免疫染色,以标记发育中不同阶段的人类脊髓中的NPC。结果表明,SOX2+ NPCs在GW8位点明显富集,聚集在增厚的VZ区在作者的研究中,NPC沿背腹轴的空间分布(dp1→dp2→dp3-6→p0/1→pMN→p2/3)与在发育中的小鼠和小鸡脊髓中的报道相似 (图2e)。
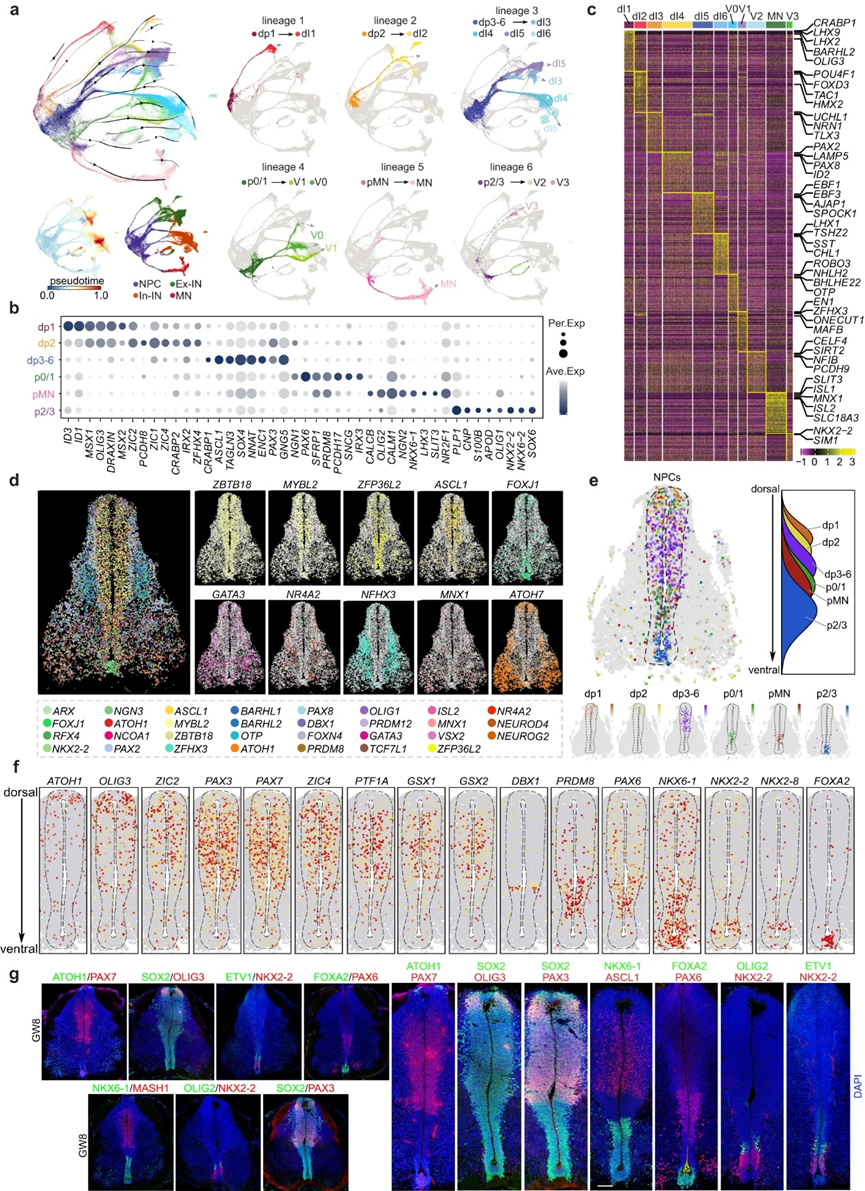
图2 发育中的人脊髓神经祖细胞的分子和空间特征
此外,作者还研究了人类祖细胞细分的TF结构的空间组织模式。作者的研究结果显示,在VZ区域,对确定祖细胞身份至关重要的TF在空间上表达受限(图2f)。其中,dp1特异性的ATOH1主要富集于背侧大部分细胞,而dp3-6富集的PAX3、PAX7、GSX1、GSX2广泛分布于中上部分(图2f)。此外,作者观察到腹侧受限的tf如PRDM8、NKX6-1、NKX2-2、NKX2-8和FOXA2的表达(图2f)。免疫染色证实了这些发现(图2g)。虽然作者的研究揭示了脊髓NPC在物种进化过程中空间基因表达的显著保守性,但作者也发现了人类脊髓发育的独特特征。例如,PTF1A广泛分布于人脊髓,其模式与dp3-6特异性GSX1、GSX2、PAX3和PAX7相似(图2f),不同于其对小鼠脊髓dp4神经元的限制这种差异可能解释了dp3-6祖细胞在人类脊髓中的不可区分性。
综上所述,作者的研究不仅基于scRNA-seq分析鉴定了转录多样性的NPC,而且阐明了NPC和TF在发育中的人脊髓表达的空间组织模式。作者的研究结果表明,尽管NPCs的空间转录组在物种进化中很大程度上是保守的,但人类胎儿脊髓的发育遵循着微妙的不同的遗传调控规则。
3. 利用TF-seqFISH揭示神经元分化和沿中-外侧轴迁移的空间动力学
在描述了NPC的空间转录组之后,作者试图阐明在发育中的人类脊髓中控制神经元组织的规则。为此,作者基于TF-seqFISH数据集中1085个TF的表达,采用无监督分类方法,鉴定出18个不同的分子簇(图3a,b)。通过基于相关性的分析,这些集群进一步划分为5个空间离散域(区域1-5)(图3a)。具体来说,集群2、7、9、11、12、16和18与区域1相关;第4组和第13组分配给区域2;聚类10与区域3相关;集群14和集群5位于区域4;集群1、3、6、8和17被分组在区域5(图3a)。根据发育中的人脊髓图谱,22区1位于中间,主要由分裂的祖细胞组成。区域2,一个与增殖区相邻的中间区(IZ),被指定为暂居区,包含预迁移神经元。背侧定位的地幔区3区由背角神经元迁移和定居组成。第4区是间地幔区(MZ),包含中间神经元和向腹角方向迁移的神经元。最后,腹角特异区5主要由固定的腹角神经元组成(图3a)。这些TF分类的空间区域为描绘神经解剖结构提供了有价值的分子基础。
然后,作者结合TF-seqFISH和scRNA-seq数据,计算了转录组全基因的表达谱。利用这些数据,作者还推导出了非TF基因的空间表达模式,为解码发育中的人类胎儿脊髓的细胞和分子组织原理提供了全面的资源。利用这个数据集,作者旨在解开人类脊髓中神经元迁移和分化的谜团。在背角,区域1、2和3高度层积(图3a)。DEGs和基因本体(GO)分析显示,1区的VZ细胞参与细胞分裂、维持神经干细胞群体和调节神经发生(图3c)。相反,侧定位区域2 (IZ)和3 (MZ)中的细胞与神经元分化、迁移、投射发育和脊髓背侧发育有关(图3c)。
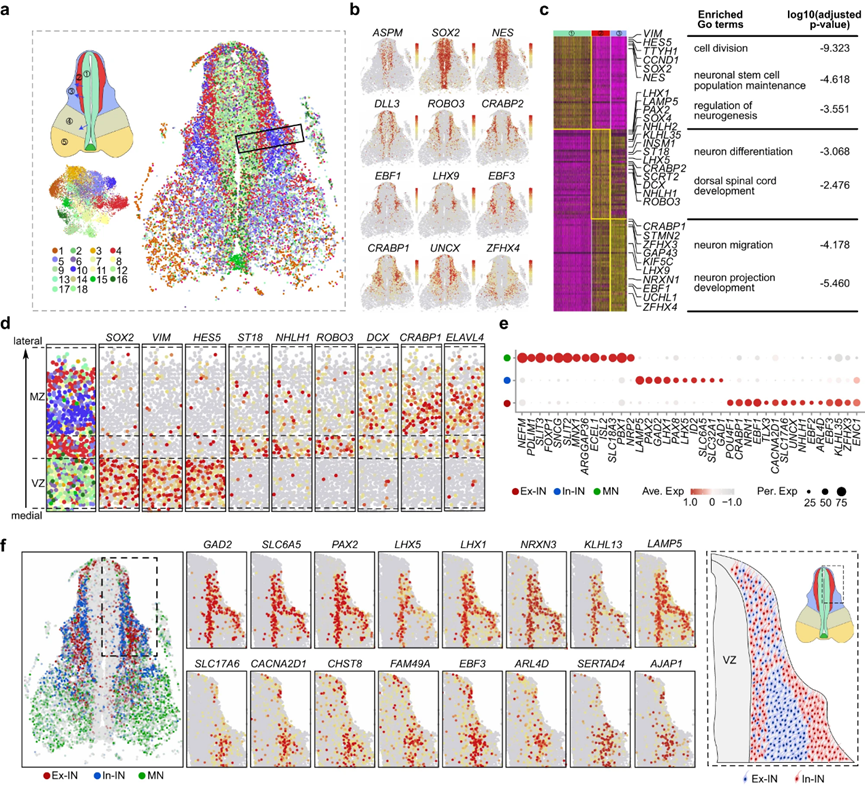
图3 发育中的人脊髓中外侧组织模式的空间分辨特征
从增殖祖细胞到有丝分裂后神经元的转变受到不同分子的严格调控。例如,作者发现SOX2、VIM和HES5在VZ区(1区)富集,而ST18、NHLH1、ROBO3和INSM1在空间上仅限于IZ区(2区)。相比之下,DCX、CRABP1和ELAVL4的表达仅限于更偏侧的MZ区(3区)(图3c,d)。在区域2细胞中富集的基因中,NHLH1和INSM1在晚期神经元祖细胞和新生神经元中短暂表达,进一步表明了尚未完全分化并到达最终位置的区域2细胞的新生身份。因此,通过探测区域2的特异性基因表达,作者在发育中的人脊髓的IZ中发现了一组有丝分裂后神经元的早期标记,包括NHLH1、INSM1、ST18、ROBO3、KLHL35等。此外,作者在侧MZ(3区)较晚、更成熟的有丝分裂后细胞中发现了表达的基因,如CRABP1、STMN2、DCX和ZFHX3(图3c、d)。然而,腹侧增殖性VZ区比其背侧对应区薄得多,可能是由于腹侧区域更早的神经发生(图3a)。
总的来说,作者的TF-seqFISH数据集为理解发育中的人类脊髓神经解剖划分的细胞和分子基础提供了宝贵的资源。此外,作者的数据集提供了对神经元生成、迁移和分化背后的空间和分子程序的详细理解。
4. 发育中的人脊髓的脊髓背角发育
脊髓神经元可以根据其神经递质特性进一步分类,它们在神经元功能和电路连接中起着至关重要的作用。脊髓中有三种主要类型的神经递质定义的神经元:谷氨酸能Ex-INs、GABA能/甘氨酸能In-INs和乙酰胆碱能MNs。通过对scRNA-seq数据集的DEG分析,作者确定了区分这些神经元类型的特征分子谱,如MNs中的NEFM、SLIT2、SNCG、ECEL1和NRP2, In-INs中的LAMP5、PAX2、PAX8和ID2, Ex-IN中的TLX3、NRN1、EBF3、CACNA2D1和CRABP1(图3e)。为了进一步研究这三种神经元类型的空间分布,作者将TF-seqFISH细胞映射到转录组分类中,并分配了最匹配的神经元身份。结果表明,MNs主要分布在腹角,而Ex-IN和In-INs主要分布在背角和中间部分(图3f)。有趣的是,在GW8时,Ex-INs被夹在背角的两个空间分叉的In-INs群之间(图3f)。值得注意的是,位于VZ附近的In-INs与一些Ex-INs呈现混合模式(图3f)。Ex-INs和In-INs富集基因的空间表达谱也揭示了这种独特的组织模式,这种组织模式在整个脊髓中保持一致(图3f)。在成人脊髓中,背角神经元被组织成不同的层,接受特定的感觉输入人类胎儿脊髓背角中Ex-INs和In-INs的三明治状组织可能是形成适当的回路连接以感知环境和内部信号的中间状态。
接下来,作者的目标是揭示在广泛的时间范围内背角发育的分子和细胞事件。为此,作者对不同胎龄(GW8、GW9、GW13、GW27)的人脊髓组织发育进行了10× Visium实验,丰富了空间转录组数据资源。利用无监督聚类,作者根据分子特征和空间位置对13个具有分子特征的斑点簇进行了分类,包括腹侧灰色细胞、背侧灰色细胞、中间灰色细胞、外侧皮质脊髓束、分裂细胞、室管膜、中胚层、背根神经节(DRG)细胞(仅从GW8和GW9的组织中捕获)、背侧和腹侧胶质细胞以及两组MNs(图4a,b)。作者发现GW8样本中没有一组斑点,主要由群集12和群集13组成(用红色圆圈勾画)(图4c),当空间可视化时,这组斑点位于背角的表面(图4d)。在GW9、GW13和GW27处,除了一些具有Cluster 8身份的黄色斑点外,作者还可以在背角处检测到Cluster 12和Cluster 13的斑点(图4d)。然而,在GW8时,背角仅能检测到Cluster 8的斑点,而Cluster 12和13的斑点则完全缺失(图4c,d)。作者的结果表明,在GW8时或之前出现了早生神经元(Cluster 8),在GW8后出现了晚生神经元(Cluster 12和13)。GW9时晚生神经元的出现与发育中的人类脊髓背角的扩张相吻合,表明它们在背角构建中的重要性(图4d)。
此外,作者还进行了DEG分析,以探测背角中早生和晚生神经元的分子特征。作者发现,簇8中早生的神经元对CRABP1、RBP1、ROBO3、MEIS2和OTP具有特异性,而簇12和13中晚生的神经元则表现出独特的分子特异性(图4e)。集群12具有ENC1、SST、EBF3、GRIA2和PCDH8的特征,而集群13具有MAF、MAFA、CCK和RORB的特征(图4e)。通过分析其在所有不同簇中的表达,也确定了CRABP1在簇8中的特异性富。CRABP1和DRGX的空间表达谱进一步说明了背角的模块化结构,它们分别代表了早期和晚期的神经元(图4f, g)。值得注意的是,DRGX在GW8时特异性地在DRG细胞中表达丰富,而在脊髓中没有表达(图4f)。通过整合scRNA-seq和10x Visium数据集,作者还鉴定了集群8、12和13的神经元身份。Cluster 8中早出生的神经元主要定位于dI1、dI2、dI3和dI4神经元类型,而Cluster 12和13中晚出生的神经元主要定位于dI5和dI6神经元类型(图4h)。此外,作者对GW8和GW9的scRNA-seq数据集的分析显示,大多数dI5和dI6神经元起源于GW9,这表明这些神经元具有晚出生的身份。有趣的是,与图1c-g所描述的观察结果一致,作者的研究还揭示了背侧和腹侧胶质细胞的缓慢出现(图4c)。
因此,通过采用空间视角,作者对支撑人类脊髓背角发育的细胞和分子机制进行了全面的研究(图4i)。在胚胎初期,作者在背角中发现了典型的背腹层状神经元结构,这为体感觉回路的构成奠定了基础。利用空间转录组学数据集,作者不仅确定了发育中的人类脊髓背角的早期神经源性事件,而且还确定了延迟的事件,并将GW8时代归因于背角个体发育的关键时间间隔。
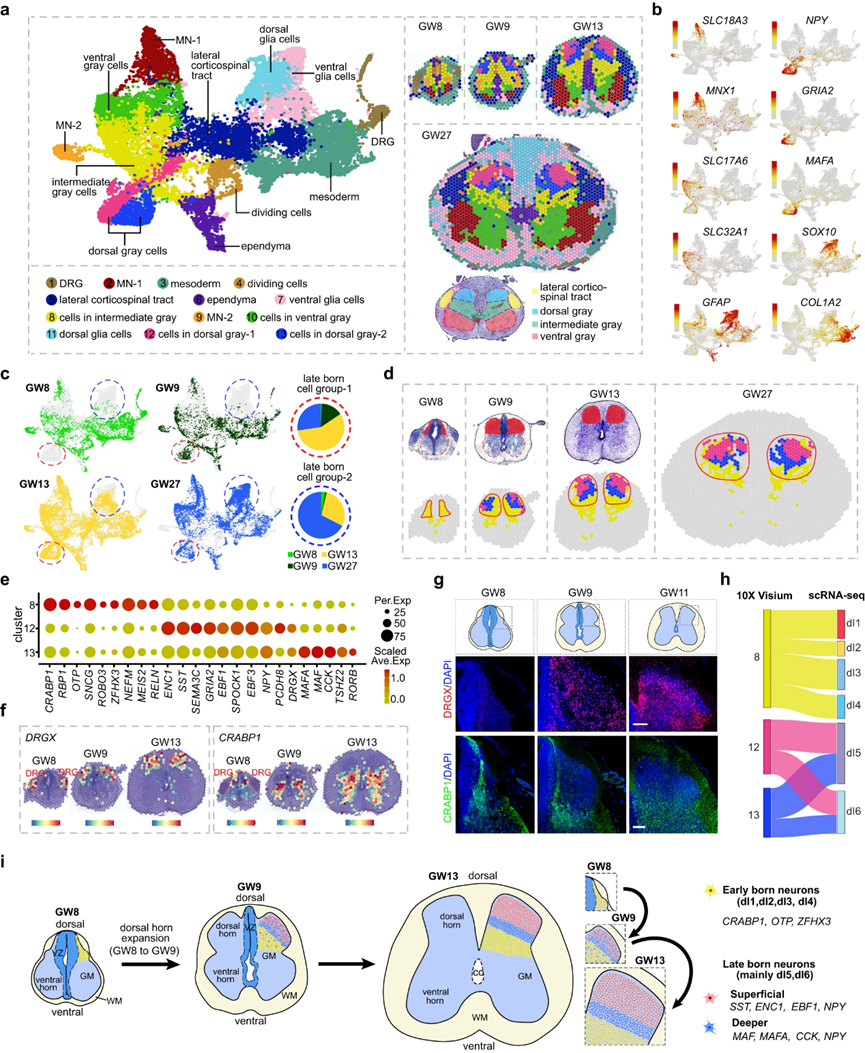
图4 探索人类脊髓背角发育的空间、细胞和分子基础
5. 人类脊髓发育过程中MNs的分子和空间多样性
脊髓运动神经元在形态、连通性和功能特征上表现出多样性。MN多样性的一个值得注意的方面是它们分为不同的柱状群,每个柱状群在脊髓内占据特定的背侧位置,并支配独特的外周靶组织阵列。MN柱状群主要有四大类:LMC(外侧运动柱),可进一步分为外侧(LMCl)和内侧(LMCm)子柱;节前运动柱(PGC);轴下运动柱(HMC)和正中运动柱(MMC)(图5a)。
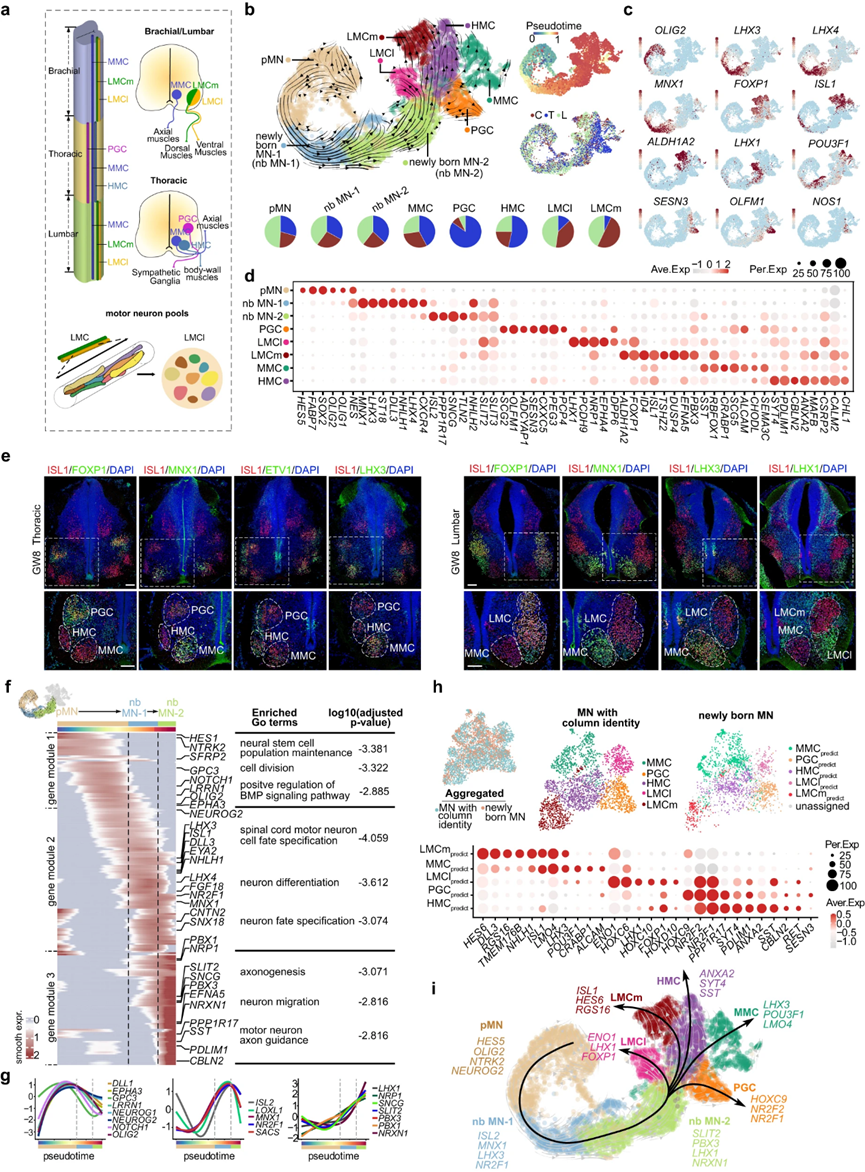
图5 MN的分子程序占早期规范的多样性
在阐明了控制背角神经元回路形成的复杂细胞和分子原理之后,作者将努力揭示驱动MN多样化的因素,这是对感知到的外周信号做出反应的唯一手段。为了实现这一目标,作者深入研究了包含MN及其祖细胞的scRNA-seq数据集,根据无监督聚类和显著的基因表达模式,将其进一步分类为MN的祖细胞(pMNs)、新生MN (nb MN-1和nb MN-2)和具有不同列身份的MN (LMCm、LMCl、MMC、PGC和HMC)(图5b-d)。利用RNA速度推断发育轨迹,揭示了MNs从pMN到新生MN到具有不同柱身份的MN的分化(图5b)。还确定了每种细胞类型的节段偏好,即颈、胸和腰椎来源(图5b)。有趣的是,作者的分析揭示了MNs在GW7-8的早期柱状特性,这是作者研究中最早的时间点(图5b-d)。此外,作者使用免疫染色验证了柱状身份的早期规范,以及它们的片段偏好(图5e)。作者的研究还发现了新的柱特异性基因表达模式,为作者对柱特异性MNs的理解增加了一个新的维度。例如,作者发现TAC1、NRP1和NTRK2在LMC中富集,TSHZ2、DUSP4和ID4在LMCm中富集,PCDH9、DPP6和OPRK1在LMCl中富集,CXXC5、PEG3和CELF4在PGCs中上调(图5d)。
不同的TF表达谱与针对不同目标肌肉群的MN池有关作者在LMC神经元中鉴定出具有独特转录组特征的亚群。这些亚组被称为假定的运动神经元池,通过评估池特异性基因的独特表达来识别,如NKX6-1、NKX6-2、ETV1和ETV4。此外,作者还揭示了内脏MNs(主要是胸椎衍生的交感PGCs)和躯体MNs(包括LMCm、LMCl、MMC和HMC)之间的转录差异,并通过GW13时颈椎和胸椎切片的空间转录组验证了这一点。因此,作者的分析揭示了推测的MN柱和MN池的早期转录规范。在发育过程中对轴突轨迹和神经-肌肉连接至关重要。然而,在作者的数据集中,体细胞MNs并没有表现出明确的α和γ亚型的亚聚类这一观察结果可能归因于作者数据集的特征,因为它主要包括来自早期胚胎阶段的MNs。
为了研究驱动MN分化的分子程序,作者首先分析了颈椎、胸椎和腰椎节段之间的DEG,特别是头尾侧HOX的表达,这被认为是指导不同节段的MN柱和池身份。接下来,利用发育轨迹推断,作者揭示了pMN分化背后的分子级联,pMN分化分为三个不同的基因模块,分别富集于pMN、nbMN-1和nbMN-2(图5f)。功能推断显示,包含DLL1、EPHA3、OLIG2、NEUROG1、NEUROG2和GPC3等基因的基因模块1参与神经干细胞群体的维持和分裂。基因模块2由LHX3、ISL1、MNX1、NR2F1、CNTN2等基因组成,参与调控脊髓MN细胞命运,促进神经元分化。最后,基因模块3由SLIT2、LHX1、PBX1、PBX3和NRXN1等基因组成,与细胞增生、MN轴突引导和神经元迁移有关(图5f、g)。作者的TF-seqFISH数据显示了这些pMN、新生MN-1和新生MN-2富集基因沿中外侧轴的空间分布。此外,通过将新生MNs与不同列中的MNs进行配对整合,作者确定了新生MNs具有假定的MMC、PGC、HMC、LMCl和LMCm命运,从而揭示了新生MNs中列特异性转录规范(图5h)。新生MNs的无监督子簇与列特异性转录特征之间的强大相似性进一步支持了这一点。
总的来说,作者的研究揭示了MNs在组织(MN柱和池)和功能(体细胞MNs和内脏MNs)背景下的早期转录组特征。此外,作者的研究结果通过揭示控制MN多样化的转录程序,为将干细胞编程为特定MN亚型提供了路线图(图5i)。
6. 人类脊髓发育过程中的星形细胞发生
对人类脊髓星形胶质细胞异质性的调控机制的认识仍然有限。为了解决这个问题,作者将细胞周期1细胞与指示星形细胞命运的分子线索结合起来,以及星形胶质细胞和APC。采用无监督聚类,作者确定了两组不同的APC, APC-1和APC-2,以及五个星形胶质细胞亚簇(图6a)。然后,根据原生质星形胶质细胞(PA)和纤维状星形胶质细胞(FA)的标记基因SLC1A2和GFAP的表达,作者将5种不同的星形胶质细胞类型分别标注为FA1-2和PA1-3(图6a)。为了进一步研究FA和PA在发育过程中是如何分化的,作者利用RNA速度分析在转录组水平上推断了人类脊髓星形胶质细胞的分化轨迹。作者观察到细胞周期-1作为起始细胞分化为APC-1和APC-2,然后分别产生FA和PA(图6a)。这与APCs和星形胶质细胞成对整合的结果一致,如Sankey图所示(图6b)。这些发现表明FA和PA起源于不同的祖细胞群,这使作者研究了APC-1和APC-2中活性差异的遗传程序(图6c)。作者的分析揭示了NTRK2、GFAP、ZFP36L1和IGFBP5在APC-1中的特异性表达,以及GLUL、MT3、APOE和SLC6A11在APC-2中的独特表达,为指导不同类型星形胶质细胞分化的分子密码提供了重要的见解(图6c, d)。此外,作者发现了定义FA和PA的新基因,如CRYAB、SAT1和ID3在FA中的特异性表达,以及MT3、ALDOC、CST3和ATP1B1在PA中的特异性表达,这通过空间转录组数据集和免疫染色结果进行了验证(图6e, f)。综上所述,作者的研究结果表明,人类脊髓中的FA和PA来自具有不同基因表达谱的不同细胞系。
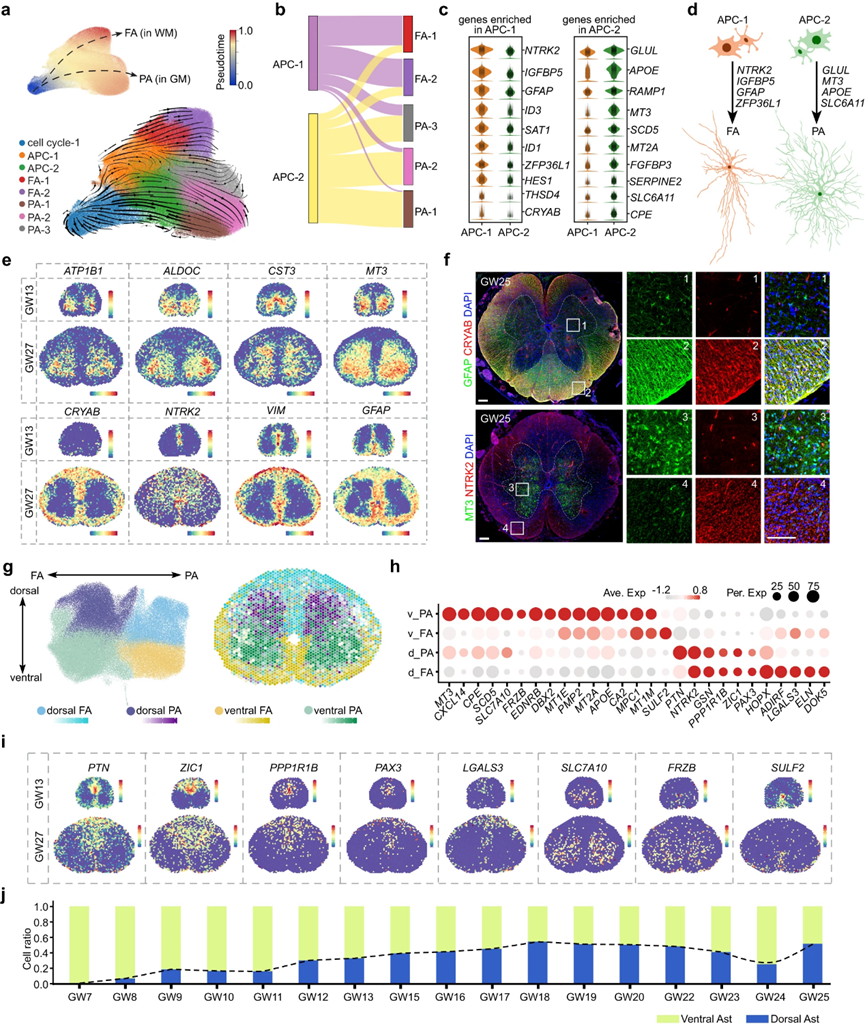
图6 发育中的人脊髓中星形胶质细胞的空间异质性
为了探索人类胎儿脊髓中星形胶质细胞的空间特征,作者对星形胶质细胞进行了无监督聚类,并鉴定出具有独特转录组谱的四种不同组:背侧FA、背侧PA、腹侧FA和腹侧PA(图6g,h)。使用GW27的10× Visium数据,作者在空间上可视化了这些转录不同的星形胶质细胞亚型(图6g)。有趣的是,作者发现一些参与指定神经元空间命运的基因,如PAX3和ZIC1,也在星形胶质细胞中表达,这表明神经元和星形胶质细胞的空间规范可能在一定程度上共享共同的转录编码(图6h,i,2f)。此外,作者分析了不同发育阶段背侧和腹侧星形胶质细胞的比例,并观察到腹侧星形胶质细胞在早期胚胎阶段首次被检测到。随后,背部星形胶质细胞的比例增加,并在大约GW16时与腹侧星形胶质细胞大致相等(图6j)。这些发现为人类胎儿脊髓中星形胶质细胞发育的空间动力学提供了重要的见解,并提出了星形胶质细胞发育与神经元之间的潜在联系。
7. 揭示ALS细胞类型易感性的分子基础
肌萎缩侧索硬化症(ALS)是一种毁灭性的神经退行性疾病,其特征是逐渐丧失MNs,导致肌肉无力、萎缩、瘫痪,最终导致呼吸衰竭和死亡尽管付出了巨大的努力,ALS发病机制的潜在分子机制仍然不完全清楚。为了解决这个问题,作者对发育中的人类脊髓的scRNA-seq数据集与GWAS数据集进行了综合分析,其中包括29,612名ALS患者和122,656名对照作者应用单细胞疾病相关评分(scDRS)来评估scRNA-seq数据中单个细胞的多基因疾病富集情况。作者的分析显示,小胶质细胞、内皮细胞、MNs和周细胞是GWAS鉴定的ALS风险位点最脆弱的细胞类型(图7a)。通过将ALS基因列表与这四种细胞类型中的DEGs交叉,作者确定了在这四种易感细胞类型中特异性富集的ALS风险基因:MNs(157个基因)、小胶质细胞(70个基因)、内皮细胞(92个基因)和周细胞(29个基因)。鉴于MN功能障碍和死亡是ALS的主要标志,作者首先关注了MN中富集的ALS风险基因(图7b)。在这些MN富集的ALS风险基因中,MAPT、OPTN、NRXN3、UNC13A、KIF5A等基因在ALS中的作用已经在前人的研究中得到了探讨,为作者的分析提供了证据支持。作者的氧化石墨烯富集分析表明,在MNs中富集的风险基因主要参与细胞投射组织、化学突触传递、跨突触信号传导和突触信号传导的调节等过程(图7b,c)。
除了MNs外,作者的研究还深入了解了非神经元细胞,特别是小胶质细胞在ALS发病机制中的作用,这与该疾病的非细胞自主病理一致(图7a)。作为中枢神经系统的主要常驻免疫细胞,小胶质细胞表现出免疫特性,根据不同的情况,它既可以是神经保护细胞,也可以是神经毒性细胞。虽然越来越多的证据表明小胶质细胞在ALS中起作用,但它们对病理的确切贡献尚不清楚。为了更好地了解发育中的人类脊髓中的小胶质细胞景观,作者用独特的分子特征表征了异质小胶质细胞类型。其中包括表达MKI67的增生性小胶质细胞,表达表达稳态基因的小胶质细胞,如CX3CR1、TMEM119和CSF1R,以及具有APOE、SPP1和DDIT4等遗传特征的潜在活性状态的小胶质细胞(图7d-f)。此外,作者确定了表达少突胶质细胞标记物MBP的小胶质细胞(图7e),这在其他研究中也被记录在小鼠脑白质发育以及小鼠脊髓中。IBA1和MBP的免疫染色进一步证明了MBP+小胶质细胞存在于发育中的人脊髓中,并优先分布在白质中(图7f)。除了不同的小胶质细胞类型,作者还鉴定了四个表达髓细胞标记物的髓细胞簇,如LYZ、LYVE1、S100A4和S100A9。作者的目的是研究哪些小胶质细胞亚型优先参与ALS病理。ScDRS分析显示MG-2、MG-4、MG-5、MG-6和My-4与GWAS风险位点显著相关,表明它们优先参与ALS病理(图7g)。
先前的研究已经确定了一种具有独特转录特征的小胶质细胞亚群,称为DAM,用于神经退行性疾病,如ALS和阿尔茨海默病。大坝的特点是下调稳态基因特征和上调参与吞噬、脂质代谢和溶酶体途径的基因。因此,通过评估DAM基因评分,作者想知道在发育中的人类脊髓中发现的易感小胶质细胞群(MG-2、MG-4、MG-5和MG-6)是否与DAM具有一些转录组学特征。作者的研究结果显示,MG-2、MG-4、MG-5和MG-6的评分明显更高,这表明成人大脑中的DAM与胚胎人类脊髓中的DAM样小胶质细胞之间的转录相似性(图7h)。作者的免疫染色结果证实了DAM样小胶质细胞在发育中的人类脊髓中的存在,其中小胶质标记物IBA1与DAM特异性标记物如APOE(图7f)、DDIT4和SPP1共定位。这些结果也强调了DAM样小胶质细胞在发育中的人类脊髓白质中的空间偏好。然后,对scRNA-seq数据集的进一步分析表明,DAM样小胶质细胞的出现发生在GW16至GW25的发育阶段。先前的研究也报道了健康个体发育中的大脑中存在DAM样小胶质细胞,这与作者的研究结果一致。
通过DEG深入研究四个DAM样小胶质细胞群的遗传特征(图7i)和GO分析显示,它们参与小胶质细胞中TYROBP因果网络等活动,对未折叠蛋白作出反应,积极调节细胞死亡,对有毒物质作出反应,对轴突损伤作出反应,参与神经元凋亡过程,激活T细胞(图7j,k)。这些发现揭示了小胶质细胞在ALS发病机制中的作用。综上所述,作者的研究在胚胎发育的人类脊髓中发现了四种转录异质性的DAM样小胶质细胞,为ALS发病机制背后的小胶质细胞谱提供了有价值的见解。
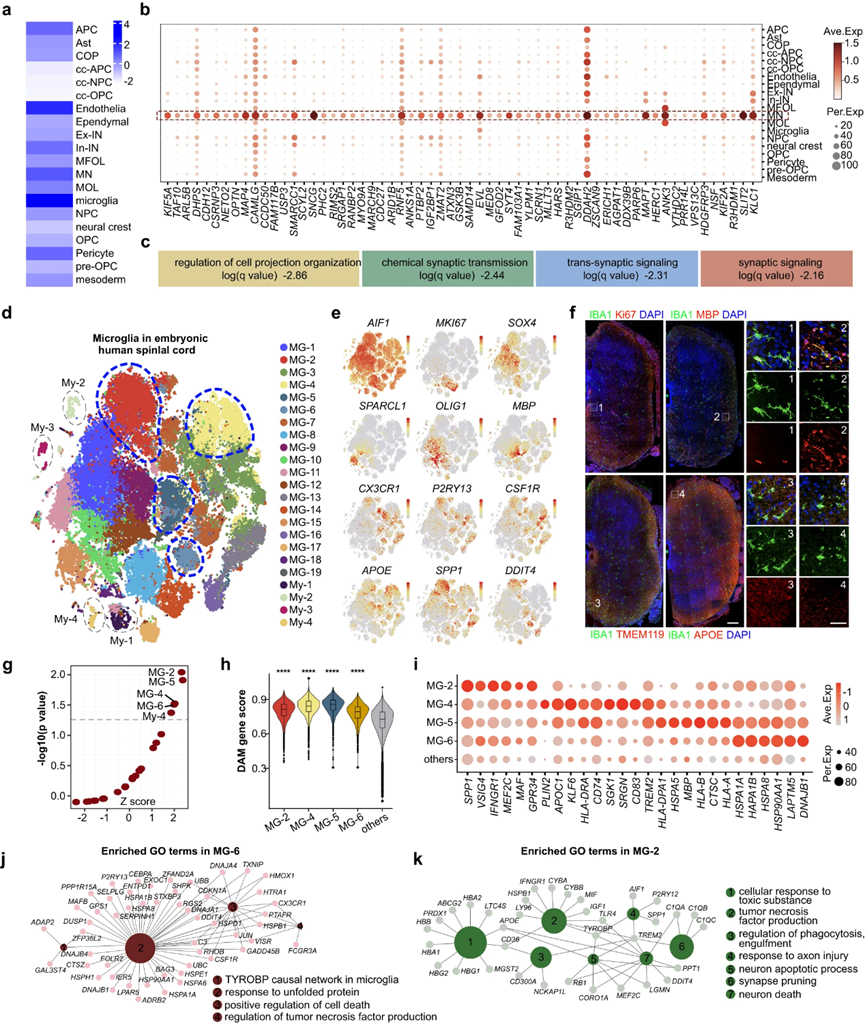
图7 联合GWAS分析揭示了ALS发病机制的细胞类型特异性特征
以往的研究已经确定,血脑屏障和血脊髓屏障的破坏是ALS的关键因素,并将ALS归类为神经血管疾病。作者的研究还发现内皮细胞和周细胞是与ALS遗传风险位点相关的主要细胞类型(图7a)。在内皮细胞和周细胞中特异性表达的风险基因通过将注释的风险基因与其DEG相交来鉴定。氧化石墨烯分析显示,内皮富集的风险基因与血管生成、止血和细胞连接组织等过程有关,而周细胞富集的风险基因与脉管系统发育等过程有关。因此,作者关于内皮细胞和周细胞参与ALS以及这些细胞类型中相关风险基因表达偏好的研究结果可能为ALS的神经血管病因提供见解。
结论:
综上所述,作者的研究结果揭示了ALS可能的细胞机制和特定细胞类型的风险基因表达偏好,这对作者对疾病发病机制的理解有深刻的见解,并可以为精确治疗的发展提供信息。
实验方法:
10× Visium空间转录组学,TF-seqFISH,免疫荧光,scRNA-seq和10x Visium数据的比对和准备,scRNA-seq数据分析,发育中的人类脊髓的发育轨迹推断,探索人类皮层发育过程中神经源性和胶质源性事件中的细胞类型比例动态,神经元谱系测定,MN发展分析,基因表达随MN分化的变化,星形胶质细胞发育和谱系轨迹推断。确定星形胶质细胞的空间特性,聚类间DEG的鉴定,与GWAS联合分析。
参考文献:
Shi Y, Huang L, Dong H, Yang M, Ding W, Zhou X, Lu T, Liu Z, Zhou X, Wang M, Zeng B, Sun Y, Zhong S, Wang B, Wang W, Yin C, Wang X, Wu Q. Decoding the spatiotemporal regulation of transcription factors during human spinal cord development. Cell Res. 2024 Jan 5. doi: 10.1038/s41422-023-00897-x. Epub ahead of print. PMID: 38177242.






