肝Zbtb18(含锌指和BTB结构域的18)通过FXR(法尼醇X受体)减轻肝脂肪性肝炎
脂肪酸合成和消耗之间的持续失衡会导致非酒精性脂肪性肝病(NAFLD),以及肝炎和胰岛素抵抗。然而,潜在机制的细节尚不完全清楚。在本研究中,作者揭示了转录因子Zbtb18在NAFLD患者和小鼠模型的肝脏中的表达显著降低。肝脏Zbtb18敲除促进了NAFLD的特征,如能量消耗受损和脂肪酸氧化(FAO),并诱导胰岛素抵抗。相反,在高脂饮食(HFD)喂养的小鼠或糖尿病小鼠中,肝脏Zbtb18过表达减轻了肝脂肪变性、胰岛素抵抗和高血糖。值得注意的是,体外和体内机制研究表明,Zbtb18转录激活法尼醇X受体(FXR)介导的FAO和网格蛋白重链(CLTC)蛋白可抑制NLRP3炎症小体的活性。通过在小鼠和培养的小鼠原代肝细胞(MPHs)中敲除和强制表达FXR,进一步验证了肝细胞Zbtb18表达减轻NAFLD和随后的肝纤维化的关键机制。此外,敲除CLTC显著消除了肝脏Zbtb18过表达对巨噬细胞NLRP3炎症小体活性的抑制作用。综上所述,Zbtb18通过转录激活FXR介导的FAO和CLTC的表达,从而抑制NLRP3炎症小体的活性,减轻炎症应激和胰岛素抵抗,为治疗肝脂肪变性和纤维化提供了有价值的药物。本文于2024年1月发表于《Signal Transduction and Targeted Therapy》,IF:39.3,Q1。
技术路线:

主要研究结果:
1、肝脏Zbtb18表达下调与NAFLD的发生发展密切相关
为了系统全面地识别参与脂肪性肝炎发生发展的关键信号分子,作者首先对NAFLD患者和正常对照的肝组织进行了mRNA微阵列分析,并随后将该临床转录组数据与已发表的转录组数据(来自NAFLD患者的GSE213621和来自NAFLD小鼠模型的GSE35961)进行了交叉分析,以确定差异表达基因(DEGs)。结果显示,3个转录组分别有274、411和792个差异表达基因。此外,3个数据集中有33个DEGs重叠。值得注意的是,作者发现在这些转录组数据中,肝脏Zbtb18的表达下调(图1a)。此外,作者证实了NAFLD患者肝活检组织中Zbtb18 mRNA和蛋白的显著降低(图1b)。作者还发现在几种NAFLD小鼠模型(包括db/db糖尿病小鼠、ob/ob肥胖小鼠和HFD诱导的肥胖小鼠)中,肝脏Zbtb18表达降低(图1c-e)。此外,在油酸和棕榈酸(OA和PA)培养的小鼠原代肝细胞(MPHs)中,肝脏Zbtb18的表达显著降低(图1f-g)。为了初步探究Zbtb18的生理功能,作者构建了AD -Zbtb18感染的MPHs,发现Zbtb18过表达有效地增加了参与FAO和氧化磷酸化(OXPHOS)的基因表达,而显著抑制了参与糖异生的基因(图1h, i)。因此,Zbtb18过表达增加了脂肪酸的分解代谢,同时减少了MPHs中的脂质沉积(图1j-l)。因此,作者的研究表明肝脏Zbtb18与NAFLD的发生发展呈负相关。
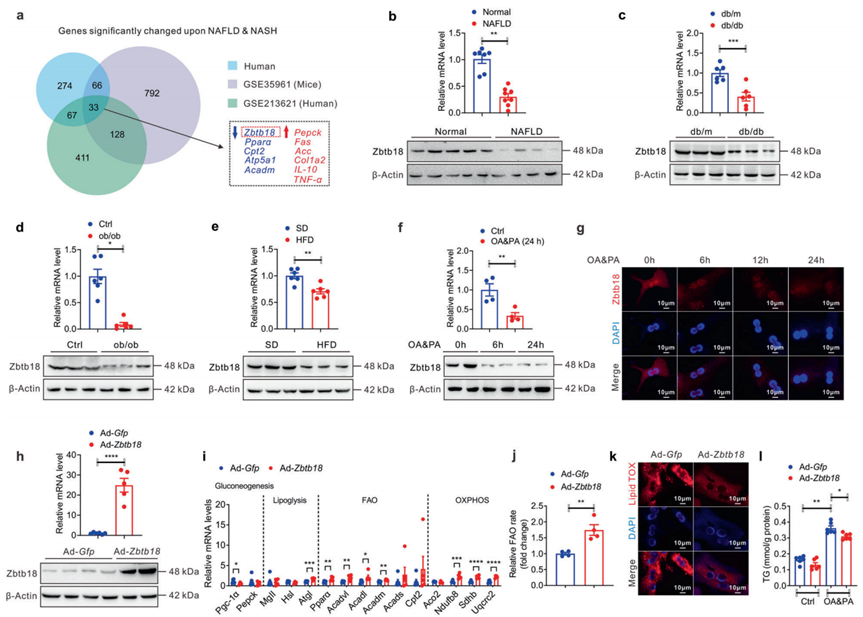
图1 肝脏Zbtb18 mRNA和蛋白表达下调与NAFLD的发生发展密切相关
2、肝脏Zbtb18的消融使小鼠更容易发生脂肪性肝炎
为了探索肝脏Zbtb18的功能,作者首先生成了肝细胞特异性Zbtb18缺失(Zbtb18LKO)小鼠。以Zbtb18flox/flox小鼠作为Zbtb18LKO小鼠对照。接下来,作者长期给予这些小鼠高脂饮食(HFD),以进一步探索肝脏Zbtb18在脂质代谢中的生理作用。作者发现,肝脏Zbtb18缺失易使小鼠在长时间HFD暴露后发生肥胖,如小鼠较高的体重和脂肪量所示(图2a, b)。组织学检查(HE染色)也一致显示Zbtb18LKO小鼠附睾白色脂肪组织(WAT)、腹股沟WAT和肩胛间棕色脂肪组织(BAT)的脂肪细胞肥大增加(图2c)。相应地,这些小鼠肩胛间BAT中产热基因的表达受到抑制,这可能导致了它们的体重增加(图2d)。然后,作者将小鼠饲养在代谢笼中,发现与对照小鼠相比,Zbtb18LKO小鼠的能量消耗、呼吸O2消耗和CO2生成程度较低(图2e)。更重要的是,Zbtb18LKO小鼠显示HFD喂养后小鼠的空腹血糖和胰岛素水平增加(图2f)。此外,Zbtb18LKO小鼠表现出葡萄糖耐量和胰岛素敏感性的损害(图2g)。随后的蛋白质印迹分析也显示了Zbtb18LKO小鼠肝脏中AKT和GSK-3β磷酸化的降低,进一步表明这些小鼠的胰岛素敏感性受损(图2h)。此外,肝脏Zbtb18缺失降低了参与FAO和OXPHOS的基因,上调了糖原生成基因,共同增加了高脂饮食小鼠肝脏中的脂质沉积(图2i, j)。
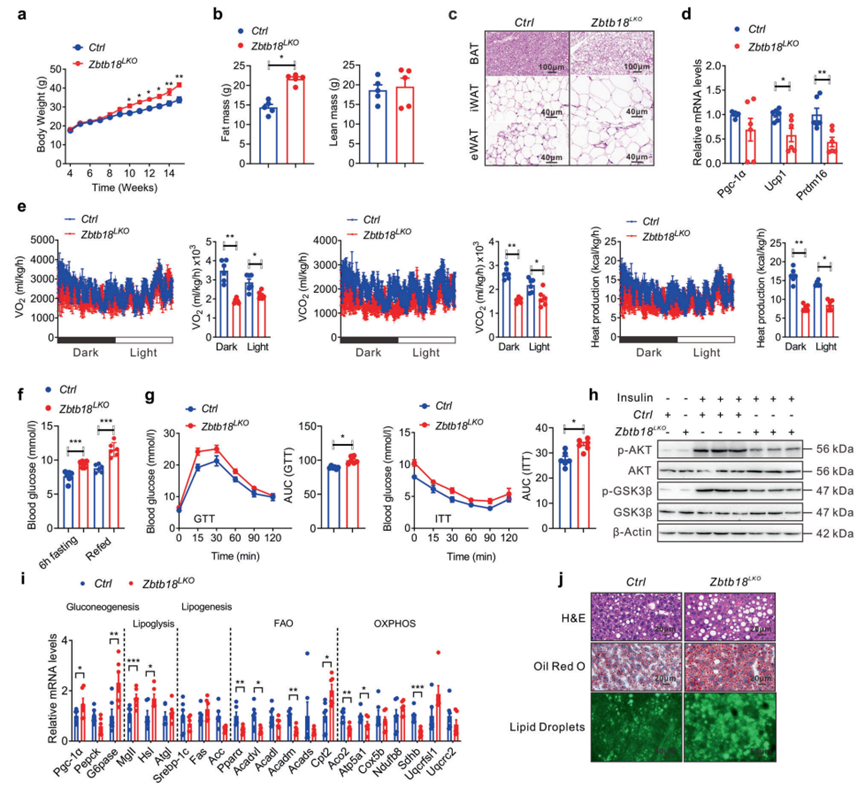
图2 肝脏Zbtb18的消融加重了HFD喂养的小鼠的脂肪性肝炎
3、肝脏Zbtb18过表达对高脂饮食诱导的肝脂肪变性的保护作用
为了验证肝脏Zbtb18的增加是否可以改善肝脏的脂质和葡萄糖稳态,作者通过将Alb-Cre小鼠和Rosa26-Zbtb18小鼠杂交,产生了肝脏特异性Zbtb18过表达(Zbtb18LKI)小鼠。以Zbtb18Rosa26基因敲入小鼠作为Zbtb18LKI对照。作者首先将这些小鼠暴露于HFD,发现Zbtb18过表达降低了体重,这可能归因于脂肪量和肝脏重量的减少(图3a, b)。此外,与同窝对照小鼠相比,Zbtb18LKI小鼠表现出能量消耗、呼吸氧消耗和CO2生成的增加,以及BAT中Ucp1(解偶联蛋白1)基因表达的增加,最终导致体重下降(图3c, d)。值得注意的是,Zbtb18过表达有效缓解了HFD诱导的肝脂肪变性,包括肝细胞气球样变和脂质沉积的改善(图3e)。此外,Zbtb18LKI小鼠的血清酮体水平升高,肝脏和血清TGs水平降低(图3f, g)。相应地,Zbtb18过表达增加了参与脂肪分解、FAO和OXPHOS的基因表达,而与脂肪生成相关的基因表达略有变化(图3h)。此外,改善肝脏过度脂质蓄积可有效减轻HFD诱导的肝脏脂毒性。这减轻了炎症细胞的浸润和炎症细胞因子的释放,最终逆转了HFD引起的肝炎,改善了肝功能,表现为炎症基因表达和血清ALT、AST水平的降低(图3i-l)。同样,由于肝脏Zbtb18的过表达,这些小鼠表现出较低的空腹血糖和胰岛素水平(图3m, n)。肝脏Zbtb18过表达还改善了HFD喂养的小鼠的葡萄糖耐量和胰岛素敏感性,并提高了肝脏中AKT和GSK-3β的磷酸化,表明HFD暴露导致的胰岛素信号通路改变得到了恢复(图3o, p)。综上所述,这些数据证明了肝脏Zbtb18在维持全身糖脂平衡中发挥着重要作用。
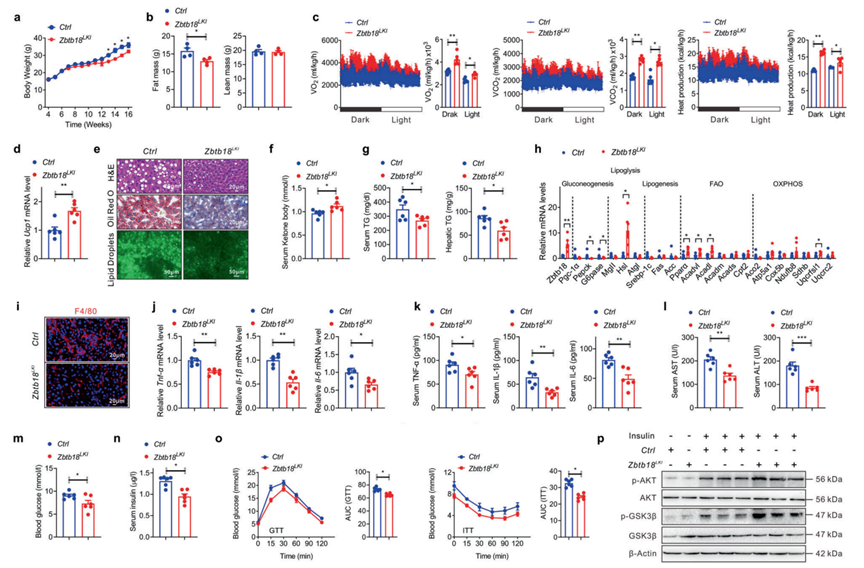
图3 肝脏Zbtb18过表达对抗高脂饮食诱导的肝脂肪变性
4、强制肝脏Zbtb18表达减轻糖尿病小鼠的肝脂肪变性
鉴于肝脏Zbtb18在保护饮食诱导的糖脂紊乱方面的主要作用,作者接下来测试其过表达是否会改善糖尿病db/db小鼠的脂肪肝表型。因此,通过尾静脉注射AAV-Zbtb18, db/db小鼠的肝脏Zbtb18表达增加(补充图7)。与此一致,AAV-Zbtb18感染的db/db小鼠体重和肝脏重量/体重比值降低(图4a, b)。AAV介导的肝脏Zbtb18过表达也显著改善了db/db小鼠的脂肪肝表型,如TGs含量的总体变化和组织学分析所示(图4c, d)。同样,AAV-Zbtb18感染的db/db小鼠显示空腹血糖和胰岛素水平降低(图4e)。后一结果暗示db/db小鼠中葡萄糖紊乱的改善,这通过改善的葡萄糖耐受不良和胰岛素抵抗进一步证实(图4f)。此外,在注射AAV-Zbtb18的db/db小鼠中也观察到血清酮体水平升高(图4g)。相应地,肝脏Zbtb18过表达显著增加了脂肪酸氧化相关基因的表达,而糖原基因包括Pgc-1α和Pepck被抑制(图4h)。同时,肝脏中AKT和GSK-3β磷酸化的增加促进了db/db小鼠胰岛素功能障碍的恢复(图4i)。同时,Zbtb18过表达的db/db小鼠肝脏F4/80和cd11b阳性巨噬细胞在肝脏内的聚集显著减少,同时炎性细胞因子水平降低(图4j, k)。所有这些变化都有助于肝功能障碍的改善,正如这些小鼠血清ALT和AST水平的降低所证明的(图4l)。总之,这些数据表明,靶向肝脏Zbtb18是阻止db/db小鼠肝脏脂肪变性进展的有效方法。
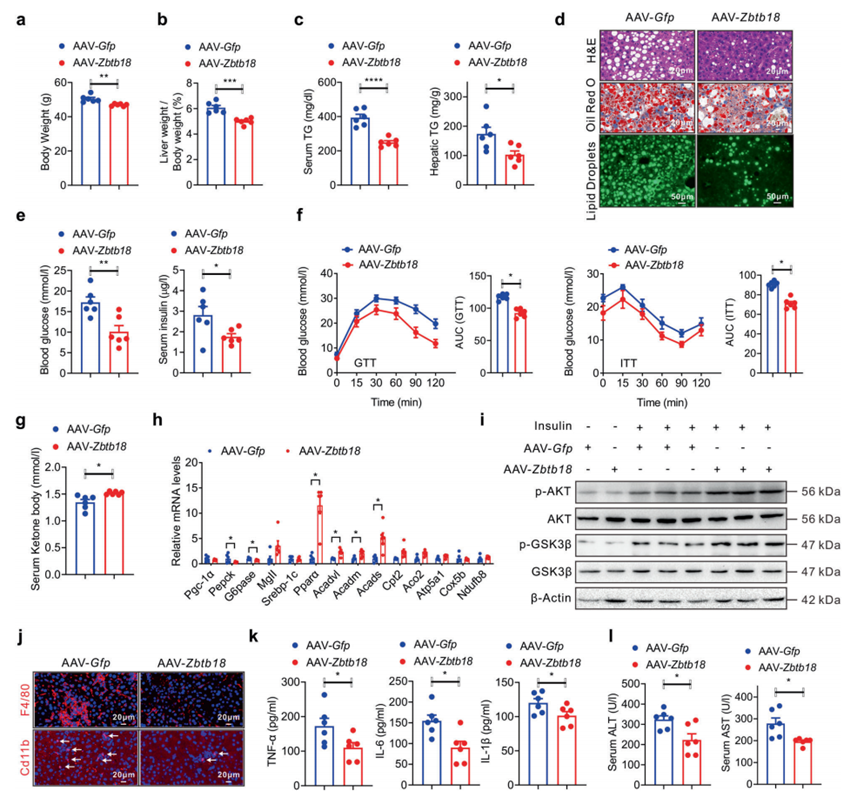
图4 挽救肝脏Zbtb18表达可减轻糖尿病小鼠的肝脂肪变性
5、Zbtb18通过转录激活FXR介导的FAO加速脂质分解代谢
为了研究在Zbtb18介导的肝脏保护作用中涉及的效应器或信号节点的细节,作者对Zbtb18过表达的MPHs进行了RNA-seq。因此,作者发现7347个基因因Zbtb18的过表达而发生了不同的变化,其中3628个基因上调,3719个基因下调(图5a)。随后的GO分析表明,Zbtb18过表达伴随着肝脏炎症和脂肪酸代谢通路的明显显著改变(图5b)。为了深入了解Zbtb18调节肝脏脂肪酸代谢和炎症的潜在机制,作者分析了从Zbtb18过表达的MPHs和NAFLD患者肝脏中发现的重叠DEGs。值得注意的是,结果显示大部分重叠的DEGs涉及FXR靶基因(图5c, d)。此外,在Zbtb18过表达的MPHs和NAFLD患者的肝脏中鉴定的上述DEGs的基因集富集分析(GSEA)显示,“FXR信号通路”与Zbtb18的表达呈正相关,提示这些DEGs的表达可能是由FXR依赖的机制驱动的(图5e)。此外,在Zbtb18过表达的肝脏中,FXR mRNA和蛋白水平均上调(图5f-g)。与此一致,Zbtb18过表达也显著增加了培养的MPHs中FXR蛋白及其靶基因的总水平和细胞核水平(图5h)。
为了进一步探索Zbtb18激活FXR的潜在机制,作者在MPHs中进行了Zbtb18特异性ChIP-seq。结果显示在FXR基因中有一个显著的Zbtb18结合启动子区域(图5i)。此外,作者进一步分析了ChIP-seq数据,并证实位于FXR启动子区域的“AACTCACTCT”是Zbtb18的关键结合基序(图5j)。然后,使用一系列已报道的构建体(pFXR-1838, pFXR-1074和pFXR-677)在HepG2和MIHA细胞中进行荧光素酶检测。作者发现,Zbtb18显著刺激pFXR-1838和pFXR-1074的转录活性,而pFXR-677没有产生影响,这表明Zbtb18转录因子的潜在结合位点从-1074 bp到-677 bp(图5k, l,左)。更重要的是,FXR启动子区AACTCACTT突变为TTTTTTTT减弱了Zbtb18对FXR转录活性的刺激作用,表明其结合位点位于FXR区域(图5k, l,右)。此外,作者的ChIP-qPCR分析显示,在db/db小鼠和HFD喂养的小鼠的肝脏中,FXR启动子上的Zbtb18转录因子的占用显著降低,这进一步详细说明了这些小鼠中FXR失调的机制(图5 m)。为了进一步验证FXR在介导Zbtb18诱导的保护作用中的关键作用,作者构建了FXR敲除的MPHs,并发现FXR缺失显著削弱了Zbtb18对FAO的保护作用,导致MPHs中的脂质积累水平未发生改变(图5n-p)。相反,FXR过表达减轻了Zbtb18缺乏引起的MPHs中脂质沉积(图5q)。综上所述,这些数据表明Zbtb18介导的FXR转录激活与肝细胞脂质稳态之间存在很强的相关性。
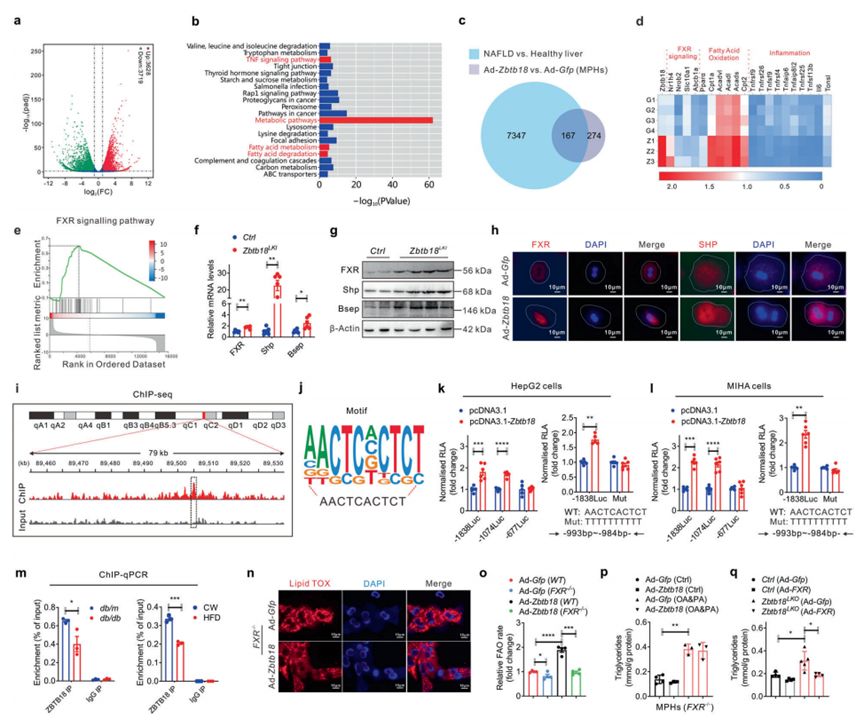
图5 FXR的Zbtb18转录激活通过FAO加速脂质分解代谢
6、肝脏Zbtb18通过FXR介导的CLTC蛋白表达抑制巨噬细胞中NLRP3炎症小体的活化
越来越多的证据表明,肝细胞脂质失衡通常会引发并促进肝脏炎症,进而加重NAFLD的进展。为了全面探讨Zbtb18对NAFLD发展的影响,作者还研究了NLRP3炎症小体的组装和活化的变化,在肝脏Zbtb18获得或丢失模型中,NLRP3炎症小体在肝脏炎症中起关键作用。肝脏Zbtb18缺失显著增强了HFD诱导的炎症小体相关蛋白的表达,包括NLRP3, ASC和Caspase-1。这些作用被肝脏Zbtb18过表达显著逆转(图6a, b)。作者的结果表明,肝脏Zbtb18对NLRP3介导的炎症小体激活具有抑制作用,这也在AAV-Zbtb18感染的db/db小鼠中得到了验证(图6c)。随后,作者对Ad-Zbtb18感染的肝细胞上清液进行了蛋白质组学分析,以揭示参与肝细胞Zbtb18驱动的炎症抑制的关键递质。随后对使用上述培养基处理的巨噬细胞进行的实验也证实了这一假设,实验显示在Ad-Zbtb18感染的肝细胞条件培养基中培养的巨噬细胞中,炎症小体的活性受到抑制(图6d)。有趣的是,在Zbtb18缺失的小鼠中,FXR缺失有效地消除了Zbtb18对NLRP3炎症小体相关蛋白的抑制,而FXR过表达有效地阻断了NLRP3炎症小体的异常激活(图6e-f)。在肝细胞中敲除CLTC可有效减弱Zbtb18条件培养基体外诱导的巨噬细胞中NLRP3炎症小体的抑制作用(图6g-h)。综上所述,这些结果表明肝脏Zbtb18的表达通过FXR介导的CLTC蛋白表达抑制巨噬细胞中NLRP3炎症小体的活化,从而帮助减轻小鼠NAFLD。
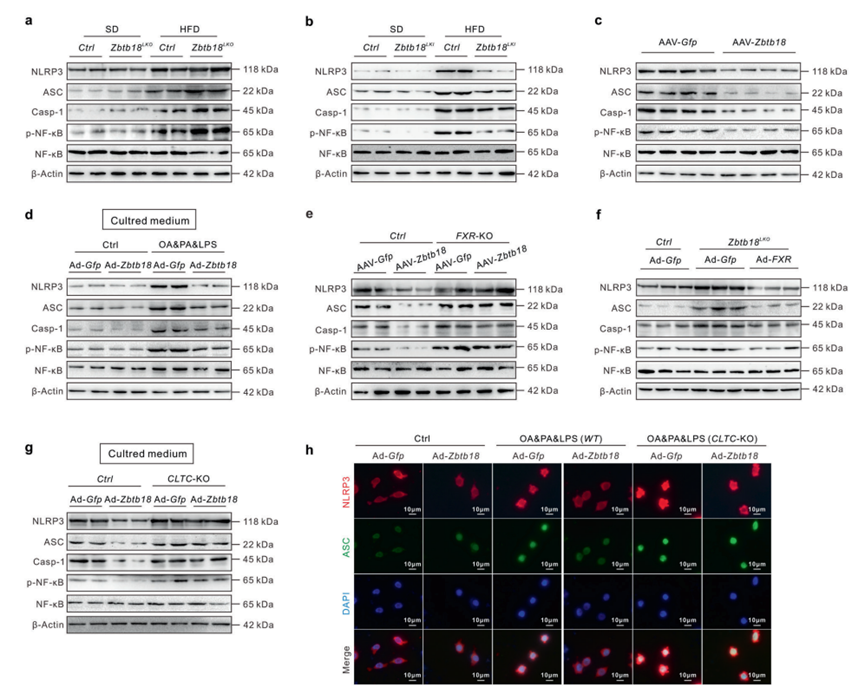
图6 肝脏Zbtb18蛋白通过FXR介导的CLTC蛋白表达抑制巨噬细胞NLRP3炎症小体的活化
7、FXR活性有效地介导了Zbtb18诱导的肝脂肪变性的减轻
与上述结果一致,作者通过尾静脉注射AAV-Zbtb18到FXR缺失的小鼠体内来测试FXR在介导Zbtb18驱动的有益效应中的生理功能。因此,作者发现FXR缺失几乎消除了Zbtb18诱导的体重和脂肪量减少,HFD小鼠的能量消耗发生了罕见的变化(图7a, b)。此外,注射AAV-Zbtb18后,FXR缺失小鼠的血清酮体水平几乎没有变化(图7c)。此外,肝脏Zbtb18过表达未能改变与FAO相关的肝脏基因的表达(图7d)。这导致AAV-Zbtb18感染的FXR敲除小鼠的血清和肝脏中的TGs含量不变,同时肝细胞内的气球样变和脂滴积聚不变(图7e, f)。同样,FXR缺失消除了Zbtb18过表达后空腹血糖和血清胰岛素水平的下降(图7g)。此外,AAV-Zbtb18感染的FXR缺陷小鼠的葡萄糖耐量和胰岛素抵抗无变化(图7h)。这些结果表明,FXR在Zbtb18诱导的肝脏葡萄糖紊乱保护作用中起关键作用。值得注意的是,在FXR缺失的小鼠中没有观察到Zbtb18诱导的肝脏中AKT和GSK-3β磷酸化的增加(图7i)。此外,在AAV-Zbtb18感染小鼠和AAV-Gfp感染小鼠之间,由于FXR缺失,未检测到肝脏生糖基因(如Pgc-1α和Pepck)的表达有差异(图7j)。Zbtb18同样不能降低FXR缺陷小鼠的血清炎性细胞因子,如TNF-α和IL-1β,以及ALT和AST水平(图7k -1)。
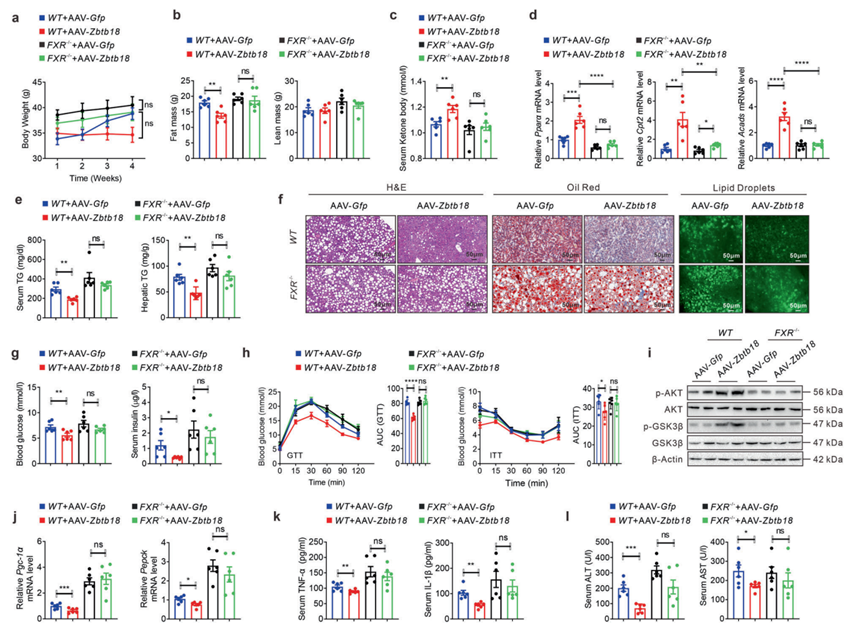
图7 FXR消融减弱了Zbtb18诱导的对脂肪性肝炎的保护作用。
相反,FXR的强制表达有效地增加了其靶基因在肝Zbtb18LKO小鼠肝脏中的表达(图8a)。由于FXR的表达,这些小鼠的脂肪量减少,能量消耗增加(图8b, c)。相应地,Zbtb18LKO小鼠肝脏重量/体重比值、血清酮体水平和TGs含量的变化由于FXR的恢复激活而逆转,同时这些小鼠中涉及fao的肝脏基因表达和肝脏脂肪变性的改善,如肝细胞内脂滴积聚导致的气球样变减少(图8d-f)。此外,FXR表达增加降低了Zbtb18LKO小鼠的空腹血糖和胰岛素水平。此外,FXR表达的增加显著减轻了Zbtb18缺失引起的肝脏葡萄糖耐受不良和胰岛素抵抗(图8g, h)。在FXR过表达后,作者观察到对肝脏中AKT和GSK-3β磷酸化的类似刺激作用,这表明Zbtb18LKO小鼠的肝脏胰岛素信号活性得到挽救,并且参与糖生成的基因得到有益的调节(图8i, j)。值得注意的是,强制肝脏FXR表达有效减轻了Zbtb18缺陷刺激的CD11b+和F4/80+巨噬细胞在肝脏中的聚集,从而减轻了炎症应激,最终促进了这些小鼠NAFLD的改善(图8k-m)。综上所述,这些数据强烈表明了Zbtb18介导的FXR转录激活在维持肝脏糖脂稳态方面的潜在工作机制。
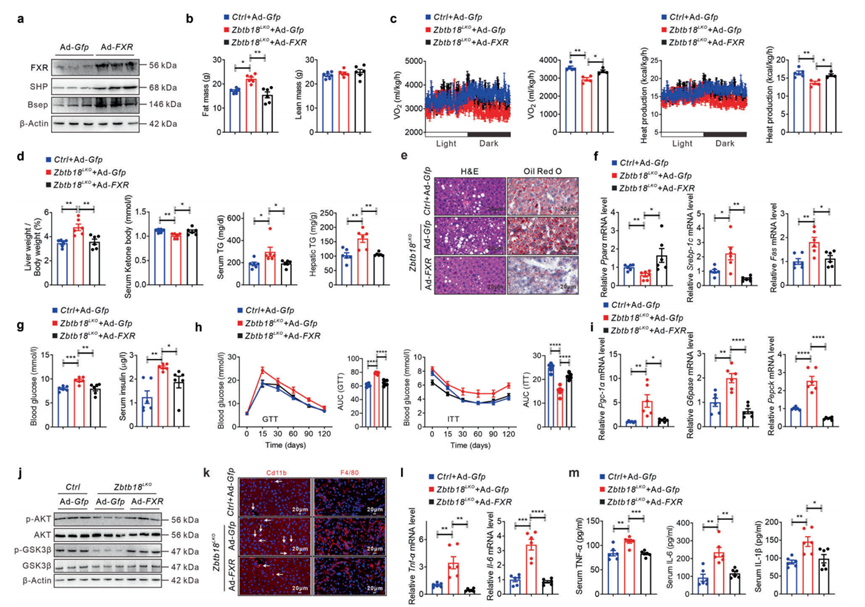
图8 肝脏FXR强制表达减轻肝脏Zbtb18缺失小鼠的NAFLD表型
8、肝脏Zbtb18蛋白通过转录激活FXR保护MCD诱导的小鼠肝纤维化
越来越多的证据表明,肝脏内脂质的长期异常积累会导致纤维结缔组织的过度沉积以及肝脏内细胞外基质的合成和降解失衡,从而促进NASH进展。考虑到Zbtb18在减少肝脏脂质沉积方面的明显作用,作者怀疑Zbtb18可能对肝纤维化具有显著的保护作用。接下来,作者用MCD饮食喂养Zbtb18LKO小鼠,以证明Zbtb18在MCD饮食诱导的肝纤维化发展中的生理功能。正如预期的那样,与同窝对照小鼠不同,在MCD饮食暴露后,Zbtb18LKO小鼠的ALT和AST水平升高(图9a),这表明这些小鼠发生了重度肝损伤和肝细胞死亡。此外,在MCD饮食喂养后,Zbtb18缺失导致TGs水平和肝脏脂质沉积均加重,如脂滴积累和随后的肝细胞气球样变所示(图9b, c)。此外,作者的天狼星红染色分析表明,在Zbtb18消融的肝脏小鼠中,MCD饮食诱导的致死性实质内细胞外周纤维化的发生促进了α-SMA染色水平的急性升高(图9d)。相应的,MCD饮食诱导的与肝纤维化发展相关的肝基因表达(包括α-SMA、Col1a1和TGF-β)也在肝Zbtb18LKO小鼠中受到刺激,同时FXR及其靶基因的表达受损(图9e、f)。此外,肝脏Zbtb18缺失加剧了MCD饮食诱导的肝脏炎症应激,如炎症基因(如F4/80和TNF-α)的上调,血清炎症细胞因子水平的升高,以及肝脏中F4/80+和CD11b+巨噬细胞的聚集增加(图9e, g, h)。所有这些事件都会导致脂肪性肝炎的快速发展。
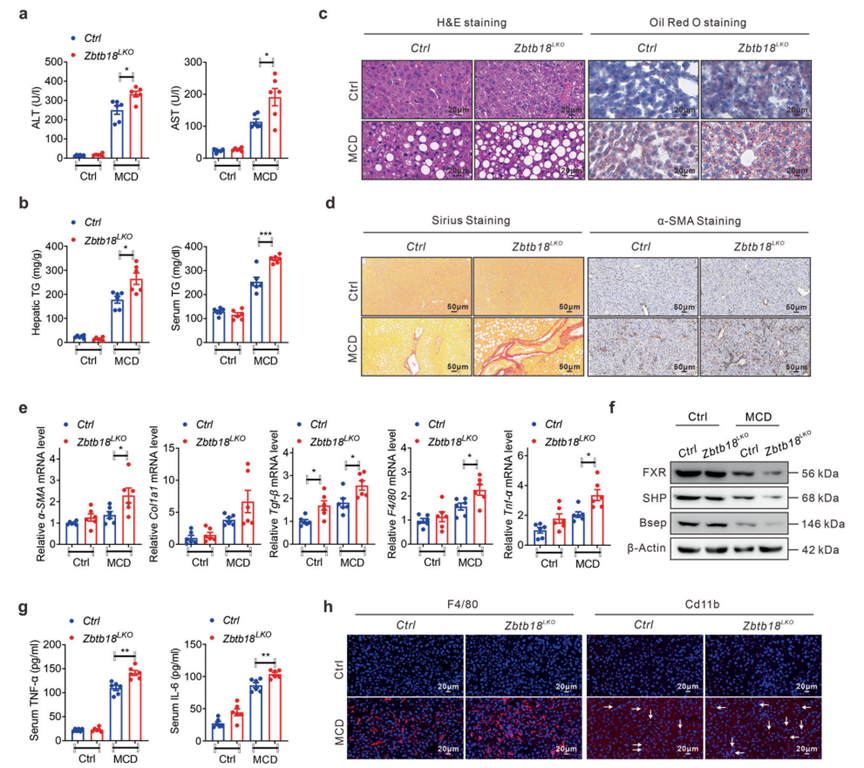
图9 肝脏Zbtb18缺失加重MCD诱导的肝纤维化进展
相比之下,如正常血清ALT和AST水平与同窝对照组小鼠相比所示,肝脏Zbtb18过表达保护小鼠免受MCD饮食诱导的肝纤维化(图10a)。此外,通过HE染色和油红O染色分析显示,Zbtb18过表达有效改善了MCD饮食刺激的TGs升高和肝脏脂肪沉积(图10b, c)。Sirius染色和α-SMA免疫组化分析一致表明,在肝脏Zbtb18过表达的小鼠中,即使喂食MCD饮食,实质内细胞外周纤维化的发展也受到了部分阻碍(图10d)。与此同时,密切相关的基因(包括α-SMA、Col1a1和TGF-β)表达减少(图10e)。此外,肝脏Zbtb18过表达抑制了MCD饮食诱导的肝脏炎症基因F4/80、TNF-α、CXCL1和CXCL10,从而降低炎症细胞因子的血清水平和肝脏炎症细胞的浸润,有助于改善脂肪性肝炎(图10e-g)。
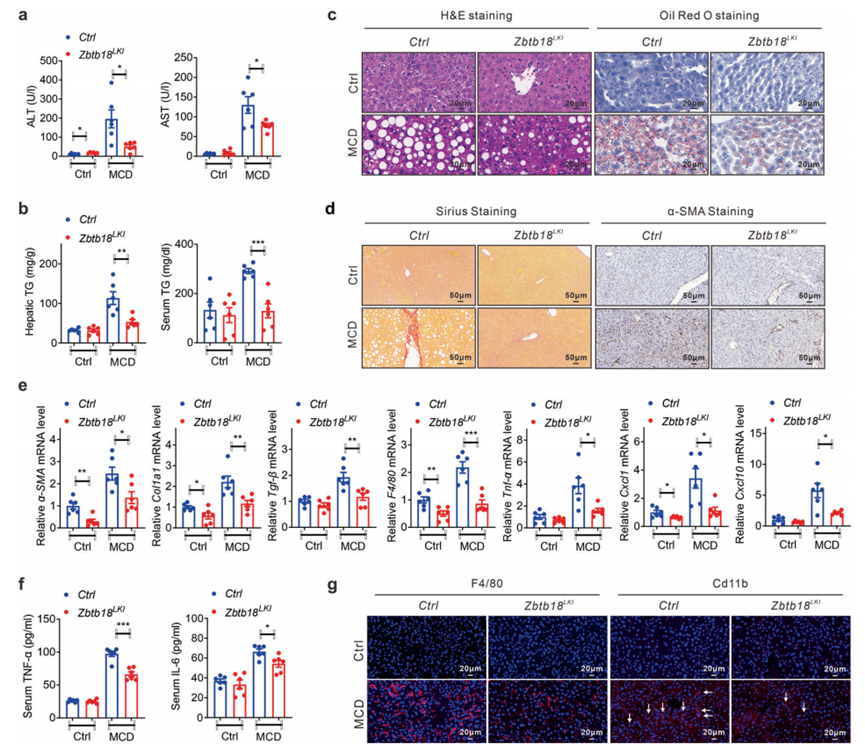
图10 肝脏Zbtb18过表达对MCD诱导的小鼠肝纤维化具有保护作用
总之,这些发现提示肝脏Zbtb18在防御脂肪性肝炎方面具有潜在的治疗作用,其部分机制是通过激活FXR及其下游靶基因(图11)。
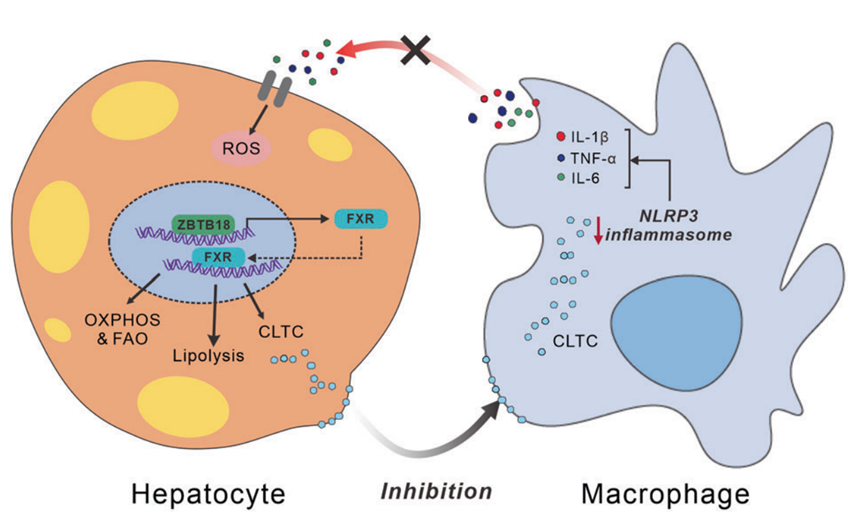
图11 Zbtb18通过转录激活FXR介导的肝脏脂质代谢,抑制NLRP3炎症小体的活性,减轻炎症应激和胰岛素抵抗
结论:
综上所述,作者证明了肝脏Zbtb18可以通过直接结合FXR启动子区的AACTCTCT元件来增加FXR mRNA和蛋白的表达。反过来,FXR可以刺激其靶基因加速FAO,从而阻止NAFLD的发生和发展。此外,Zbtb18/FXR轴刺激的CLTC蛋白显著减轻肝脏炎症浸润和纤维化。因此,Zbtb18/FXR轴是一个新的治疗NAFLD和NASH的候选靶点。
实验方法:
临床组织制备;动物和治疗;组织学分析、免疫荧光分析和脂滴染色;脂肪酸氧化检测;耐量试验;代谢笼和MRI;ELISA和TGs和TCs检测;荧光素酶报告基因法;染色质免疫沉淀(ChIP)分析;RNA测序;CHIP测序和发现峰;Western blot;实时定量PCR;细胞培养和预处理。
参考文献:
Zhang L, Chen J, Yang X, Shen C, Huang J, Zhang D, Liu N, Liu C, Zhong Y, Chen Y, Tang K, Guo J, Cui T, Duan S, Li J, Huang S, Pan H, Zhang H, Tang X, Chang Y, Gao Y. Hepatic Zbtb18 (Zinc Finger and BTB Domain Containing 18) alleviates hepatic steatohepatitis via FXR (Farnesoid X Receptor). Signal Transduct Target Ther. 2024 Jan 24;9(1):20. doi: 10.1038/s41392-023-01727-7. PMID: 38263084; PMCID: PMC10806020.






