Hedgehog-Gli1诱导的外泌体circ0011536介导胰腺癌周围神经重构
Hedgehog-Gli1信号诱导胰腺导管腺癌(PDAC)中两种常见神经特征的发展:外周神经侵袭(PNI)和外周神经重塑(PNR)。然而,Gli1衍生的背根神经节(PNR)在癌细胞和神经中的潜在分子机制尚未得到全面分析。我们首先通过外泌体circ-0011536和DRG之间的串扰确认了PNR发生的分子机制。在Gli1过表达的PDAC中,circ-0011536主要由外泌体分泌。被DRG摄入后,通过降解miR-451a,上调VGF的表达,促进DRG的活性。Gli1过表达可加速小鼠皮下肿瘤的增殖,与神经丛密度密切相关,而circ-RNA下调可抑制肿瘤增殖,降低神经丛密度。此外,TMA结果证实Gli1过表达可显著增加VGF的表达,并与神经丛密度增加密切相关。Hedgehog-Gli1诱导的外泌体circ-0011536通过miR-451a/VGF轴促进PNR,从而确定它可能通过激活Hedgehog信号通路促进PDAC相关的神经变化。本文于2023年12月发表于“Journal of Experimental & Clinical Cancer Research”(IF=11.3)上。
技术路线:

结果:
1)Gli1促进PDAC细胞的增殖和侵袭
为了研究Gli1上调是否促进PDAC细胞系的肿瘤进展,我们首先通过qRT-PCR和Western blotting检测了5种PDAC细胞系中Gli1的表达。与HPDE相比,至少有4个PDAC细胞系中Gli1表达上调,而Gli1的mRNA和蛋白表达在CFPAC和PANC-1细胞中相对较低(补充图)。为了进一步研究Gli1在PDAC细胞进展中的功能作用,我们在CFPAC和PANC-1细胞中构建了Gli1慢病毒(lentii-Gli1),并使用空病毒(EV-Gli1)作为对照。通过qPCR和Western blotting验证了Gli1在RNA和蛋白质水平上过表达的影响(图1A-C)。此外,我们使用CCK-8方法检测Gli1表达上调对PDAC细胞增殖的影响。结果显示,过表达Gli1组的细胞增殖率明显高于空白对照组(图1D)。Transwell法检测Gli1在PDAC细胞侵袭能力中的作用。结果显示,培养24 h后,lenti-Gli1组通过底部聚碳酸酯膜的细胞数量明显高于EV-Gli1组,细胞数量差异有统计学意义(图1E)。同样,Western blot结果证实,与增殖和侵袭相关的基因Ki-67和E-cadherin也表现出与功能一致的趋势 (图1F)。
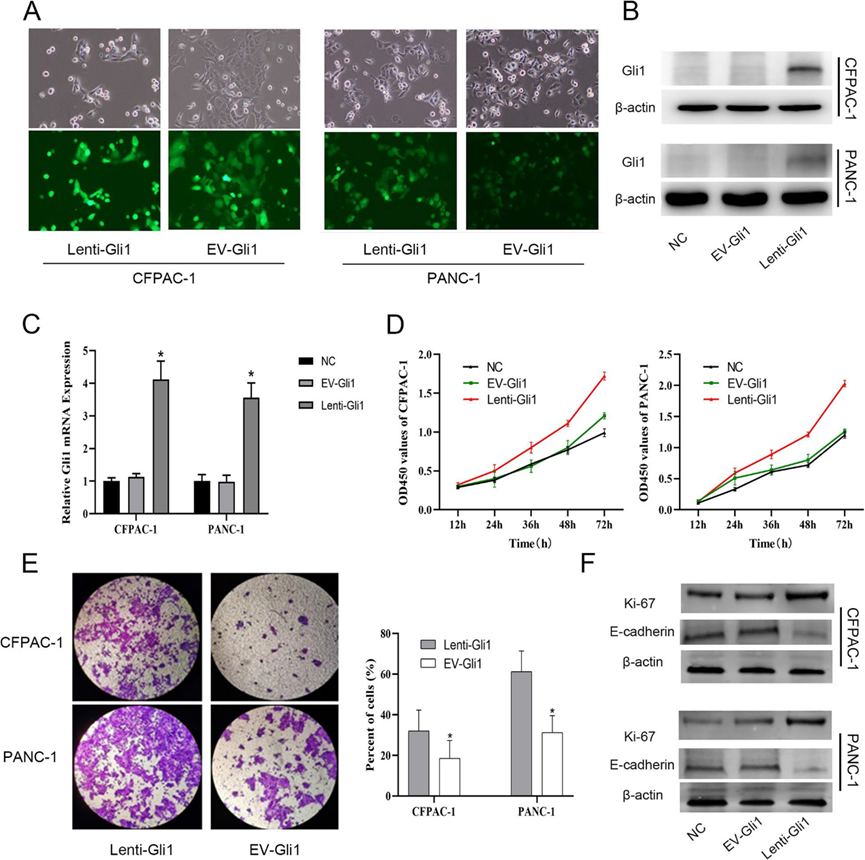
2)Gli1诱导PDAC细胞介导的DRG趋化
为了进一步表征观察到的神经元变化的潜在分子基础,我们构建了一个体外共培养模型,使用DRG细胞作为神经元元件。提取小鼠DRG,构建PDAC-DRG共培养模型。实验结果显示,与EV-Gli1对照组相比,lenti-Gli1组通过Transwell细胞的DRG细胞数量明显增加(图2A、B)。为了进一步研究Gli1信号在神经元可塑性中的功能作用,我们以NGF为对照,观察DRG轴突延伸长度。结果表明,lenti-Gli1组促进PDAC细胞DRG轴突延伸,其作用类似于NGF的产生。以不含NGF的空血清(SF组)为对照(图2C)。此外,Gli1过表达还能保护DRG免受血清饥饿诱导的细胞凋亡。通过Annexin V/PI检测,当Gli1过表达的PDAC细胞与DRG共培养时,细胞中caspase-3的表达显著降低(图2D-F)。上述研究表明,在PDAC细胞中激活Gli1可以促进DRG细胞趋化和轴突神经伸展,同时避免饥饿诱导的细胞凋亡的发生。
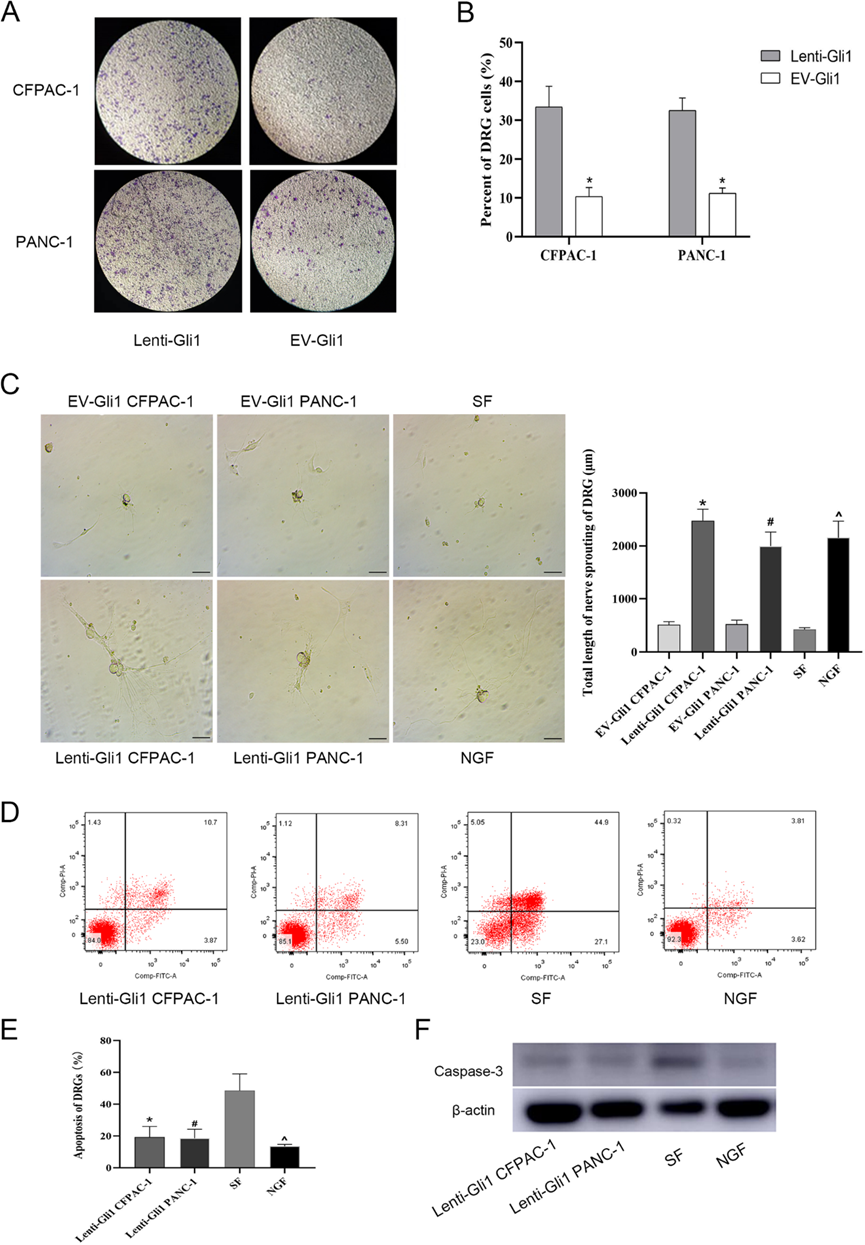
3)Gli1通过PDAC诱导的外泌体作用于DRG
提取上清液进行外泌体分离,并通过透射电子显微镜、纳米颗粒跟踪分析(NTA)分析和Western blotting对所得物质进行验证。电镜观察结果显示,提取物呈碟状透明,具有完整的囊泡膜结构。NTA结果表明,提取的外泌体的体积主要为130 nm,与以往文献一致,验证了胰腺癌细胞系CFPAC-1中外泌体的存在。Western blotting结果显示外泌体标记蛋白CD63和TSG101阳性 (图3A-C)。为了确认PDAC细胞衍生的外泌体是否可以转移到DRG受体上,我们提取lenti-Gli1组和EV-Gli1组的外泌体,用PKH26染料标记,过滤后加入到DRG,与DRG共培养24 h,结果显示外泌体被聚焦在细胞周围并被细胞吸收(图3D)。同时,lenti-Gli1组的外泌体延长了DRG的轴突延伸(图3E, F)。这表明,对DRG的影响可能是由源自PDAC细胞的外泌体实现的。
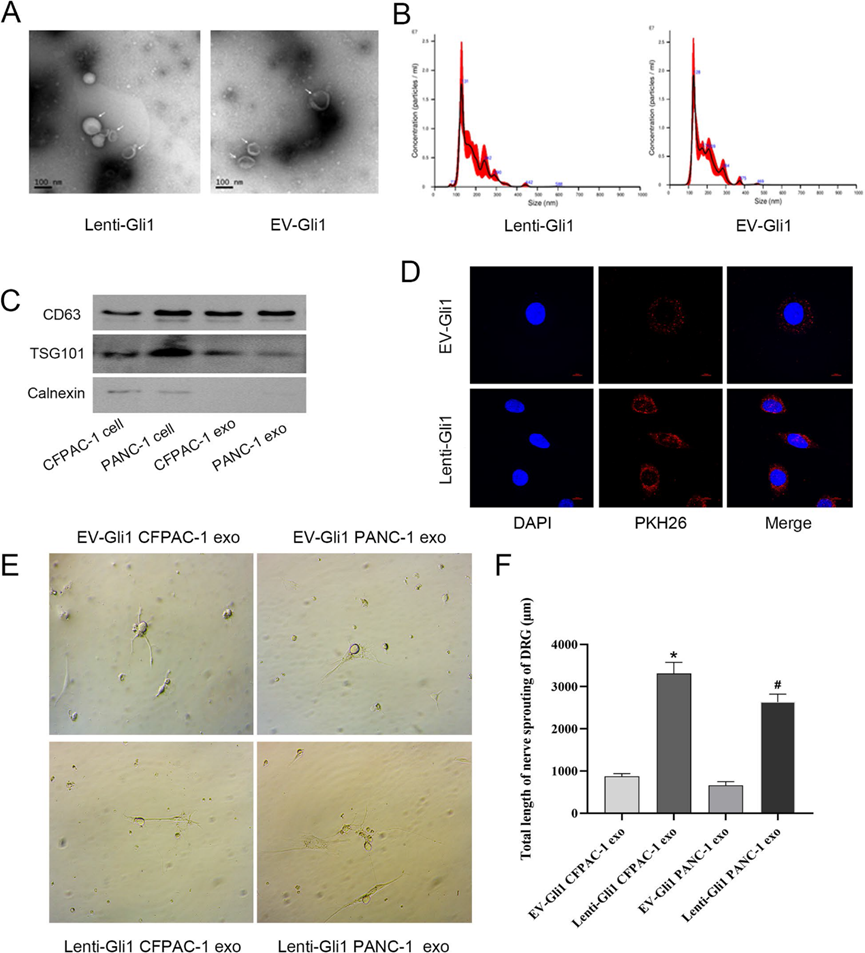
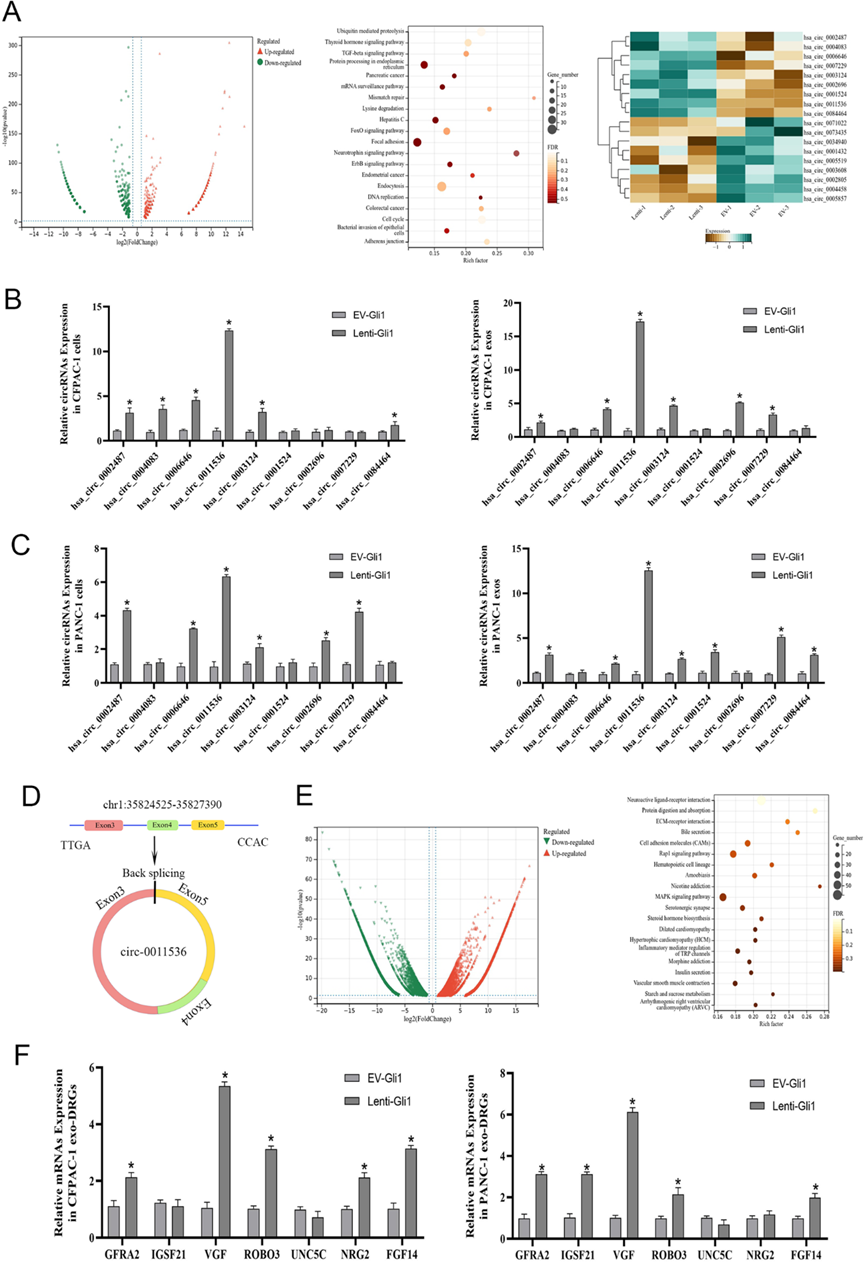
4)携带传输信号的外泌体中circRNA的筛选和验证
我们提取RNA并对过表达Gli1的CFPAC-1细胞进行RNA测序。在鉴定的lncRNA、circRNA和microRNA中,circRNA存在显著差异。我们鉴定出2621个差异表达基因,其中1530个表达上调,1091个表达下调。对差异基因进行KEGG通路富集分析,共筛选出18个与Neurotropin信号通路相关的circRNA,包括9个上调基因和9个下调基因(图4A)。为了阐明潜在的机制,我们评估了9个上调基因的表达水平。hsa-circ-0011536的表达同步升高,差异显著(图4B-D)。同样,我们用从Gli1过表达的细胞中提取的外泌体处理DRG并进行测序。共鉴定出6718个上调基因和5578个下调基因。聚类后,发现59个基因参与了神经活性配体-受体相互作用途径(图4E)。选择前7个差异显著的基因进行qPCR检测。在lenti-Gli1处理的DRG细胞中,VGF被发现上调(图4F)。这些发现表明外泌体可能携带circ-0011536并将其传递给DRG细胞,从而改变VGF并导致下游效应。
5)携带circ-0011536的外泌体通过miR-451a作用于DRG细胞
我们分别构建了在EV-Gli1和lenti-Gli1 PDAC细胞中过表达和敲低hsa-circ-0011536的载体。在验证circRNA表达后,我们初步评估了VGF在DRG细胞中的表达,显示出外分泌效应。VGF的表达与circRNA的变化一致(图5A)。此外,lenti-has-circ-0011536和lenti-Gli1 CFPAC-1细胞分泌的外泌体同样促进轴突伸长(图5B)。由于DRG和PDAC细胞来自不同的物种和属,因此在DRG细胞中将has-circ-0011536转化为同源基因mum -circ-0001261进行检测。序列比较分析表明,这两个基因具有高度保守性。我们随后在外泌体处理的DRG细胞中检测了VGF mRNA和蛋白。Gli1和has-circ-0011536过表达的CFPAC-1细胞的分泌物显示,mmu-circ-0001261和VGF的表达升高(图5C, D)。我们使用荧光素酶测定mmu-circ-0001261与VGF的结合;结果未显示直接结合,因此表明mmu-circ-0001261可能参与内源性竞争性RNA的调控。ENCORI和Circineracoome数据库预测了15个miRNA可能与mmucic-0001261互补,并且通过ENCORI、TargetScan、miRTarBase和miRDB预测了VGF上游的33个miRNA,经过DRG验证,发现两者交集的3个常见miRNA (mmu-miR-423-5p、mmu-miR-451a、mmu-miR-6921-5P)高度保守且差异显著(图5E)。为了进一步验证miRNA的作用,我们构建了过表达mmu-circ-0001261的DRG细胞模型来模拟lenti-Gli1外泌体的作用。添加miR-451a模拟物后,VGF mRNA和蛋白表达下调(图5F、G)。根据上述结果,我们初步确定PDAC细胞通过Gli1-circ-0011536-miR-451a-VGF通路作用并介导神经细胞变化。
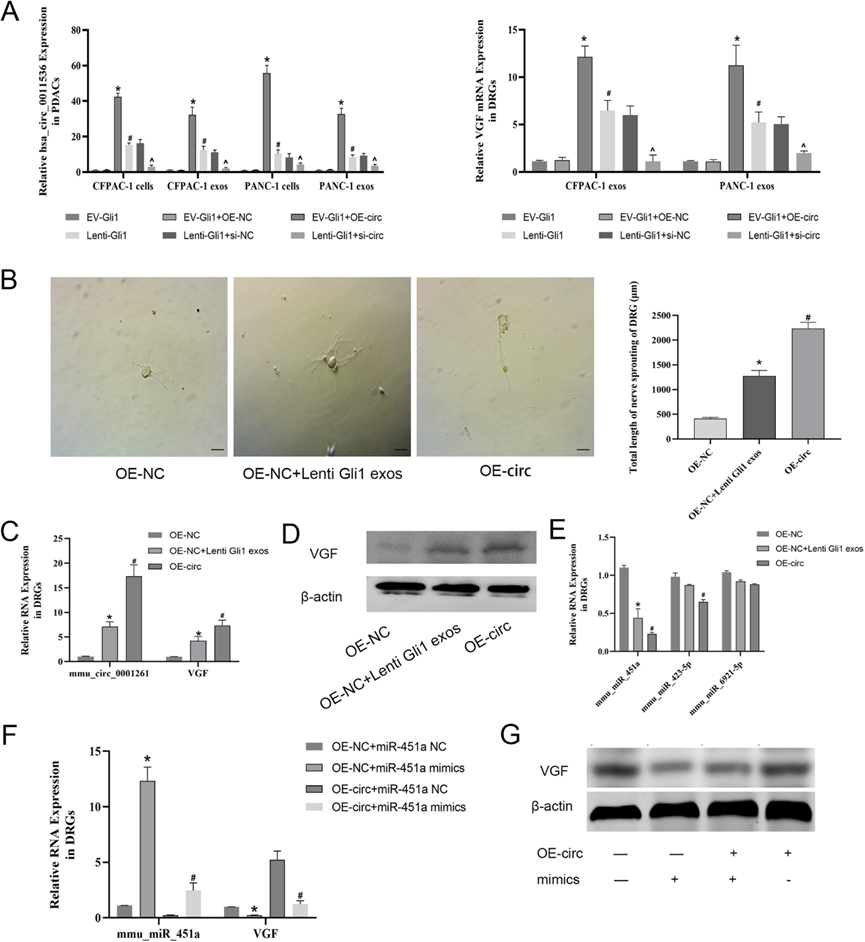
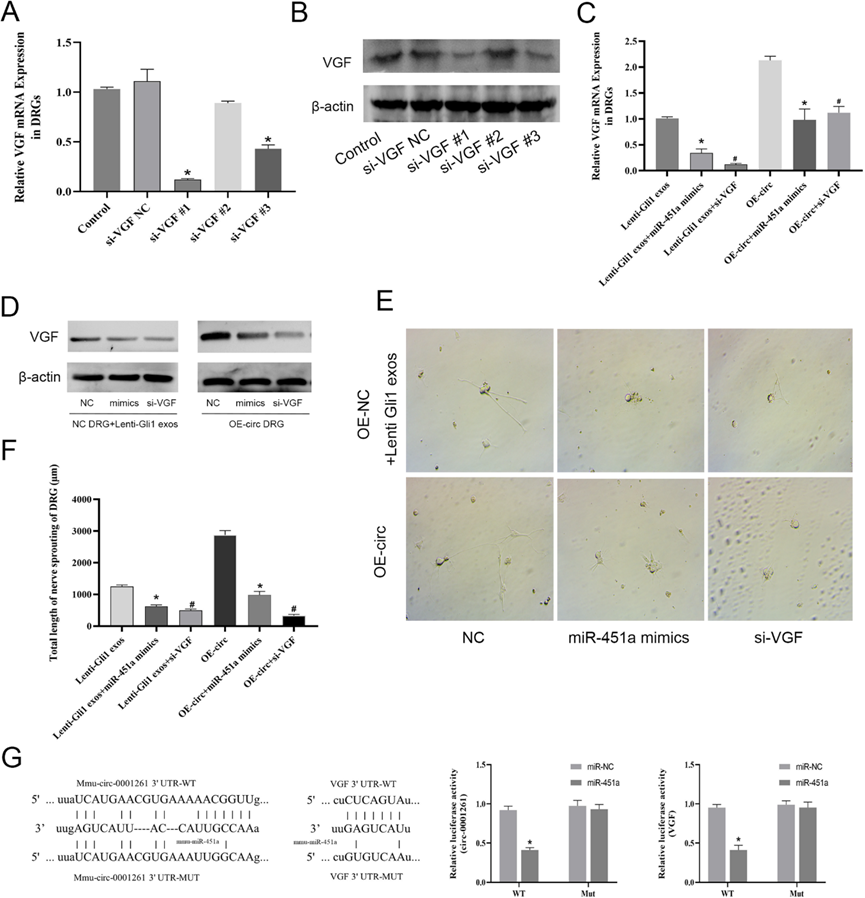
6)Gli1衍生的外泌体circ-0011536通过miR-451a/VGF轴介导PNR
我们构建了VGF siRNA,并在DRG细胞中进行了沉默验证,以确定最有效的siRNA(图6A, B)。随后,我们进行拯救实验。正如预期的那样,miR-451a的过表达或VGF的沉默降低了VGF的mRNA和蛋白表达,也影响了DRGs的轴突延伸(图6C-F)。荧光素酶报告基因检测表明,mmic-0001261和miR-451a模拟治疗抑制WT信号,而mmucic-0001261突变消除了miR-451a模拟的抑制作用。此外,miR-451a模拟物降低了DRG细胞中的VGF-WT荧光素酶报告信号,但对VGF-MUT载体没有影响(图6G)。我们的数据表明,在体外,在Gli1过表达的PDAC细胞中,外泌体携带的has-circ-0011536通过miR-451a/VGF轴调节DRG细胞的神经元变化。
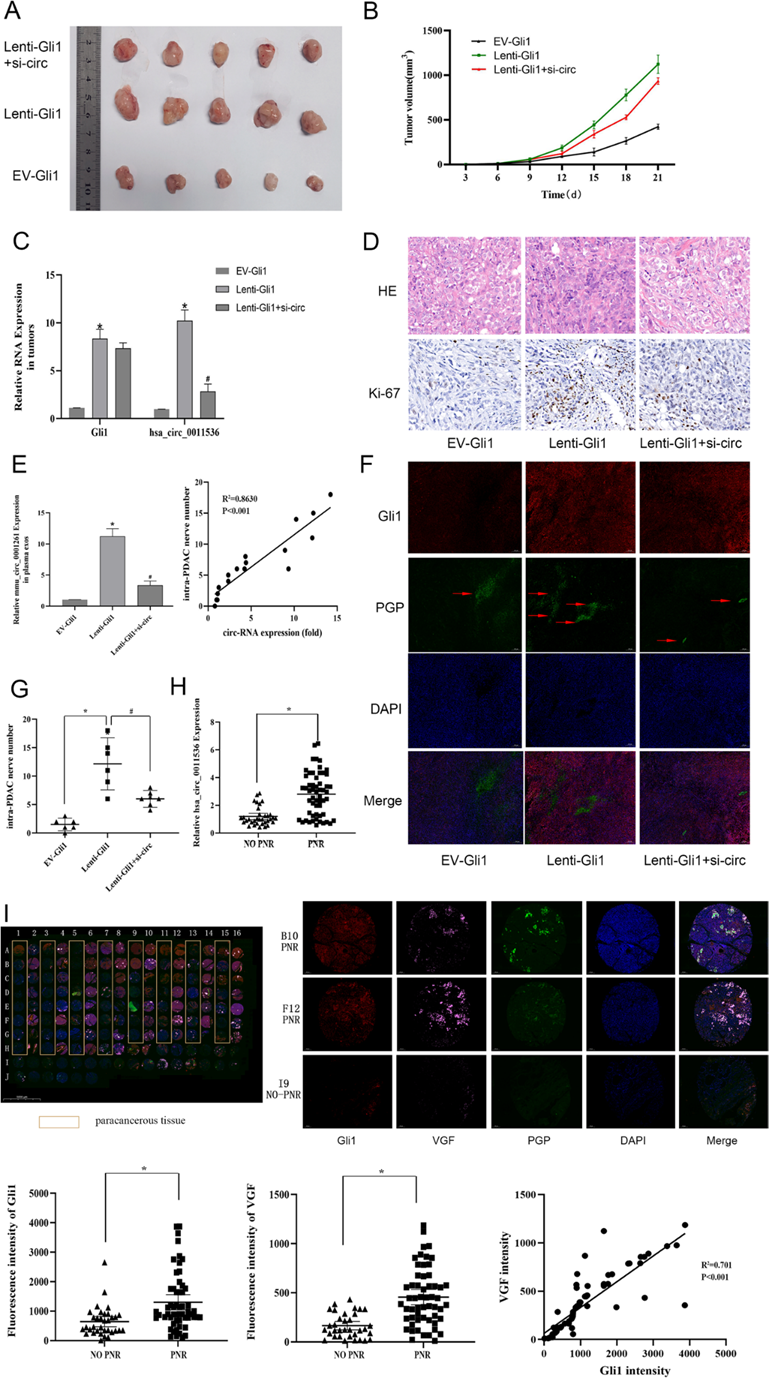
7)血浆外泌体中circ-0011536的水平是与PNR相关的预后生物标志物
为了确定circ-0011536在体内的作用,我们使用EV-Gli1和lenti-Gli1 CFPAC-1建立小鼠皮下致瘤模型。然后,我们对lenti-Gli1小鼠进行了circ-siRNA处理。首先,我们用苏木精-伊红染色和Ki-67染色来评估增殖水平,Ki-67核染色在lenti-Gli1组和阳性对照中较高。然而,在circ-siRNA处理后,在lenti-Gli1组织中观察到Ki-67的表达显著降低,从而表明在lenti-Gli1小鼠中具有抗增殖作用(图7D, E)。此外,Gli1过表达的肿瘤生长更快,而circ-siRNA处理后肿瘤生长受到抑制(图7A, B)。我们随后通过PCR检测肿瘤中Gli1和has-circ-0011536的表达,发现Gli1和circ-0011536的表达符合调控预期(图7C)。肿瘤组织中mmu-circ-0001261的表达与神经密度呈正相关。用siRNA处理的小鼠在肿瘤中显示出明显的神经衰减(图7F)。此外,在阳性对照组(PNST标本)和lenti-Gli1组中,Gli1和PGP9.5的细胞质染色均升高,而在circ-siRNA处理后,lenti-Gli1组织中几乎没有染色(图7G)。双免疫荧光染色结果显示,Gli1过表达后神经丛密度增加,但随着circ-siRNA的下调而降低(图7G, H)。PNR患者血浆外泌体中has-circ-0011536的表达显著升高(图7I)。最后,我们通过荧光三重染色TMA验证了Gli1与PNR之间的关系(图7J)。结果证实Gli1表达与PNR密切相关,显著增加VGF表达。上述结果提示circ-0011536可能在肿瘤中被Gli1上调,从而直接促进肿瘤内神经密度的增加,从而作为预测胰腺癌PNR的生物标志物。
结论:
我们的研究表明外泌体circ0011536通过激活hedgehog-Gli1信号调节PDAC中的神经改变。此外,我们的研究结果表明circ-0011536通过海绵化miR-451a促进VGF的表达。外泌体和circRNA抗核酸酶的独特优势使它们成为研究新的生物标志物和生物学机制的极好的潜在工具。未来,胰腺癌与神经细胞之间的信号转导通路还需进一步研究,为最终找到阻断神经侵袭通路的治疗策略奠定理论基础。
实验方法:
Western blotting,PCR,CCK-8,Transwell,Annexin‑V/PI染色,外泌体分离,RNA测序,荧光素酶报告试验,免疫组化,免疫荧光。
参考文献:
Dai W, Wu X, Li J, Tang W, Wang Y, Xu W, Han D, Xu X, Xu X. Hedgehog-Gli1-derived exosomal circ-0011536 mediates peripheral neural remodeling in pancreatic cancer by modulating the miR-451a/VGF axis. J Exp Clin Cancer Res. 2023 Dec 2;42(1):329. doi: 10.1186/s13046-023-02894-9.






