靶向基质细胞唾液化逆转肿瘤微环境中T细胞介导的免疫抑制
免疫抑制肿瘤微环境(TMEs)降低了癌症免疫反应的有效性。间充质间质细胞(MSCs)是癌症相关成纤维细胞(CAFs)的前体,在结直肠癌(CRC)中通过增强免疫细胞抑制来促进肿瘤进展。多糖的高唾液酰化通过唾液酸与免疫细胞上表达的受体Siglecs结合,促进癌症的免疫逃逸,从而抑制效应功能。唾液化在TME中形成MSC/ CAF免疫抑制中的作用尚未得到很好的表征。在这项研究中,作者发现肿瘤条件下的基质细胞增加了唾液基转移酶,a2,3/6链唾液酸和Siglec配体的表达。肿瘤调节基质细胞和CAFs诱导耗尽的免疫调节性CD8+ PD1+和CD8+ siglece -7+ / siglece -9+ T细胞表型。在体内,靶向基质细胞唾液化可逆转基质细胞介导的免疫抑制,如肿瘤和引流淋巴结中CD25和表达CD8+颗粒酶b的T细胞浸润。靶向基质细胞唾液化可能克服CRC TME的免疫抑制。该文与2023年5月发布于《Cell Reports》,IF=8.8。
技术路线:
主要研究结果:
1、肿瘤条件下的基质细胞表面a2,3-和a2,6-链唾液酸水平升高
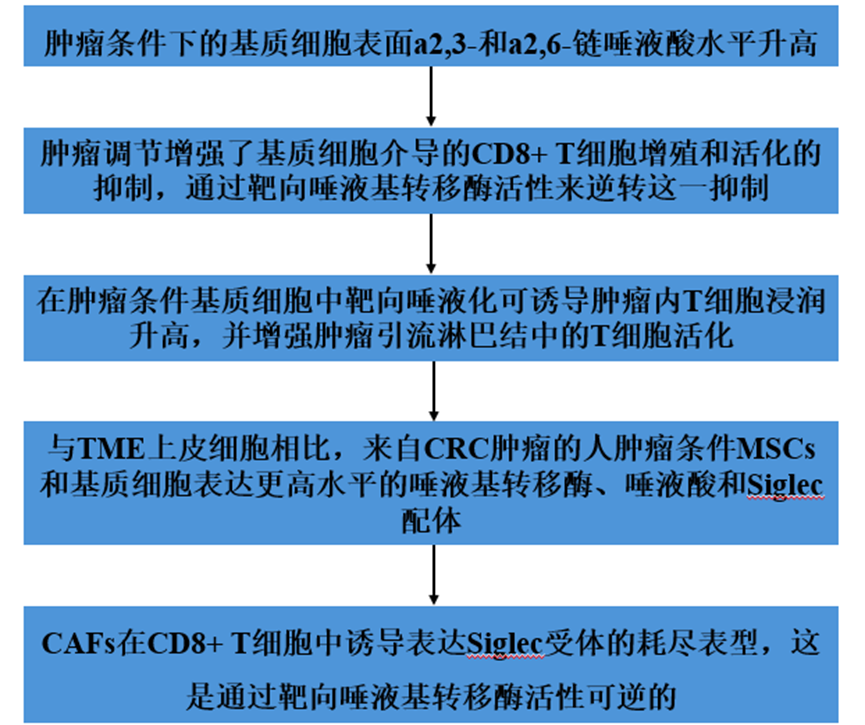
MSCs可以通过可溶性免疫抑制分子的分泌以及细胞间接触介导的免疫调节配体表达来感知和切换免疫反应。然而,间充质干细胞糖基化对其免疫调节潜能的影响尚未得到很好的表征。因此,作者试图评估糖基化在msc介导的T细胞增殖和活化抑制中的作用。采用生物素化凝集素cona、Galanthus nivalis (GNA)、wheat germ凝集素WGA和sambuus nigra (SNA-I),通过流式细胞术检测各自聚糖结构的表达水平。图1A显示了每种凝集素优先结合的示意图。与未染色的MSCs相比,唾液酸结合凝集素SNA-I和WGA在MSCs上的表达水平最高(图1B)。唾液酸的两个最常见的糖苷键是a2,3和a2,6。如图1C示意图所示,作者用CT26肿瘤细胞分泌组(CT26 MSCsTCS)调节小鼠MSCs,并分别用a2,3-和a2,6结合凝集素Maackia Amurenesis (MAL-II)和SNA-I孵育细胞,分析唾液酸的表达。流式细胞分析证实,MSCsTCS上a2,6,唾液酸的表达显著增加,但a2,3,唾液酸的表达不明显(图1D)。通过RNA测序,作者分析了控制唾液化的酶的mRNA表达水平,即a2,3-和a2,6特异性唾液基转移酶。图1E和1F分别显示了tcs条件和非条件MSCs之间a2,3和a2,6特异性唾液转移酶的差异表达。这凸显了唾液酸合成调控的复杂性,因为除了MSCsTCS增加了St3gal4的表达外,唾液基转移酶mRNA的表达没有明显的趋势。最后,在共培养实验中,与无条件MSCs相比,MSCsTCS抑制CD4+和CD8+ T细胞增殖(图1G)。在另一种肿瘤模型中也发现了类似的观察结果,即MM的5T3MM模型。许多研究都强调了基质细胞(包括MSCs和CAFs)在调节实体和血液肿瘤免疫中的作用。CRC和MM出现在基质密集的微环境中,其中基质细胞特征与免疫抑制有关。为了评估体外调节是否再现了体内TME,作者直接从患病5T33MM小鼠的骨髓中分离并扩增基质细胞(MM MSCs),并与野生型(WT) C57BL/ kalwrj来源的MSCs (MSCsControl)比较,评估其唾液酸表达(图1H)。a2,3 (MAL-II)和a2,6 (SNA-I)唾液酸在5T33MM小鼠的MSCs中表达较高(图1H)。5t33mm来源的MSCs也比wt来源的对照组具有更强的抑制作用,与对照组相比,可以显著抑制CD4+和CD8+ T细胞的增殖(图1I)。综上所述,这些数据证实了两个单独TMEs中的基质细胞表达较高水平的a2,3和a2,6唾液酸,这与增强的免疫抑制有关。
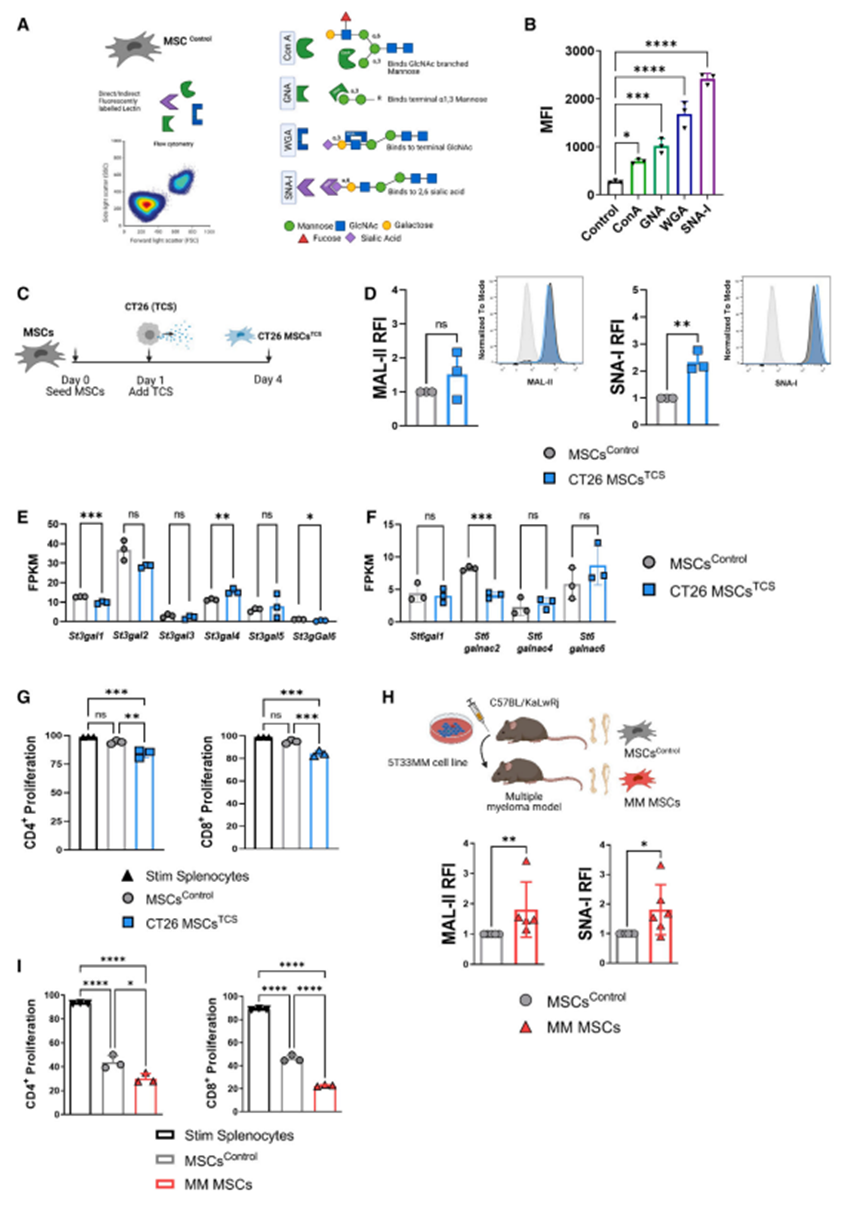 图1、肿瘤细胞分泌组诱导MSCs的唾液化
图1、肿瘤细胞分泌组诱导MSCs的唾液化
2、肿瘤调节增强了基质细胞介导的CD8+ T细胞增殖和活化的抑制,通过靶向唾液基转移酶活性来逆转这一抑制
虽然以前已经观察到肿瘤细胞的高唾液化,但作者在这里表明基质细胞的唾液化也可以在TME中被调节。为了确定基质细胞唾液化的意义,作者比较了肿瘤条件下基质细胞与结肠癌上皮细胞的唾液酸表达(图2A)。引人注目的是,与CT26上皮细胞相比,tcs条件下的基质细胞中a2,6唾液酸的基线水平明显更高(图2B)。为了评估这些唾液化蛋白对Siglec受体的结合亲和力,作者使用了Siglec- e受体Fc嵌合体。siglece是人类siglec7 /9的同源物,由免疫细胞如T细胞、巨噬细胞和中性粒细胞表达。它在细胞质区域含有一个抑制性ITIM。siglece配体在MSCsTCS上的表达显著高于对照MSCs(图2C)。接下来,作者评估了靶向基质细胞唾液化对T细胞功能和表型的功能影响。为了实现这一点,作者使用了唾液基转移酶抑制剂(SI) 3FaxNeu5Ac,一种唾液酸类似物。体外确定最佳SI浓度。SI预处理显示细胞活力、粒度、大小或形态没有显著差异,但显著降低了MSCsTCS上siglece配体、MAL-II和SNA-I的表达(图2D)。肿瘤条件基质细胞用SI预处理,随后与混合脾细胞或cd3分类T细胞共培养,以评估对T细胞的直接或间接影响(图2A)。如图2E-2H所示,MSCsTCS显著抑制CD4+和CD8+ T细胞的增殖。SI处理部分逆转了这种作用,在cd3分选共培养中,CD4+和CD8+ T细胞的增殖明显恢复(图2G和2H)。这些结果表明,唾液化在肿瘤诱导的msc介导的T细胞抑制中起关键作用。在cd3分类共培养中,免疫抑制作用更为显著,表明MSC唾液化对T细胞有直接作用。接下来,作者评估了T细胞的活化和表型,重点关注两种T细胞亚群的CD25和siglece表达。作者发现MSCsTCS在cd3分选T细胞培养物中显著抑制CD4+ CD25+和CD8+ CD25+ T细胞(图2K和2L),但在混合脾细胞中没有(图2I和2J)。具体来说,CD8+ CD25+ T细胞频率的恢复是通过抑制cd3分选T细胞培养基质细胞唾液化来观察的(图2L)。与MSCsTCS共培养对混合脾细胞培养中CD4+ siglece +或CD8+ siglece + T细胞的频率有相反的影响,可能表明细胞间相互作用的复杂性。在混合脾细胞共培养中,当与MSCsTCS共培养时,CD4+ siglece + T细胞的频率增加(图2M), SI没有明显的影响。然而,CD8+ siglece +细胞的频率以唾液化依赖的方式增加(图2N)。在cd3分类共培养中,当与MSCsTCS共培养时,CD4+ siglece +和CD8+ siglece + T细胞的反应相似(尽管CD8+ siglece + T细胞的总体百分比要高得多)(图20和2P)。这种作用依赖于唾液酰化,因为SI的添加导致CD4+ siglece +和CD8+ siglece + T细胞的频率显著降低。总的来说,在MSCsTCS中,抑制唾液基转移酶活性后,CD8+ T细胞表型发生了最显著的改变。总的来说,这些数据表明,在肿瘤调节后,基质细胞唾液化会被诱导,从而增强基质细胞的免疫抑制,并可以决定CD8+ T细胞的表型、siglece的表达和功能。
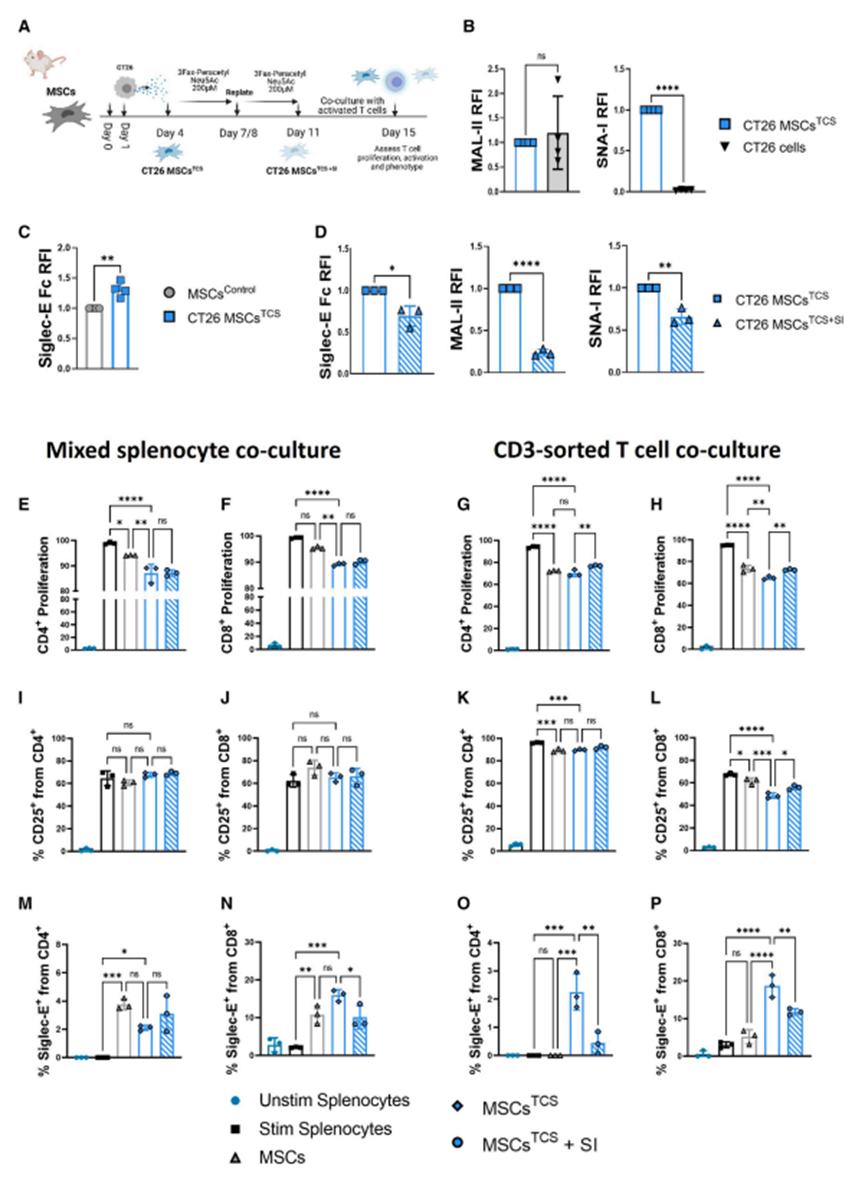 图2、肿瘤条件MSCs以唾液化依赖的方式抑制CD8+ T细胞效应表型
图2、肿瘤条件MSCs以唾液化依赖的方式抑制CD8+ T细胞效应表型
3、在肿瘤条件基质细胞中靶向唾液化可诱导肿瘤内T细胞浸润升高,并增强肿瘤引流淋巴结中的T细胞活化
接下来,作者研究了靶向肿瘤基质细胞唾液化对体内免疫反应的影响。利用免疫活性的Balb/c皮下肿瘤模型,作者先前发现MSCs和CT26癌细胞共同给药可促进肿瘤的发生和侵袭。为了评估靶向唾液化对早期免疫细胞浸润的影响,作者在基质细胞存在或不存在、SI预处理或不预处理的情况下诱导CT26肿瘤。作者之前证明基质细胞诱导的肿瘤促进在诱导后16-18天是明显的(数据未显示);因此,为了评估靶向基质细胞唾液化对类似大小肿瘤早期免疫细胞浸润的影响,作者在第13天评估了免疫表型。众所周知,肿瘤浸润性T细胞在许多类型的实体肿瘤(包括CRC)中具有很强的预后(例如,无病生存率和总生存率)意义。因此,作者将体外免疫细胞分析的重点放在CD4+和CD8+ T细胞频率和表型上。循环T细胞表达低水平的抑制性siglece -9受体;然而,瘤内CD4+和CD8+ T细胞在黑色素瘤、非小细胞肺癌和结直肠癌中表达上调。作者的数据支持这一发现,因为作者证实,与引流淋巴结(DLN)、非引流淋巴结(NDLN)和脾脏中的T细胞相比,siglece在CD4+和CD8+肿瘤浸润T细胞上均上调(图3A和3B)。CT26肿瘤具有免疫原性,可被T细胞和先天免疫细胞浸润。与单独接受CT26细胞的小鼠相比,MSCsTCS显著抑制了皮下肿瘤中表达cd25的活化CD4+和CD8+ T细胞的水平(图3C、3E)。然而,注射前对MSCsTCS进行SI处理导致这种作用完全逆转,激活T细胞恢复到与ct26处理小鼠肿瘤相当的水平。接下来,作者评估肿瘤内CD4+ siglece +和CD8+ siglece + T细胞的水平(图3D, 3F)。结果与作者对表达cd25的T细胞的研究结果惊人地相似,MSCsTCS显著抑制CD4+ siglece +和CD8+ siglece + T细胞,SI预处理逆转了这种作用。考虑到siglece表达的增加通常与免疫抑制的增加有关,这些数据相当令人惊讶。然而,Haas及其同事在黑色素瘤患者中发现CD8+细胞毒性T细胞中siglece -9 (siglece的同系物)表达升高,这可能解释了这一发现。此外,如图3G所示,与未注射SI的小鼠相比,注射SI预处理的肿瘤条件MSCs的小鼠表达颗粒酶b的细胞毒性CD8+ T细胞水平也有所升高。考虑到肿瘤dln作为抗肿瘤发展的主要位点,以及它们在增强细胞毒性t淋巴细胞相关抗原4 (CTLA-4)和程序性细胞死亡蛋白1 (PD-1)阻断功效方面的作用,研究越来越多地将注意力转向肿瘤dln,以寻找强大的抗肿瘤免疫证据。因此,作者评估了DLN、NDLN和脾脏的T细胞浸润情况。如图4A、4C所示,联合注射MSCsTCS,无论是否进行SI预处理,其对dln的影响与肿瘤内观察到的效果相似(图3D和3F);也就是说,MSCsTCS显著降低了活化的CD4+ CD25+和CD8+ CD25+ T细胞的水平,SI预处理使水平恢复到基线水平。此外,与未注射SI预处理MSCsTCS的小鼠相比,共注射SI预处理MSCsTCS的小鼠DLNs中细胞毒性CD8+ T细胞颗粒酶B的表达显著增加(图4E)。有趣的是,与作者的肿瘤内观察结果相反,联合注射MSCsTCS,无论是否进行SI预处理,表达siglece的T细胞水平都不受影响(图4B、4D)。作者对荷瘤小鼠脾脏中相同的T细胞表型的分析显示了与dln相似的结果。这表明MSCsTCS和SI预处理的MSCsTCS分别诱导的抑制和随后的抑制逆转是对特定T细胞表型的特异性调节。通过比较dln和ndln中活化的CD4+和CD8+ T细胞频率,进一步强调了这一点。虽然MSCsTCS联合注射后,荷瘤小鼠DLNs中CD4+ CD25+和CD8+ CD25+ T细胞的频率被抑制,但ndndns中CD4+ CD25+和CD8+ CD25+ T细胞的水平仍显著升高(腹股沟;左侧)(图4F和4G)。此外,作者观察到SI预处理的MSCsTCS小鼠中细胞毒性CD8+颗粒酶B+ T细胞的频率增加,特别是在dln中观察到。ndln无显著性差异(图4H)。作者的体内数据表明基质细胞具有强大的抑制作用。
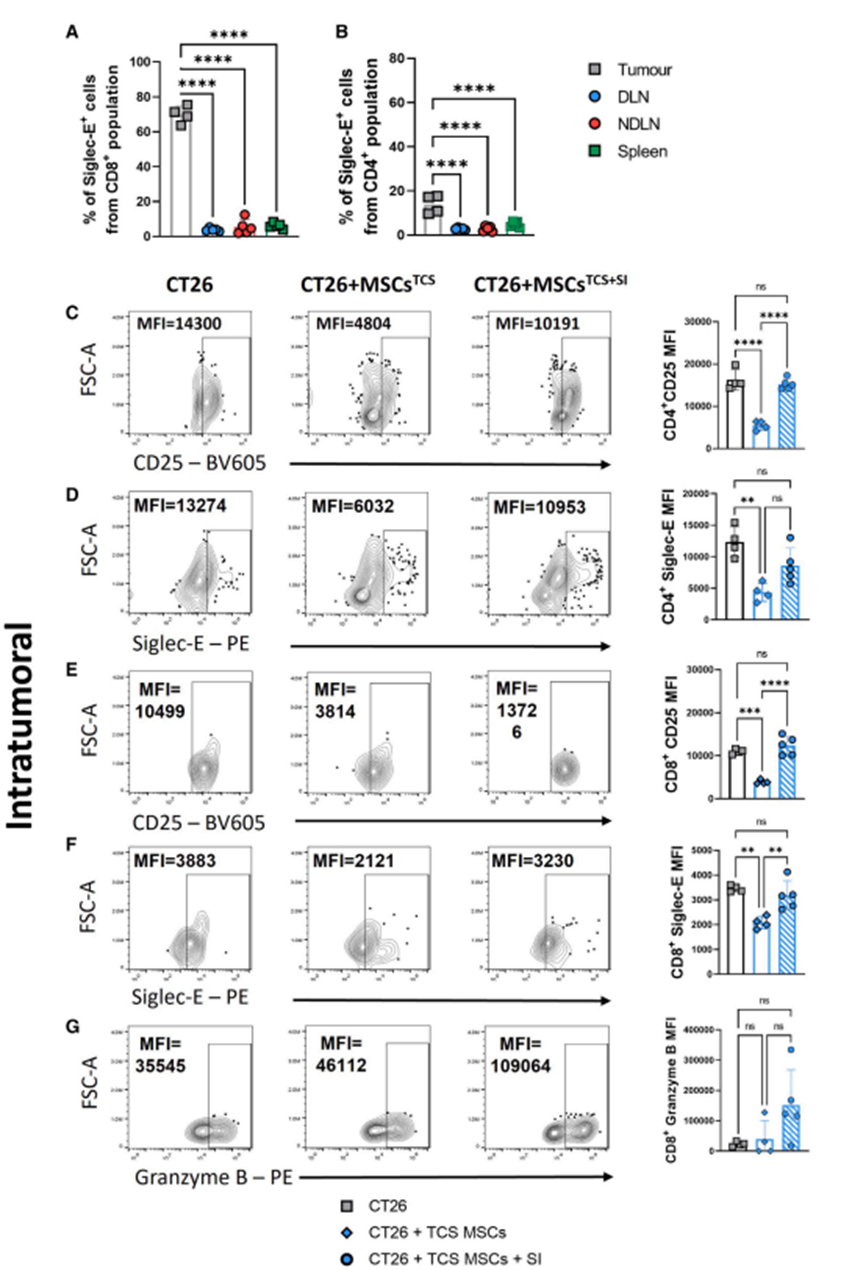
图3、去唾液酸化的肿瘤条件基质细胞增强了活化T细胞在瘤内的浸润
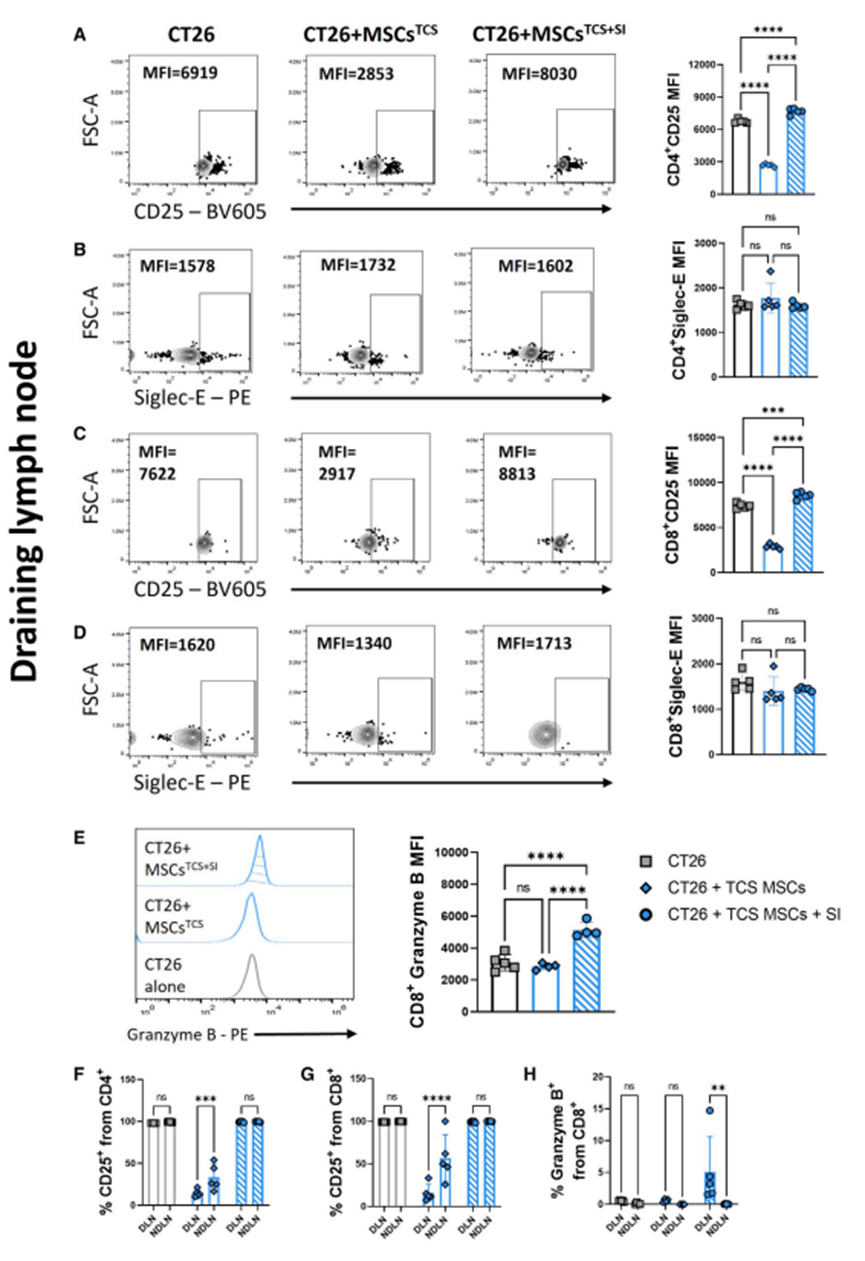 图4、唾液转移酶抑制逆转肿瘤条件基质细胞介导的T细胞抑制,并增加CD8+ T细胞在引流淋巴结中的颗粒酶B表达
图4、唾液转移酶抑制逆转肿瘤条件基质细胞介导的T细胞抑制,并增加CD8+ T细胞在引流淋巴结中的颗粒酶B表达
4、与TME上皮细胞相比,来自CRC肿瘤的人肿瘤条件MSCs和基质细胞表达更高水平的唾液基转移酶、唾液酸和Siglec配体
为了评估作者发现的临床相关性,作者评估了人类结直肠癌组织病理标本中的基质和上皮细胞区域。T细胞定位评估显示,CRC间质区CD3+和CD8+ T细胞密度明显高于上皮区(图5A和5B)。使用QuPath进行定量验证,在结直肠肿瘤中,基质区相关的CD3+(图5C,左)和CD8+ T细胞(图5C,右)的数量明显高于上皮区。接下来,作者使用人类数据集、人类肿瘤细胞系和基质细胞来分析人类结直肠癌组织中多种a2,3和a2,6特异性唾液基转移酶的表达。作者分析了基因表达谱(GEO: GSE35602),这些CRC切除样本在微阵列谱分析之前被激光捕获微解剖以分离基质和上皮部分。对该数据集中多个唾液转移酶的评估表明,与上皮细胞区室相比,a2,3特异性唾液转移酶ST3GAL1, ST3GAL4和ST3GAL6的表达与间充质谱系标记a-SMA (ACTA2), vimentin (VIM), CD90 (THY1), PDGFR-a (PDGFRA)和CD105 (ENG)的共同表达更密切相关(图5D)。ST3GAL1、ST3GAL4和ST3GAL6基因的相对表达量的定量证实了这一点,显示这三个基因在基质部分的表达明显高于上皮部分(图5E)。a2,6特异性唾液转移酶ST6GAL1和ST6GAL2的表达没有明显改变(图5E)。此外,作者观察到a2,6特异性ST6GALNAC6的表达显著增加,它优先将唾液酸添加到糖脂中,而不是糖蛋白中,同时唾液酸酶NEU1显著降低(图5F)。为了扩展这些观察结果,作者分析了从结直肠癌组织(CAFs)和邻近正常粘膜组织(正常相关成纤维细胞[NAFs])中分离的患者匹配的原代成纤维细胞的转录谱(GEO: GSE70468)。虽然作者观察到NAFs和CAFs之间ST3GAL1、ST3GAL4和ST3GAL6(数据未显示)的表达水平没有显著差异,但与NAFs相比,CAFs中ST6GAL1和ST6GAL2的相对表达水平显著升高(图5G)。综上所述,这些数据表明,与上皮细胞相比,结直肠癌微环境的间质室中a2,3连锁特异性唾液转移酶的水平升高。此外,在基质室中,与正常相邻基质细胞相比,CAFs表达更高水平的a2,6连锁特异性唾液转移酶。为了探索基质细胞和Siglec受体之间的关联,作者接下来访问了cBioPortal,以评估作为基质细胞标志物的成纤维细胞激活蛋白(FAP)与人类免疫细胞已知表达的9种携带ITIM基序的Siglec受体之间的潜在相关性(图6A)。本研究分析了594例结直肠癌基因组图谱(TCGA)胰腺癌图谱数据集中的患者。如图6A和6B所示,根据Spearman相关系数,与FAP正相关最强的两个Siglec受体是Siglec-9和Siglec-7(分别为0.66和0.63)。因此,作者使用siglece -7/9 Fc嵌合体评估了人骨髓来源的MSCs±HT29和HCT116 TCS调节(图6C)对特异性siglece -7/9配体的表达。结果显示,与癌细胞相比,tcs条件下的MSCs表达了更高水平的Siglec配体(图6D和6E)。接下来,作者研究了临床CRC标本中的基质细胞唾液化。从结直肠癌肿瘤中分离出CAFs,从肿瘤邻近非癌组织中分离培养患者匹配的癌症相关正常成纤维细胞(NAFs)(图6F)。分析NAFs和CAFs中典型基质细胞表征标志物的表达情况。使用基于凝集素的流式细胞术,作者观察到NAFs和CAFs表达a2,3唾液酸的水平相当;然而,a2,6唾液酸在cas中的表达明显更高(图6G)。特异性Siglec配体染色显示,虽然NAFs和CAFs都表达Siglec-7配体,但CAFs上Siglec-9配体的表达量明显更高(图6H)。这些发现证明了siglecc配体在TME的基质细胞上表达,这可能调节了表达siglecc的免疫细胞的激活
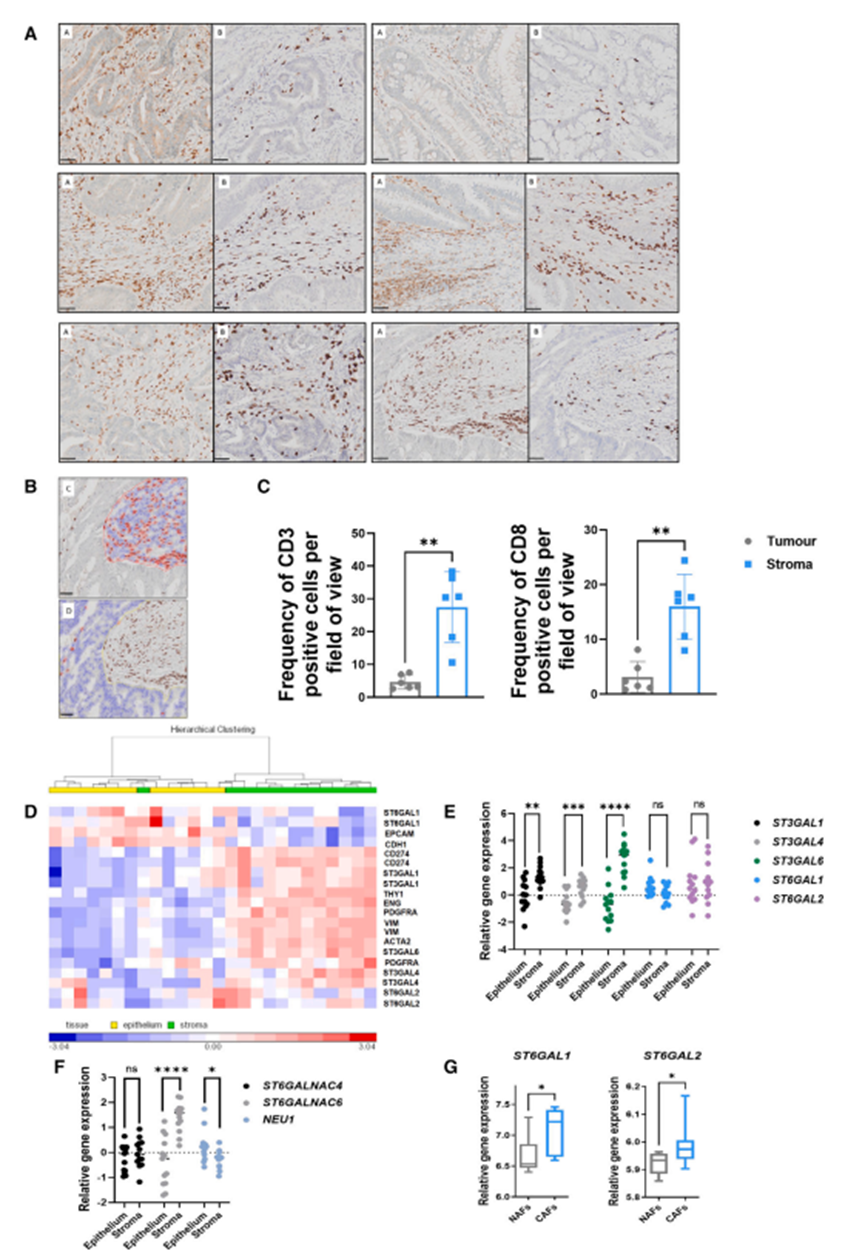
图5、与肿瘤上皮相比,结直肠癌肿瘤相关间质具有较高的T细胞浸润和唾液转移酶基因表达
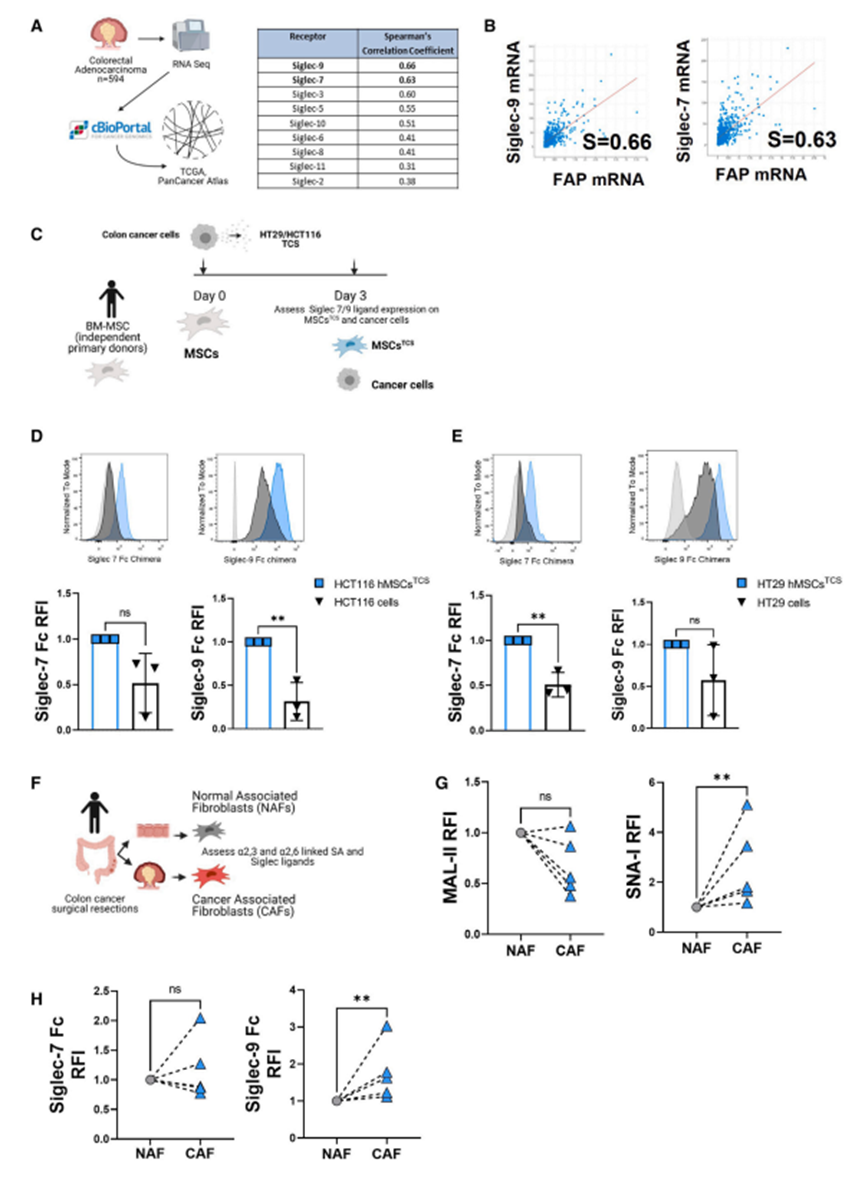 图6、肿瘤状态的人MSCs和CRC肿瘤来源的cas唾液酸表达水平升高
图6、肿瘤状态的人MSCs和CRC肿瘤来源的cas唾液酸表达水平升高
5、CAFs在CD8+ T细胞中诱导表达Siglec受体的耗尽表型,这是通过靶向唾液基转移酶活性可逆的
为了评估唾液化对基质细胞介导的免疫抑制的功能影响,作者将CRC患者来源的NAFs和CAFs与来自健康供者的外周血单个核细胞(PBMCs)或cd3分类的T细胞共培养(图7A)。与单独使用antid3 /CD28刺激的PBMCs相比,两种基质细胞群均能显著抑制CD4+和CD8+ T细胞的增殖。引人注目的是,即使在多次体外传代后,CAFs的抑制作用也明显强于NAFs(图7B)。作者还观察到,在与CAFs共培养后,表达siglece -7受体的细胞的总频率显著高于与NAFs共培养的细胞。接下来,作者用两种不同的方法评估了脱氮化对caf诱导的CD8+ T细胞衰竭的影响。在与T细胞共培养之前,用si3faxneu5ac或唾液酸酶(裂解唾液酸)处理NAFs/CAFs。作者证实了siglece -9配体在si处理的CAFs上的显著抑制作用。共培养后,作者分析了CD8+ siglece -7+和CD8+ siglece -9+ T细胞的频率。如图7C和7F所示,与受刺激的pbmc相比,CAFs分别诱导了更高水平的CD8+ siglece -7+和CD8+ siglece -9+ T细胞。此外,CAFs还诱导CD8+ PD-1+ T细胞的比例显著增加(图7I),而CD4+ PD1+ T细胞的比例明显增加。在共培养前用SI处理CAFs导致CD8+ siglece -7+和CD8+ siglece -9+ T细胞的频率显著降低(图7D和7G)。这一效应是CAFs特有的,因为与NAFs±SI预处理共培养后,CD8+ T细胞群的频率没有变化(图7D和7G)。作者使用唾液酸酶验证了这些发现(图7E和7H),并观察到CD8+ siglece -7+和CD8+ siglece -9+ T细胞具有相同的显着作用。这是一个重要的发现,虽然体内系统给药可能有肾毒性作用,但唾液酸酶耐受性良好,目前正在进行1/2期临床试验(Palleon Pharmaceuticals)。CAFs诱导CD4+ siglece -9+ T细胞的频率更高,但是,与它对CD8+ T细胞的作用相反,SI预处理对逆转这种增加没有作用。作者观察到,在与si处理的CAFs共培养中,CD8+ PD-1+ T细胞的频率明显下降(图7J),当用唾液酸酶处理时,CD8+ PD-1+ T细胞的频率下降更为显著(图7K)。在这种情况下,效果不是CAF特异性的,因为作者观察到唾液酸酶处理的NAFs也有类似的显著降低(图7K)。SI预处理对CD4+ PD-1+ T细胞水平无影响。最后,作者评估了唾液酸酶对与cd3分类T细胞直接共培养的NAFs和CAFs的影响。如图7L和7M所示,CAFs诱导CD8+ siglece -9+ T细胞的频率更高,而唾液酸酶的脱盐作用显著逆转了这些作用。在CD8+ -PD-1+ T细胞中也观察到类似的发现(图7N和7O)。作者还证实,pbmc直接暴露于唾液酸酶对T细胞亚群没有影响。这些结果表明,tme衍生的CAFs可以抑制活化的T细胞并促进CD8+ T细胞衰竭,并且这种免疫抑制作用可以通过调节基质细胞表面的唾液化而显著逆转。

图7、CAFs在CD8+ T细胞中诱导唾液依赖的耗尽表型
结论
总之,作者已经证明,不仅TME内的基质细胞高度唾液化,而且唾液聚糖在其免疫调节特性中发挥重要作用,抑制免疫细胞激活,这可能至少部分是由于与Siglec受体的相互作用。这些数据表明,降低MSCs唾液化的策略可能在CRC、MM和其他恶性肿瘤中具有重要的免疫激活作用,值得进一步研究。
实验方法:
流式细胞术、T细胞扩增与活化实验、共培养实验、免疫组化、TCGA及GEO数据库生信分析
参考文献
Egan H, Treacy O, Lynch K, Leonard NA, O'Malley G, Reidy E, O'Neill A, Corry SM, De Veirman K, Vanderkerken K, Egan LJ, Ritter T, Hogan AM, Redmond K, Peng L, Che J, Gatlin W, Jayaraman P, Sheehan M, Canney A, Hynes SO, Kerr EM, Dunne PD, O'Dwyer ME, Ryan AE. Targeting stromal cell sialylation reverses T cell-mediated immunosuppression in the tumor microenvironment. Cell Rep. 2023 May 30;42(5):112475. doi: 10.1016/j.celrep.2023.112475. Epub 2023 May 10. PMID: 37167967.






