肠道微生物代谢物通过抑制铁死亡促进结直肠癌发展
肠道菌群在人类健康中起着至关重要的作用。越来越多的证据表明,肠道微生物通过产生致癌代谢物参与肿瘤的发生发展。然而,其潜在的分子机制尚不清楚。本研究中,作者发现了一种来源于厌氧菌消化链球菌的色氨酸代谢物,反式-3-吲哚丙烯酸(IDA),促进结直肠癌的发生。在机制上,IDA作为芳香烃受体(AHR)的内源性配体,转录上调ALDH1A3(乙醛脱氢酶1家族成员A3)的表达,ALDH1A3利用视网膜作为底物产生NADH,NADH是铁死亡抑制蛋白1(FSP1)介导的还原辅酶Q10合成所必需的。该研究于2024年1月发表在《Nature Cell Biology》,IF:21.3。
技术路线:
主要研究结果:
1. IDA是一种有效的铁死亡抑制因子
建立包含350种内源性人类宿主和肠道微生物代谢物的筛选文库,用于786-O人肾腺癌细胞的铁死亡测定(图1a)。筛选数据确定IDA,IDA由肠道微生物群的色氨酸代谢产生,它显著抑制RSL3诱导的铁死亡(图1b)。为验证这一发现,利用两个经典的铁死亡敏感癌细胞系(786-O和HT1080人纤维肉瘤细胞)来测试IDA的效果,发现经IDA处理的细胞对铁死亡具有稳健的抗性(图1c,d)。检测IDA孵育的HT1080细胞的脂质过氧化水平,发现IDA显著降低脂质过氧化(图1e),表明IDA是一种有效的铁死亡抑制因子。
补充10 μM的IDA有效地消除HT1080细胞的铁死亡,而低剂量(10 - 100 μM)的其他色氨酸衍生物没有显示出强大的保护作用(图1f)。此外,补充IDA(而非任何其他色氨酸代谢物)大大消除HT29人结肠癌细胞的铁死亡(图1g)。由于IDA能更有效地抑制铁死亡,因此将重点放在IDA介导的铁死亡抑制上。在HT29细胞和MC38小鼠结肠癌细胞中,IDA处理显著抑制高水平的铁死亡和脂质过氧化(图1h-k)。预测所有色氨酸代谢物的亲脂性,并通过2,2-二苯基-1-酸酐肼(DPPH)和荧光激活的抑制自氧化(FENIX)检测它们捕获自由基的活性,这些数据表明,IDA不能直接减少氧化脂质(图1l),提示IDA可能通过细胞信号通路介导铁死亡。
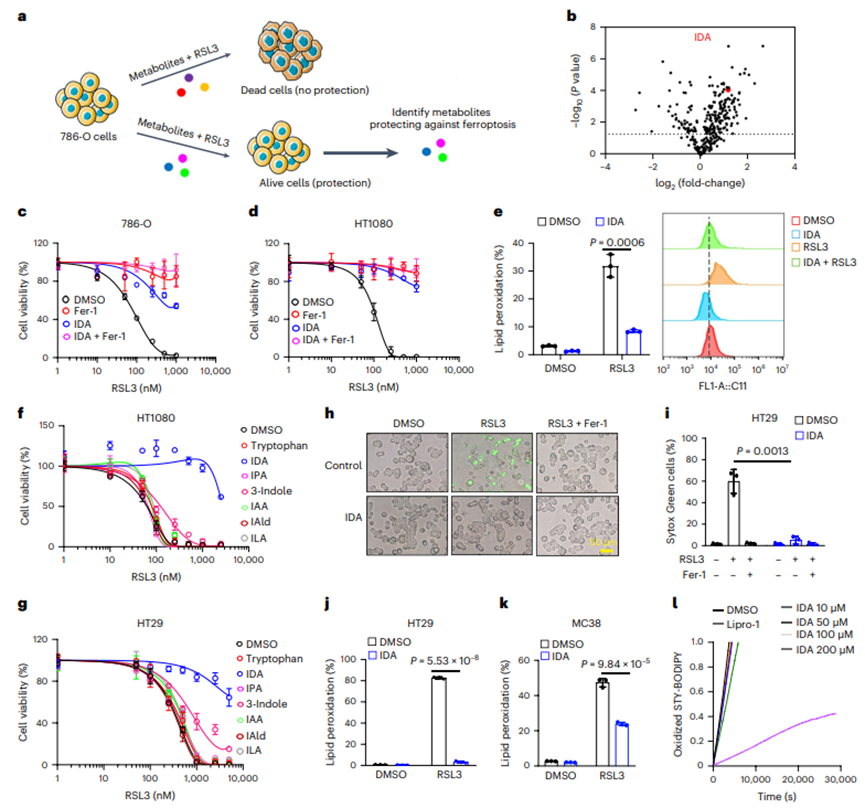
图1. IDA是一种有效的铁死亡抑制因子
2. IDA促进结直肠肿瘤的发展
将HT29和MC38细胞培养成三维(3D)肿瘤球体,以更好地模拟体内环境。如图2a,b所示,在HT29肿瘤球体中,RSL3或咪唑酮erastin (IKE)诱导的铁死亡可以通过补充IDA或利前列腺素-1 (Lipro-1)得到很大程度上的抑制。同样,在HT29类器官(图2c,d)中也观察到类似的结果。HT29异种移植发现IDA显著消除脂质过氧化作用,并促进肿瘤发展(图2e-g)。与这一发现一致,IDA在C57BL/6J小鼠中显示出对铁死亡的强保护作用,并促进MC38异种移植的进展(图2h-j)。
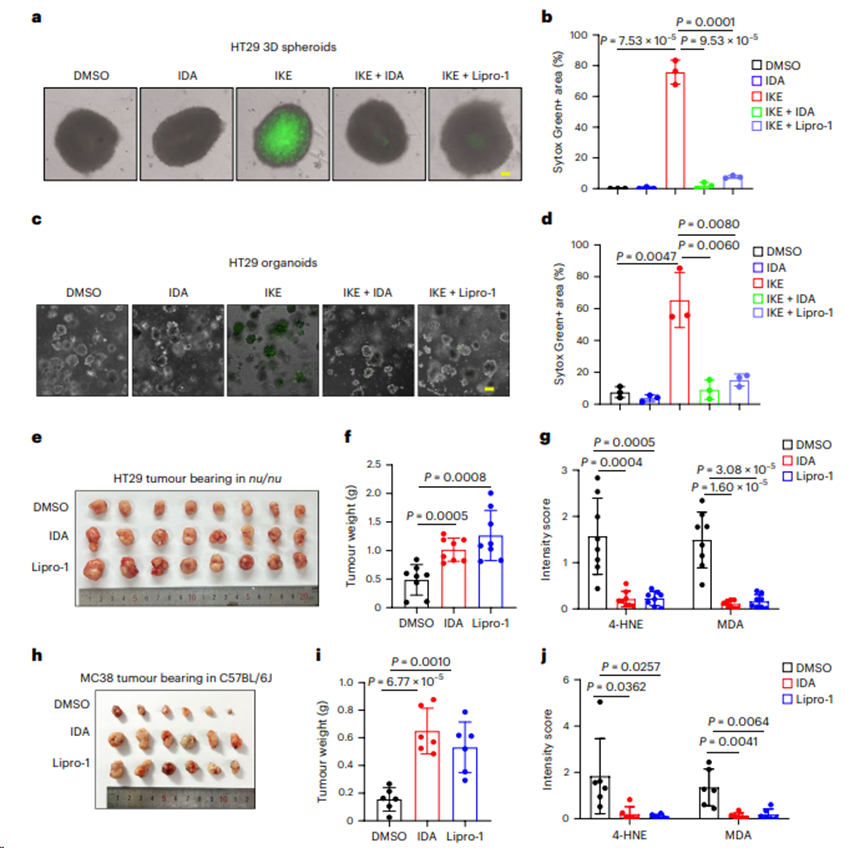
图2.IDA促进结直肠肿瘤发展
3.AHR是IDA介导的铁死亡抑制所必需的
使用AHR拮抗剂BAY218和StemRegenin 1 (SR1),发现AHR拮抗剂显著消除IDA调节的铁死亡抑制(图3a)。沉默HT29细胞中的基因表达(图3b)。正如预期的那样,在表达小发夹(sh)-AHR的细胞中,IDA未能抑制铁死亡(图3c)。此外,通过成簇的不规则间隔短回文重复序列(CRISPR) -Cas9技术敲除AHR(图3d)。事实上,由于AHR表达缺失,IDA未能挽救铁死亡细胞(图3e,f)。
在HT29和HT1080细胞中进一步生成AHR - / -克隆,在AHRnullHT29细胞中,IDA介导的铁死亡抑制通过AHR的异位表达得以恢复(图3g-j)。为研究AHR是否促进体内IDA介导的肿瘤发生,野生型(WT)和AHR KO HT29异种移植实验证实在AHR - / -细胞中,IDA的保护作用基本上被消除(图3k-n)。
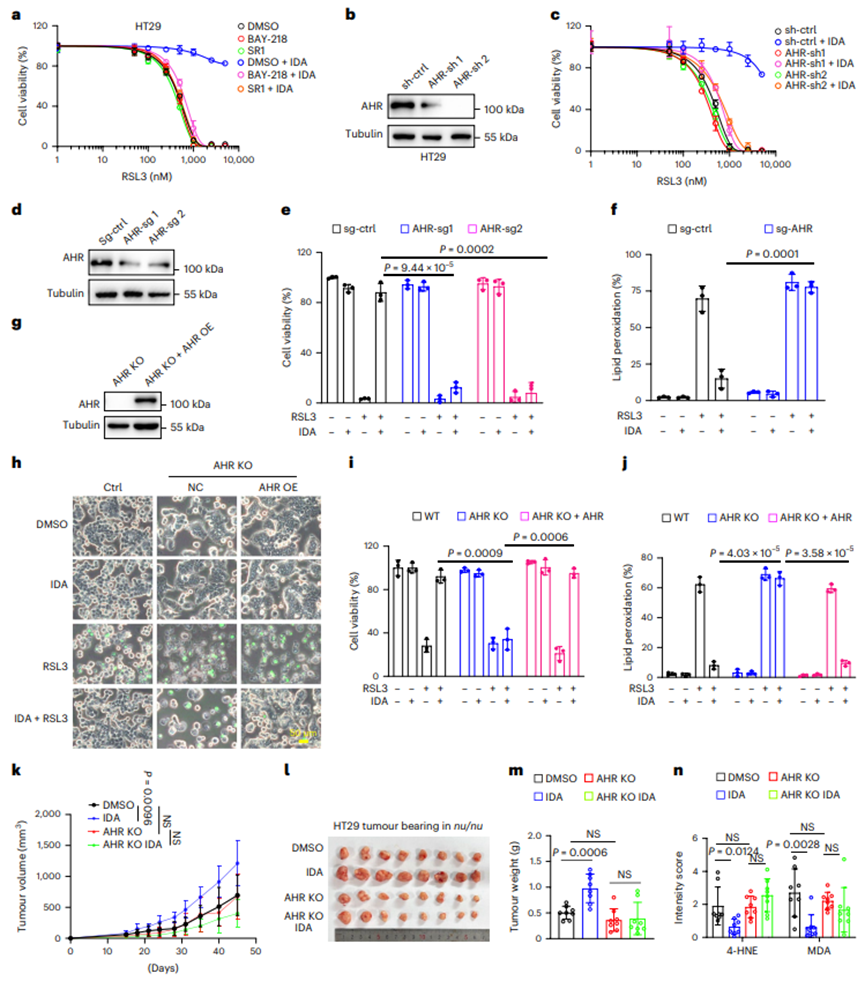
图3.AHR是IDA介导的铁死亡抑制所必需的
4. FSP1是IDA抗铁死亡作用所必需的
在HT29和HT1080细胞中构建FSP1−/−克隆,以验证FSP1是否参与IDA调节的铁死亡抵抗。如图4a,b所示,在HT29细胞中,敲除FSP1后,IDA- AHR轴的保护作用大大减弱,而WT HT29细胞对IDA介导的铁死亡抑制反应明显。与HT29 FSP1单向导(sg)RNA细胞相似,HT1080细胞中FSP1的缺失完全阻断了IDA的抗铁死亡作用(图4c-f)。相反,FSP1的异位表达挽救了这一表型(图4g,h)。在HT29 WT细胞中,补充IDA促进肿瘤的发展,而在FSP1 KO细胞中,IDA的作用基本上被消除(图4i,j),这表明IDA - AHR轴介导的铁死亡抑制依赖于FSP1。
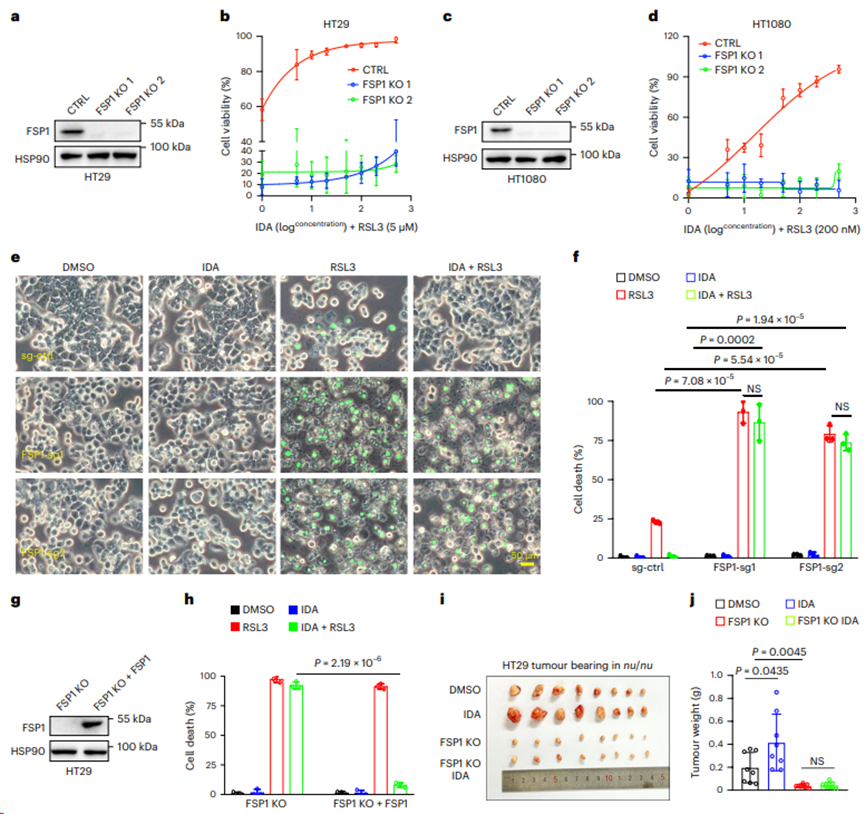
图4. FSP1是IDA抗铁死亡作用所必需的
5. IDA通过AHR-ALDH1A3-FSP1-CoQ10轴抑制铁死亡
对IDA处理的HT29细胞进行RNA测序(RNA-seq)。在可能由IDA介导的排名最高的基因中,ALDH1A3是上调最多的(图5a)。对IDA和IPA处理的细胞进行比较RNA-seq,以寻找特异性参与IDA应答的候选基因。逆转录酶定量PCR (RT-qPCR)和蛋白质印迹分析证实,ALDH1A3的信使RNA和蛋白水平在IDA处理后显著升高(图5b,c),这意味着ALDH1A3可能是AHR的直接下游靶点。通过与共有AHR结合基序(GCGTG)比较,发现三个潜在的结合区域(R1-R3),其中R3包含相同的序列(图5d)。在有或没有IDA处理的HT29中进行ChIP检测。有趣的是,在IDA作用下,内源性AHR与ALDH1A3转录起始位点(TSS)上游约100 bp处的R3具有很强的亲和力,而与R1或R2没有亲和力(图5e),这表明AHR在被IDA激活的情况下可以募集到ALDH1A3启动子上。
为测试ALDH1A3在铁死亡中的作用,在HT29细胞中阻断ALDH1A3的表达并检测了铁死亡细胞的水平。如图5f,g所示,ALDH1A3缺失使细胞对脂质过氧化诱导的铁死亡明显敏感。此外,ALDH1A3表达的降低削弱了IDA抑制铁死亡的能力(图5h)。视网膜或维生素a调节的铁死亡保护依赖于ALDH1A3(图5i),这表明视网膜通过ALDH1A3的酶活性使细胞抵抗铁死亡。使用ALDH1酶抑制剂双硫仑来测试ALDH1A3的作用。正如预期,双硫仑诱导了高水平的铁死亡,并减弱了IDA和ALDH1A3介导的铁死亡抑制作用(图5j)。
为研究ALDH1A3在肿瘤发展中的作用,测试ALDH1A3的缺失或药物抑制是否影响肿瘤细胞的生长。正如预期的那样,ALDH1A3的缺失显著抑制肿瘤的进展,并阻断IDA促进的肿瘤生长(图5k,l)。体外实验表明纯化的ALDH1A3可以通过视网膜产生NADH(图5m,n)。此外,ALDH1A3的缺失显著降低了NADH水平,而在ALDH1A3 KO细胞中补充NADH恢复了铁死亡(图5o,p)。此外,在ALDH1A3−/−和FSP1−/−细胞中检测到较低的还原和氧化CoQ10比例(图5q)。总之,这些数据表明,ALDH1A3对IDA–AHR–FSP1–CoQ10-介导的铁死亡抑制至关重要。
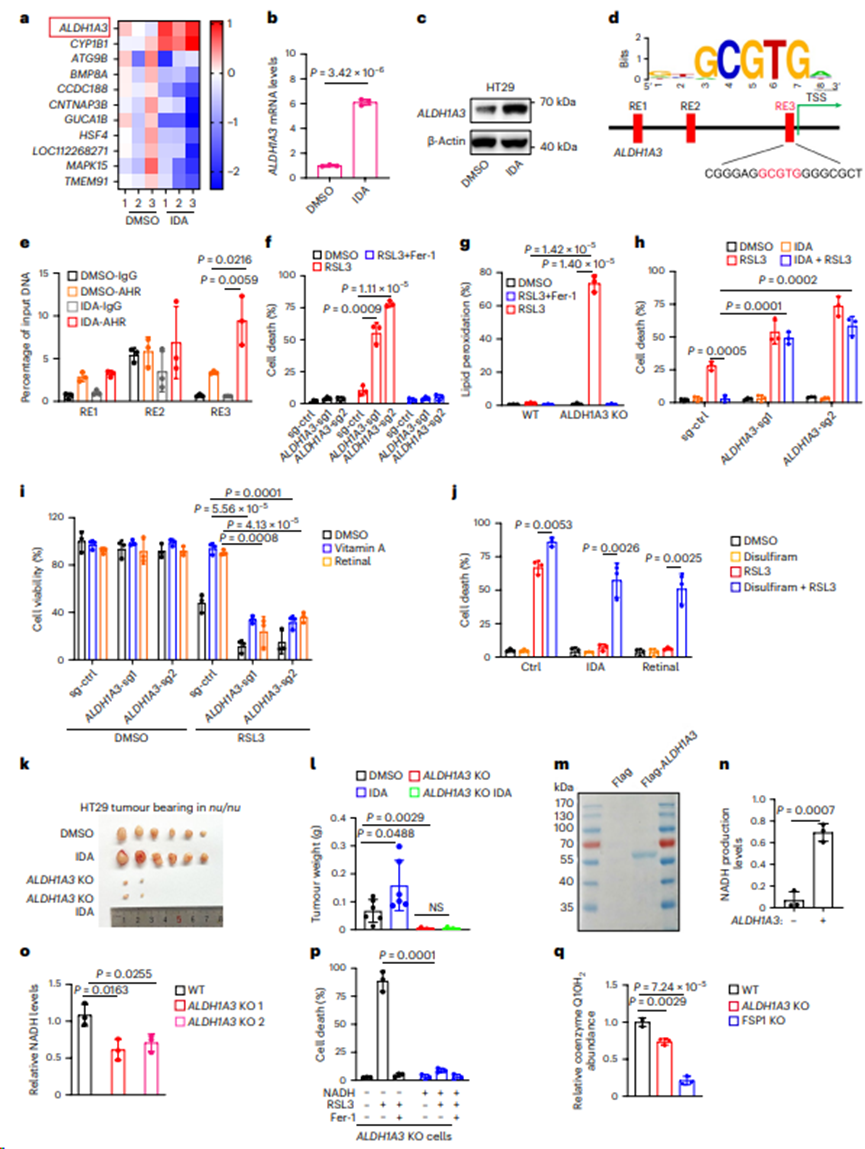
图5. IDA通过AHR-ALDH1A3-FSP1-CoQ10轴抑制铁死亡
6. 厌氧菌是IDA生物合成的主要因素
为研究IDA在结直肠癌发展中的来源,从健康人和结直肠癌患者的粪便中分离微生物种类,并分别使用16S核糖体RNA基因测序和质谱(MS)进行代谢组学分析,对微生物组成进行大规模表征。结果发现厌氧菌(一种与CRC6相关的已知细菌)在CRC患者中显著富集(图6a)。通过MS对代谢物的分析表明,厌氧菌产生了可检测到的IDA含量(图6b)。此外,与健康人相比CRC患者粪便中的IDA含量要高得多 (图6c),厌氧菌的丰度与粪便IDA水平呈正相关(图6d)。在厌氧条件下培养厌氧菌,并使用液相色谱(LC) -MS技术检测上清液中多种色氨酸衍生物的水平。事实上,厌氧菌有效地利用色氨酸产生高水平的IDA和IPA(图6e,f)。IDA浓度在12 h达到约15 μM(图6e)。此外,厌氧菌上清液处理HT29细胞后,ALDH1A3和CYP1A2的水平显著升高,而大肠杆菌上清液对其无影响(图6g,h)。此外,在添加厌氧菌上清液的细胞中,铁死亡被显著抑制(图6i)。正如所料,损失AHR消除这一作用,而AHR过表达恢复这一保护作用(图6j)。体内瘤内注射厌氧菌并检测肿瘤中IDA的含量。IDA在肿瘤中的浓度(约5 μM)有效降低CRC铁死亡并促进肿瘤生长(图7a-d)。此外,IDA的生理浓度足以消除体内的脂质过氧化和铁死亡(图7a-d)。综上所述,表明生理浓度的IDA在体外和体内都能有效地抑制铁死亡
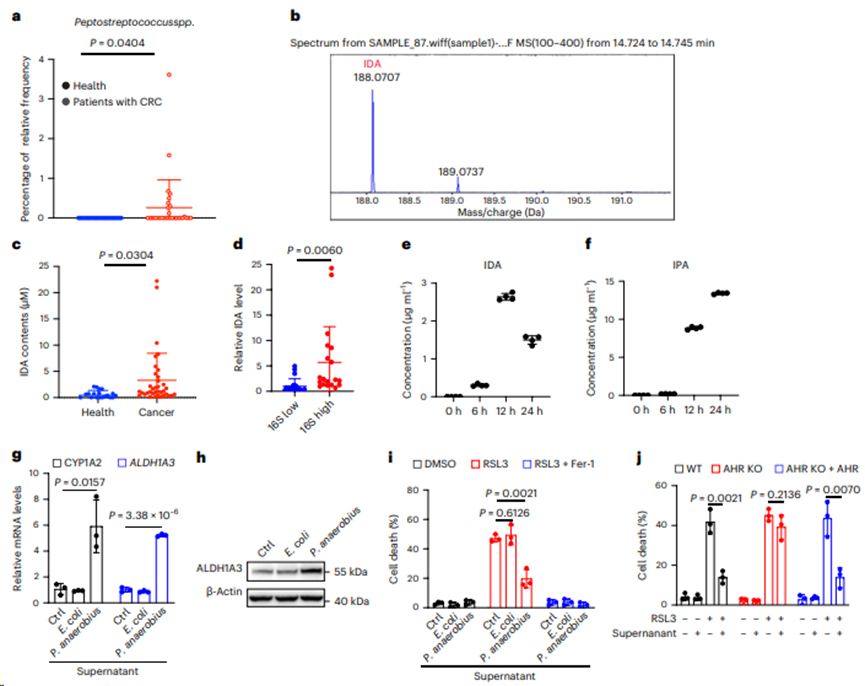
图6. 厌氧菌是IDA生物合成的主要因素
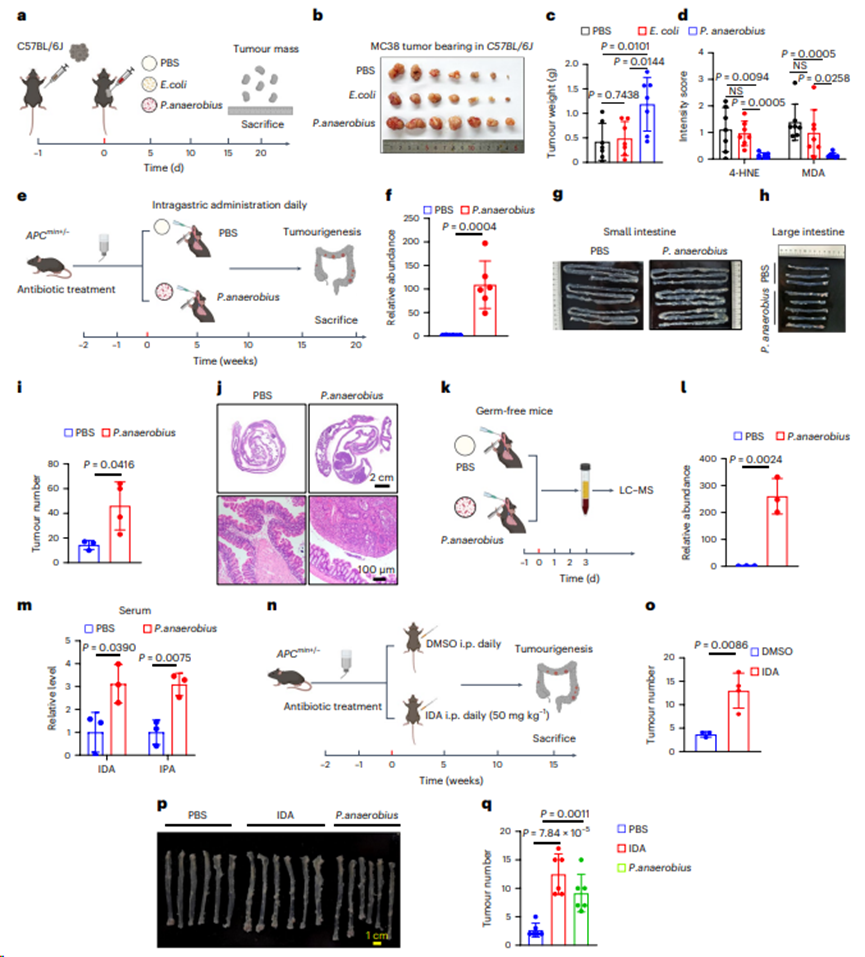
图7. 厌氧菌或IDA促进原位CRC进展
7. 厌氧菌或IDA促进原位CRC进展
采用Apc突变(ApcMin/+)驱动的CRC模型,一种自发性CRC的遗传小鼠模型。如图7e所示,厌氧菌在结肠组织中有效定植(图7f)。此外,P. anaerobius处理的ApcMin/+小鼠产生了更高的肿瘤增殖(图7g-j),表明P. anaerobius加速ApcMin/+小鼠的结直肠发育。无菌小鼠被灌胃厌氧菌,72 h后处死小鼠,检测血清色氨酸代谢物丰度(图7k)。与体外研究结果一致,补充厌氧菌后IDA和IPA显著增加(图7l,m),表明厌氧菌负责体内IDA的生物合成。接下来,评估补充IDA是否驱动ApcMin/+小鼠的结直肠肿瘤发生(图7n)。正如预期的那样,IDA处理的ApcMin/+小鼠显示出显著较高的肿瘤多样性(图7o)。此外,建立结肠炎相关癌症的氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)模型,发现IDA和厌氧菌显著促进了结肠炎诱导的CRC的进展(图7p,q)。
接下来,分析AHR在临床样本中的功能结果,发现AHR和ALDH1A3的表达在结直肠癌中上调(图8a-c)。此外,AHR的高表达与CRC患者的不良临床结局呈正相关(图8d)。免疫组织化学(IHC)和蛋白质印迹分析一致表明,AHR和ALDH1A3在人类CRC样本中表达更高(图8e-h)。此外,用4-羟基-2-壬烯醛(4-HNE)、3,4-亚甲基二氧苯丙胺(MDA)和8-羟基-2 ' -脱氧鸟苷(8-OHDG)进行的IHC染色显示,在结直肠癌中观察到较低的脂质过氧化水平(图8i-k)。总之,研究表明,IDA-AHR-ALDH1A3 - FSP1通路通过抑制铁死亡促进CRC的发展。
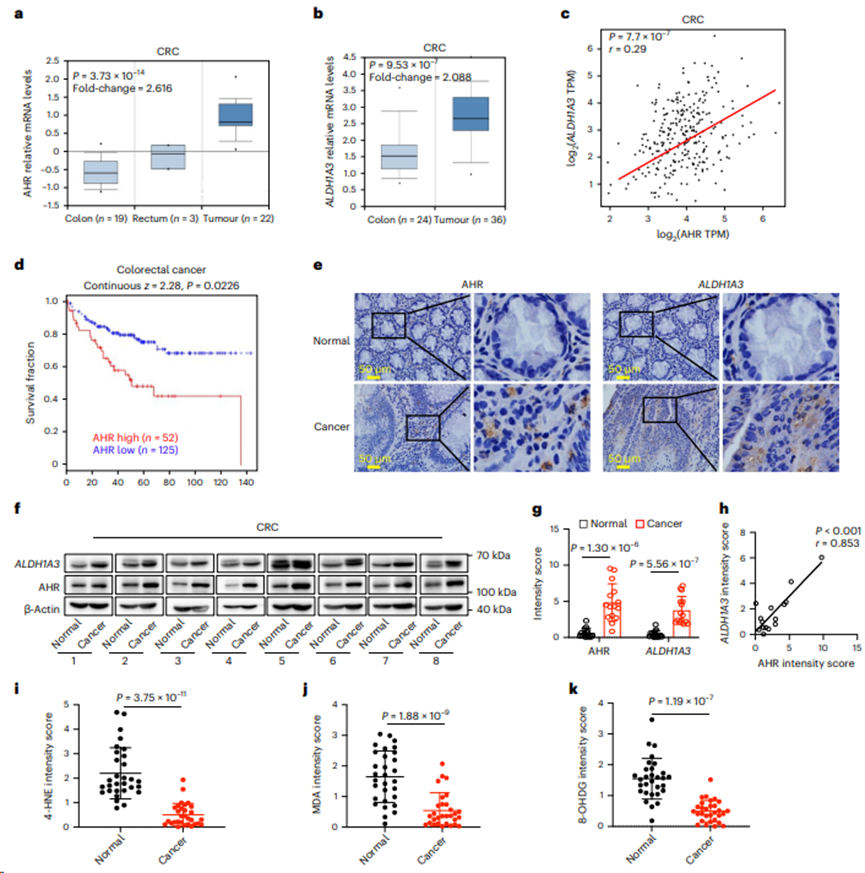
图8. AHR-ALDH1A3通路与结直肠癌患者预后呈负相关
结论
综上所述,本研究发现一种色氨酸衍生物IDA,通过抑制铁死亡在体外和体内促进肿瘤发展。具体而言,IDA介导的癌细胞铁死亡抵抗依赖于AHR-ALDH1A3-FSP1轴。IDA补充或种植厌氧菌促进肿瘤进展,提示IDA–AHR–ALDH1A3–FSP1通路的破坏可能有利于CRC的治疗。
实验方法:
细胞培养,细菌的分离、培养和鉴定,WB,细胞活力、细胞死亡及流式细胞术测定,DPPH实验,FENIX实验,通过离心生成三维球体,根据类器官建立方案生成球体,质粒的构建和转染,RT-PCR,ChIP,细胞质和细胞核分离,NADH水平测定,CoQ和CoQH2分析,粪便微生物群16S rRNA基因测序,体外色氨酸代谢产物的LC-MS代谢组学分析,体内色氨酸代谢物的LC-MS分析,磷脂的LC-MS分析,体内IDA含量的药代动力学,ALDH1A3酶活性测定,基于FlAsH传感器的BRET检测,异种移植实验,ApcMin/+肿瘤模型,结肠炎相关肿瘤的AOM/DSS模型,无菌小鼠厌氧假单胞菌植入及C57BL/6J小鼠瘤内注射,免疫组化
参考文献
Cui W, Guo M, Liu D, Xiao P, Yang C, Huang H, Liang C, Yang Y, Fu X, Zhang Y, Liu J, Shi S, Cong J, Han Z, Xu Y, Du L, Yin C, Zhang Y, Sun J, Gu W, Chai R, Zhu S, Chu B. Gut microbial metabolite facilitates colorectal cancer development via ferroptosis inhibition. Nat Cell Biol. 2024 Jan;26(1):124-137. doi: 10.1038/s41556-023-01314-6. Epub 2024 Jan 2. PMID: 38168770.






