通过体外转录的mRNA挽救p53功能阻碍高级别浆液性卵巢癌的生长
高级别浆液性卵巢癌(HGSOC)是最致命的妇科恶性肿瘤。它与肿瘤间质密切相互作用,生长迅速,广泛转移,并表现出侵袭性的过程。卵巢癌(OC)细胞停留在腹膜腔内,仅播散到间皮衬里表面。目前的标准治疗包括细胞减瘤手术和化疗。然而,大约70%的患者在手术和铂类化疗后3年内复发,并死于疾病进展。
肿瘤蛋白p53(TP53)基因是人类最常发生突变的肿瘤抑制基因,多数通过点突变,即氨基酸替换导致肿瘤蛋白p53与DNA的结合中断。因此,p53通过对抗细胞应激和DNA损伤来保护人类基因组。许多研究表明,肿瘤细胞含有功能失活的p53,其作用机制涉及DNA损伤,从而导致野生型(WT)p53的激活,因此肿瘤细胞对化疗药物具有耐药性。癌症基因组图谱研究网络揭示,高达96%的HGSOC病例具有失活或截短的TP53。此外,TP53突变似乎是肿瘤发生的早期事件,可能在OC的前体病变中,支持TP53突变作为这种恶性肿瘤的驱动因素的重要性。目前已经开发了一些小分子来对抗p53功能的丧失,主要是通过稳定p53的天然构象,如PRIMA-1,它可以重新激活突变的p53,诱导癌细胞凋亡,目前正在临床试验中。然而,不同的研究提供了与用于p53再激活的小分子相关的脱靶效应的证据。因此,是否脱靶活动或p53功能的恢复是治疗反应的起源目前正在研究中。该研究发表在《Cancer Communications》,IF:16.2。
技术路线:

主要研究结果:
1. HGSOC细胞中基于mRNA的p53再激活诱导细胞周期停滞和细胞死亡
作者的目的是通过用p53 mRNA转染HGSOC细胞系和原代细胞来挽救不同临床前模型中p53的功能。在OVCAR-8细胞中,低量的p53-mRNA(10-250 ng)强烈诱导p53蛋白表达(图1A)。与对照组相比,在转染后24小时,在100~500 ng p53 mRNA时,G1期细胞增加(图1B),支持p53活性的再激活。在低剂量的p53 mRNA(≥0.1μg)下,细胞周期抑制因子p21,p16和p27的强烈诱导与关键调节因子(如PLK1,Aurora A,CDK1和Cyclin A/B)的下调相平行,使用基于载体的p53重表达证实了作者的结果(图1C)。这些观察结果与0.5μg剂量的细胞活力在48小时后显著下降约2倍相关(图1D),与未处理对照相比,伴随着不同细胞死亡指标的上升,如Puma,Noxa和Fas,裂解的PARP,裂解的Caspase-3(图1C),以及Caspase 3/7活性的增加(图1E)和膜联蛋白染色(图1F)。克隆形成能力的丧失是通过增加p53-mRNA的浓度来诱导的(图1G)。作者还进行了细胞毒性试验,该试验证实了之前通过凋亡和集落形成试验观察到的IVT P53 mRNA对卵巢癌细胞的影响(图1H)。总之,作者的观察表明,在不同的HGSOC细胞系中,通过转染野生型p53 mRNA来挽救p53功能会诱导细胞死亡。
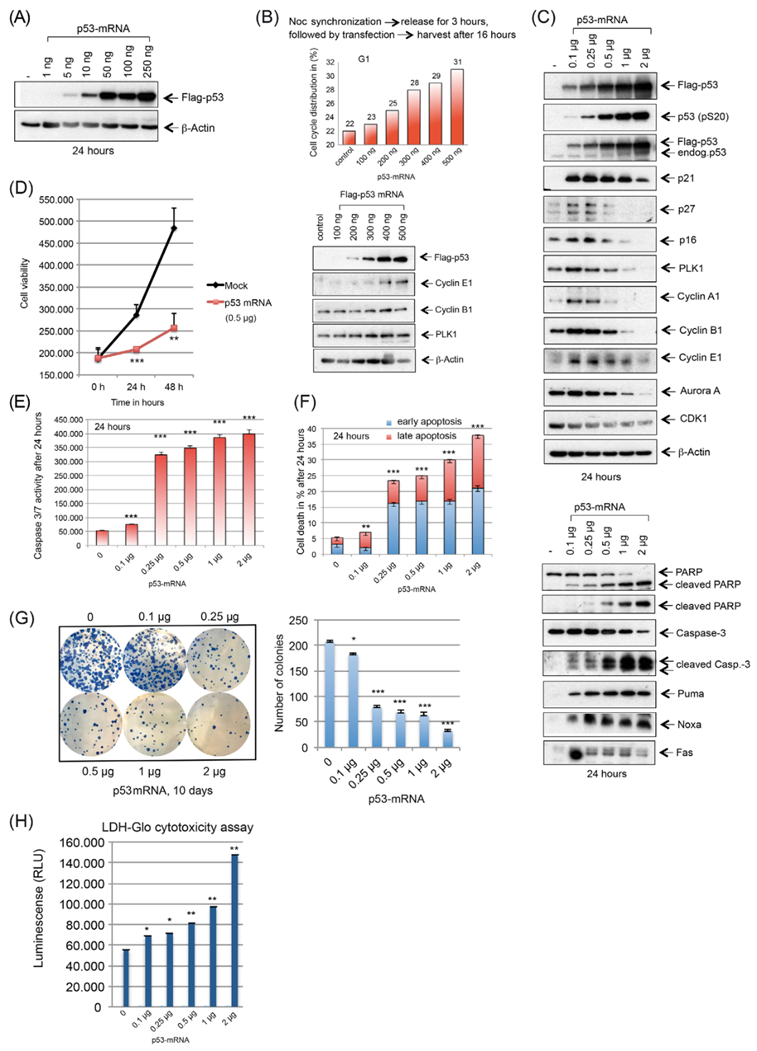
图1 脂质体转染体外转录的WT p53 mRNA在HGSOC细胞系OVCAR-8中诱导细胞周期阻滞和凋亡
2. 在HGSOC细胞系OVCAR-8中,恢复p53可降低染色体不稳定性
染色体不稳定性是OC的基本特征,并且大多数人OC细胞表现出非整倍体。OVCAR-8细胞系是一种超二倍体细胞系,具有高度的数值复杂性和介于50-59的染色体模态数。因此,作者的目的是确定恢复野生型p53的功能是否可以将细胞中的染色体数量减少到接近二倍体的状态。因此,每隔两天用低剂量的p53-mRNA处理细胞,持续28天,并在孵育期结束时评估染色体的分布(图2A-B)。当野生型p53恢复后,平均染色体数目从53减少到47(图2C-D)。
HGSOC亚型的特征是由多种因素导致的复制应激增加,包括TP53的频繁缺失。TP53功能的丧失通过损害DNA损伤反应机制来促进复制应激,这可能部分解释了在OVCAR-8细胞中观察到的遗传不稳定性增加。为了量化p53功能恢复前后OVCAR-8细胞中复制应激的程度,作者评估了Ser139-磷酸化H2AX焦点(γ-H2AX)作为复制应激的可靠标记,以及在7和14天后DNA双链断裂的存在。作者发现,在OVCAR-8和p53 mRNA处理的OVCAR-8细胞中,γ-H2AX焦点的基线水平在处理14天后从平均8个焦点显著下降到3个焦点(图2E)。这一结果进一步证明了p53在维持HGSOC细胞基因组完整性中发挥的关键作用,最有可能是通过对抗复制应激。
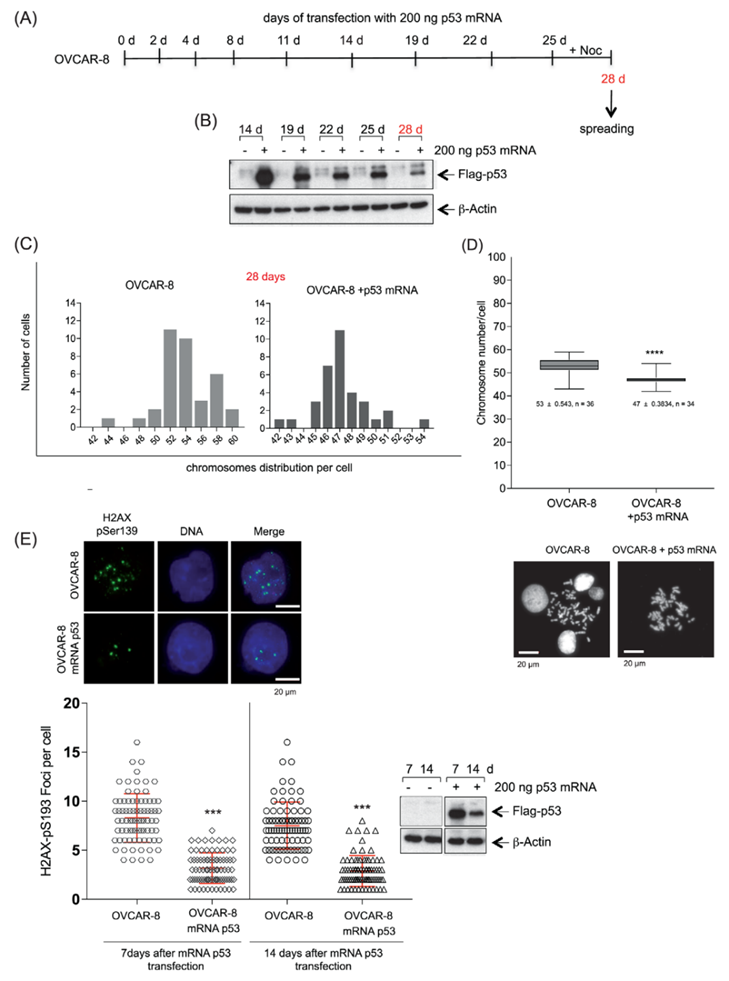
图2 恢复p53功能可降低OVCAR-8细胞的染色体不稳定性
3. 在原代HGSOC细胞中,基于mRNA的p53功能挽救诱导细胞周期停滞和细胞死亡
为了进一步验证p53表达在临床前的挽救作用,作者比较了p53 mRNA转染在正常卵巢和HGSOC细胞中的作用。除角质形成细胞外,所有原始样本均检测到p53的表达(图3A)。对同一患者的HGSOC和相应的正常卵巢组织进行的第一次比较显示,肿瘤细胞中p53的表达较高,尽管转染的p53 mRNA的量相同(图3A)。对其他患者来源组织的分析证实,所有肿瘤样本中的p53表达和caspase 3/7活性(图3B)均显著高于正常卵巢细胞中的相应水平。
WB检测揭示了抑制剂,p21,p16和p27的上调(图3C)和凋亡(图3D),在p53-mRNA-转染的原代HGSOC细胞中,与它们的正常对应细胞相比,凋亡更强,与HGSOC克隆数量的更明显减少相关(图3E),这被LDH-Glo细胞毒性实验证实(图3F)。对不同HGSOC患者来源的类器官的分析也表明,在3D细胞培养条件下,p53 mRNA处理后,体积显著减小,caspase 3/7活性增加(图3G)。综上所述,虽然p53的表达降低了两种原代细胞的活(正常细胞vs. HGSOC),但与正常细胞相比,在原代HGSOC细胞中的作用显著更强,这可能是由于p53在肿瘤细胞中的水平升高。
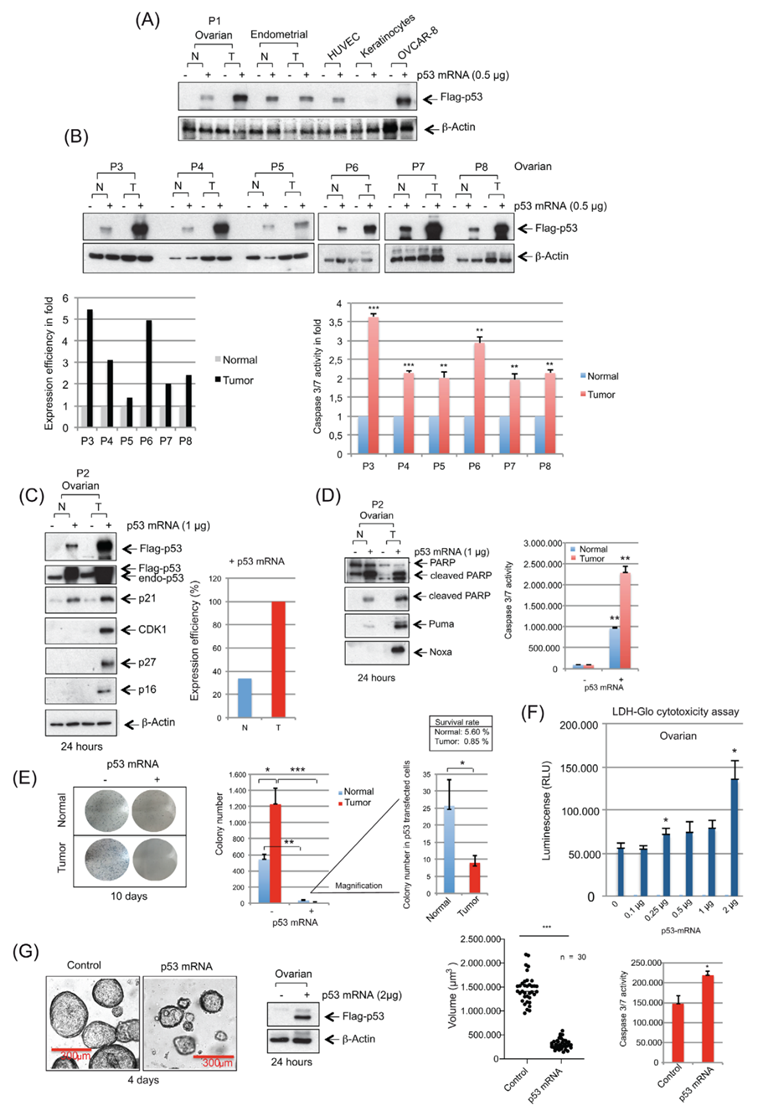
图3 脂质体转染p53-mRNA导致p53在原代HGSOC细胞中的表达高于其正常对照。
4. 拯救野生型p53功能后OVCAR-8细胞的转录组改变
在HGSOC来源的细胞系和原代细胞中,作者观察到细胞增殖活性降低,细胞死亡增加,这支持了mRNA转染后p53重新表达后恢复p53功能的模型。为了加深作者对潜在生物学过程的理解,并以相对无偏倚的方式解决这方面的问题,作者在三个独立的实验中转染1μg p53 mRNA或模拟对照(EGFP mRNA)。总共有25540个人类基因在转染后24小时被RNA测序分析。考虑到组间差异,两组均使用非配对T检验进行比较。转录组分析显示,3061个转录本被上调,1662个被下调(图4A-B)。使用IPA软件对这些重要基因进行进一步分析,以确定与p53 mRNA转染相关的过度表达的经典通路(图4C)。
与p53作为肿瘤抑制因子参与诱导细胞周期停滞和凋亡的促凋亡功能相一致,作者的IPA揭示了p53 mRNA转染后的几个相关通路的过度表达,如“p53信号”、“凋亡信号”和几个“细胞周期”通路(图4C)。为了证实这些发现,作者研究了参与IPA“p53信号”通路的所有基因,作者意识到其中大多数(51/81,63%)在FDR q<0.05和绝对FC>1.5时存在差异表达(图4D)。值得注意的是,p53信号通路的大多数已知下游靶点通过p53 mRNA转染协同上调(图4D)。作者对p53信号通路中选择的蛋白(包括p21(CDKN1A)、MDM2、Puma(BBC3)、p73、FAS(CD95)和CDK1)进行WB,进一步验证了这些结果(图4E)。它们在OVCAR-8细胞中的表达被p53-mRNA显著上调或下调,这与转录组学分析一致。
一些“细胞周期”途径,包括“染色体复制的细胞周期控制”,“细胞周期:G2/M DNA损伤检查点调节”,和“细胞周期蛋白和细胞周期调节”,以及“Polo样激酶的有丝分裂作用”,它们显示了整体下调(负z值)(图4C)。值得注意的是,细胞衰老途径也被上调,并可能在诱导凋亡的同时促进细胞死亡(图4C)。
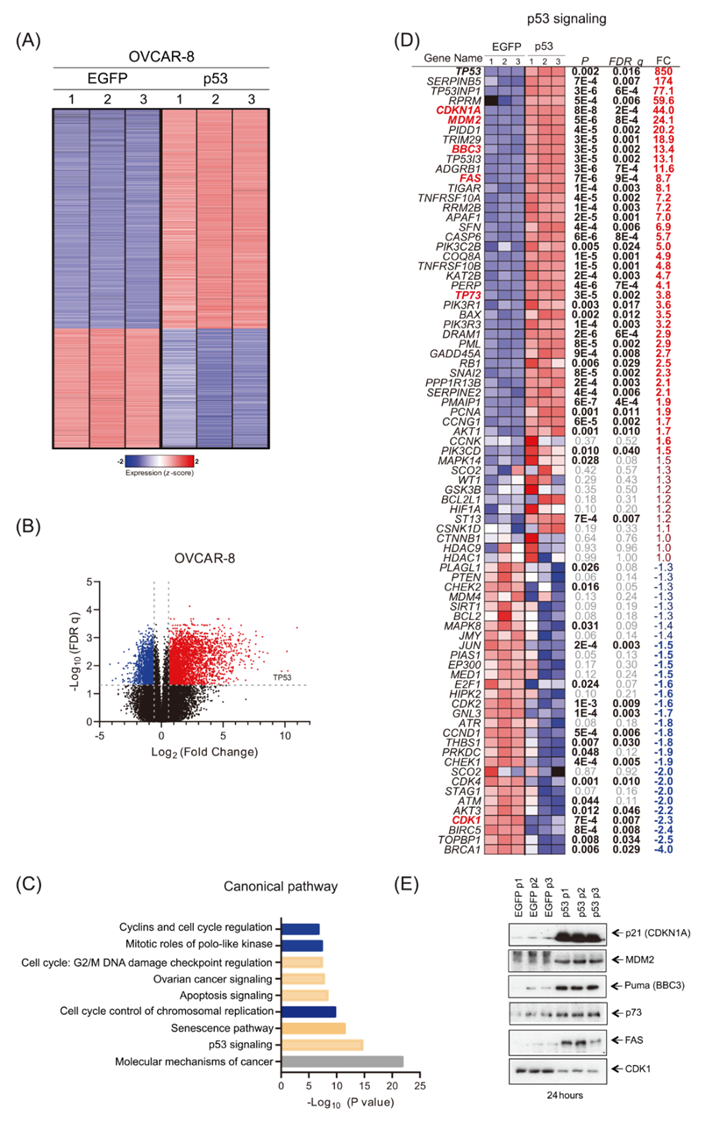
图4 p53 mRNA转染的OVCAR-8细胞与模拟转染的OVCAR-8细胞相比,差异表达基因的鉴定
接下来,作者对来自患者1的原代HGSOC细胞和OVCAR-8细胞进行了转录组比较,OVCAR-8细胞和患者1的原代HGSOC细胞均转染了p53-mRNA(图5A)。主要样本之间的高变异性导致多重检验FDR校正后的低显著性。因此,作者认为原代HGSOC细胞的转录显著性P<0.01和FC>1.5。共有156个转录本被上调,115个被下调(图5B-C)。来自原代HGSOC细胞的几个基因是显著的,并且与在OVCAR-8细胞中发现的通路相似(图5D),支持两个数据集的相关性。
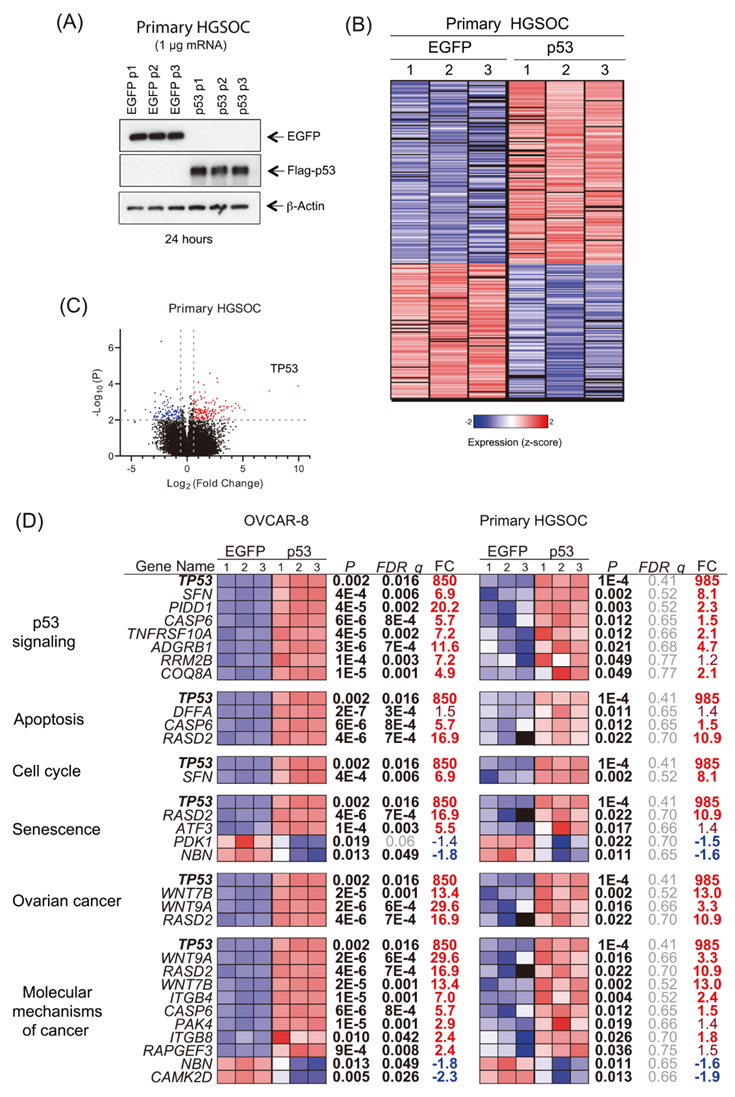
图5 原代HGSOC细胞差异表达基因分析。
与p53在OC发育中的重要功能一致,作者的IPA显示了“卵巢癌信号”通路中的多个转录改变。该通路中的许多基因(55/76,72%),包括Wnt/β-catenin信号通路,被显著地解除调控(图6A-B)。Wnt/β-catenin通路通过异常激活Wnt/β-catenin信号通路,导致catenin过度激活,从而促进卵巢癌的化疗耐药、转移和肿瘤干细胞的自我更新。p53 mRNA的处理导致AXIN1的表达上调,AXIN1是β-catenin破坏复合物成分的脚手架蛋白,包括APC, CK1PP2A和GSK3β。此外,在frizzled受体、Wnt和TCF/LEF家族成员中观察到异常(图6A-B)。总之,在p53-mRNA处理的细胞中,这些转录改变导致β-catenin的适度减少(图6B),并通过TCF/LEF报告基因实验降低Wnt信号的活性(图6C)。
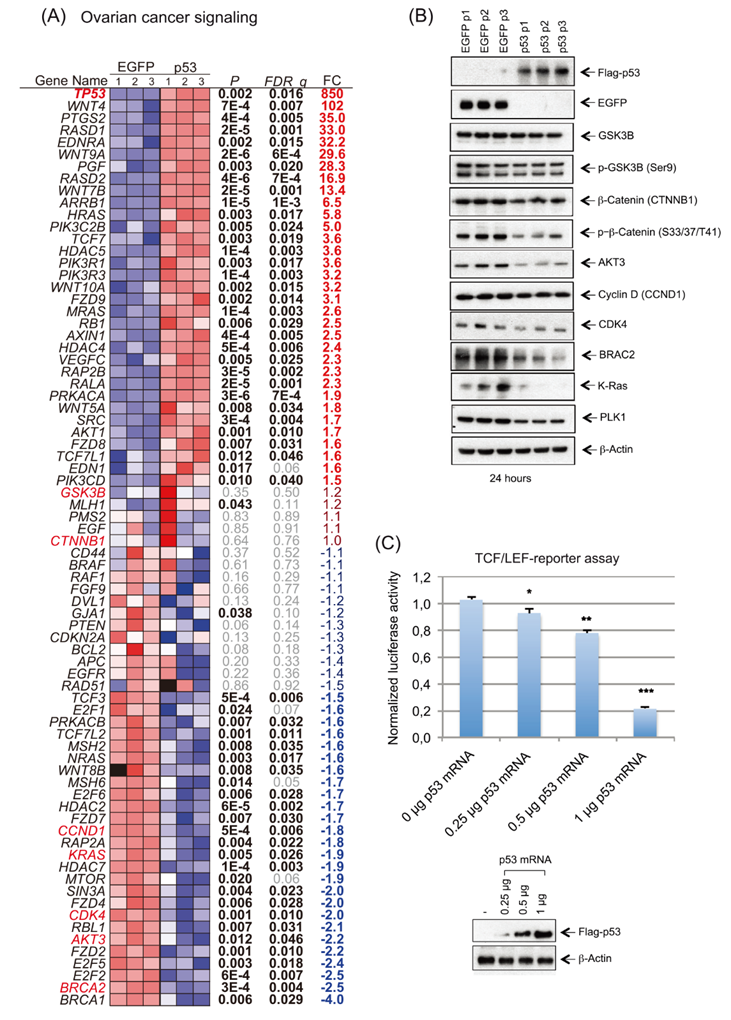
图6 IVT p53 mRNA处理OVCAR-8细胞后,OC信号通路上调。
5. 在HGSOC异种移植模型中,p53 mRNA处理的OVCAR-8细胞的原位应用导致了剂量依赖性的肿瘤生长减少
在异种移植实验的前一天,OVCAR-8/Luc细胞被转染mock-mRNA或p53-mRNA(100 ng或500 ng)(图7A)。为了建立原位模型,将Matrigel/OVCAR-8/Luc细胞悬液注射到每只小鼠的右侧卵巢。在为期10周的观察期间,BLI以每周1倍的速度测定肿瘤体积,结果表明,100ng p53-mRNA处理的细胞产生的肿瘤生长迟缓,以及500ng p53-mRNA处理的细胞增殖完全受阻(图7B)。为验证荧光素酶在体内的活性,研究结束后处死小鼠,由两名独立的兽医组织学学家对所有器官进行解剖/组织学检查。基于体积测定(图7C)和BLI测量(图7D)对切除的卵巢的检查证实了通过支持In vivo BLI测量的p53 mRNA治疗对卵巢肿瘤的剂量依赖性大小减少(图7B)。组织学检查显示巨大的肿瘤肿块和深刻的形态学改变,这是由于在注射了模拟处理的OVCAR-8/Luc细胞的右侧卵巢中巨大的癌组织。在100ng p53-mRNA处理组中,右侧卵巢显示出低到中等数量的肿瘤(图7E,d-e)或正常组织学。500ng p53-mRNA处理组的右侧卵巢和所有其他器官显示正常组织学(图7E,g-h)。在所有处理组(mock,100ng和500ng p53-mRNA)中,未接受OVCAR-8/Luc细胞的左侧卵巢显示出正常的组织学,具有卵泡和黄体结构,以及基质组织(图7E,c-f-i)。在注射了mock-treated细胞的小鼠中,在肠道中检测到转移;100-ng组的转移活性较低,在500-ng组中没有转移活性(图7D-F)。总之,这些动物数据揭示了在原位条件下,p53 mRNA处理的OVCAR-8/Luc细胞的剂量依赖性生长迟缓和播散受阻。
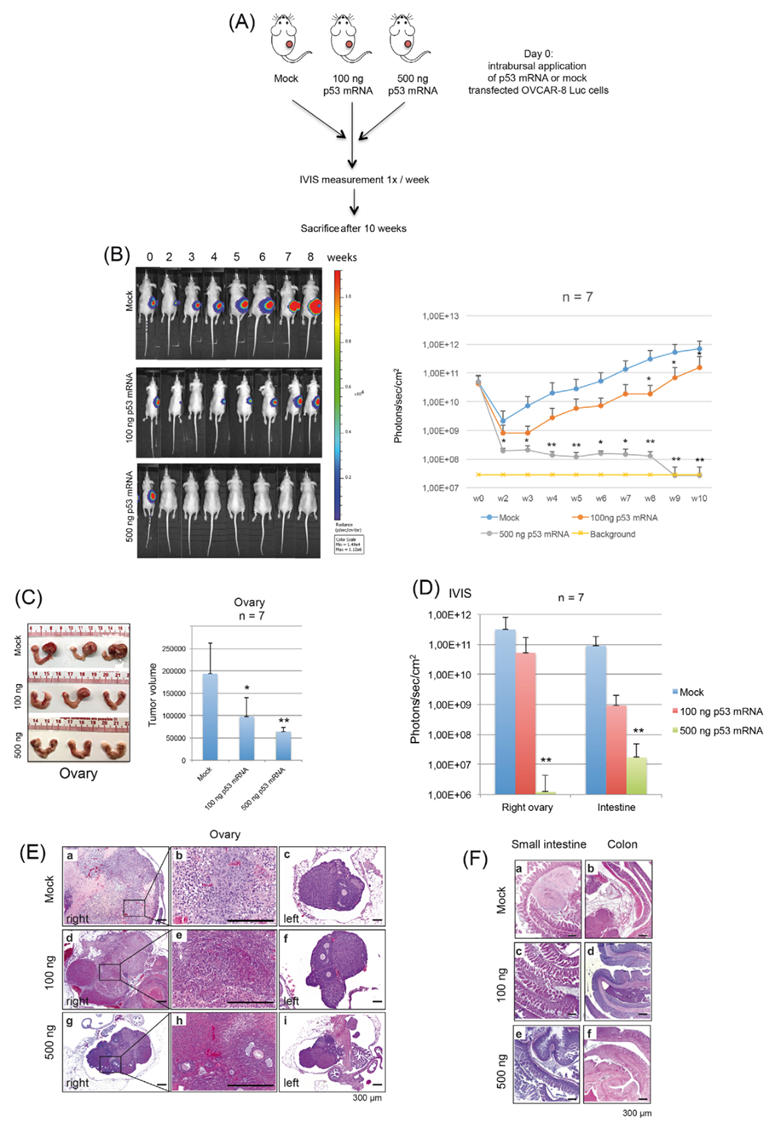
图7 在原位小鼠模型中,应用脂质体p53-mRNA到OVCAR-8细胞可防止鞘内生长和播散。
6. 腹腔内应用OVCAR-8细胞,随后腹腔内治疗p53-mRNA抑制肿瘤细胞的播散
为了进一步验证p53-mRNA在转移性HGSOC中的临床相关性,作者测试了腹膜内散在的肿瘤细胞是否可以被脂质体p53-mRNA所接近。治疗OC的药物腹腔给药被证明比全身给药更有效,美国国立癌症研究所推荐腹腔给药。沿着这些路线,作者腹腔注射2×106 OVCAR-8/Luc细胞,并在4-6小时后通过腹腔途径给予p53-mRNA。小鼠每周2次腹腔注射p53-mRNA(0.16mg/kg)或对照组,共治疗3周。尽管对照组的OVCAR-8/Luc细胞呈指数增长,但脂质体p53-mRNA腹腔内处理完全阻断了肿瘤细胞的生长(图8A)。在整个观察期间,两组小鼠体重发育正常(图8B)。
在接受腹腔OVCAR-8/Luc细胞和腹腔模拟治疗的对照小鼠中,大体解剖分析显示腹膜表面有肿瘤块(图8C-D)。大多数转移灶与脏器附着较弱。在大网膜、卵巢脂肪垫和肠系膜等脂肪组织中也检测到大肿瘤(图8C-D)。特别是,附着在小肠和大肠的较大肿瘤块会导致肠道结构之间的粘连,这意味着肠道狭窄。大网膜和肠道的IVIS测量显示了最显著的信号,与组织学结果相关(图8D-E)。在p53-mRNA处理的小鼠中,大体解剖和组织学分析没有发现腹腔内的肿瘤团块,所有的器官在肉眼检查中显示正常。IVIS测量和组织学检查没有提供肿瘤细胞播散的证据(图8D-E)。
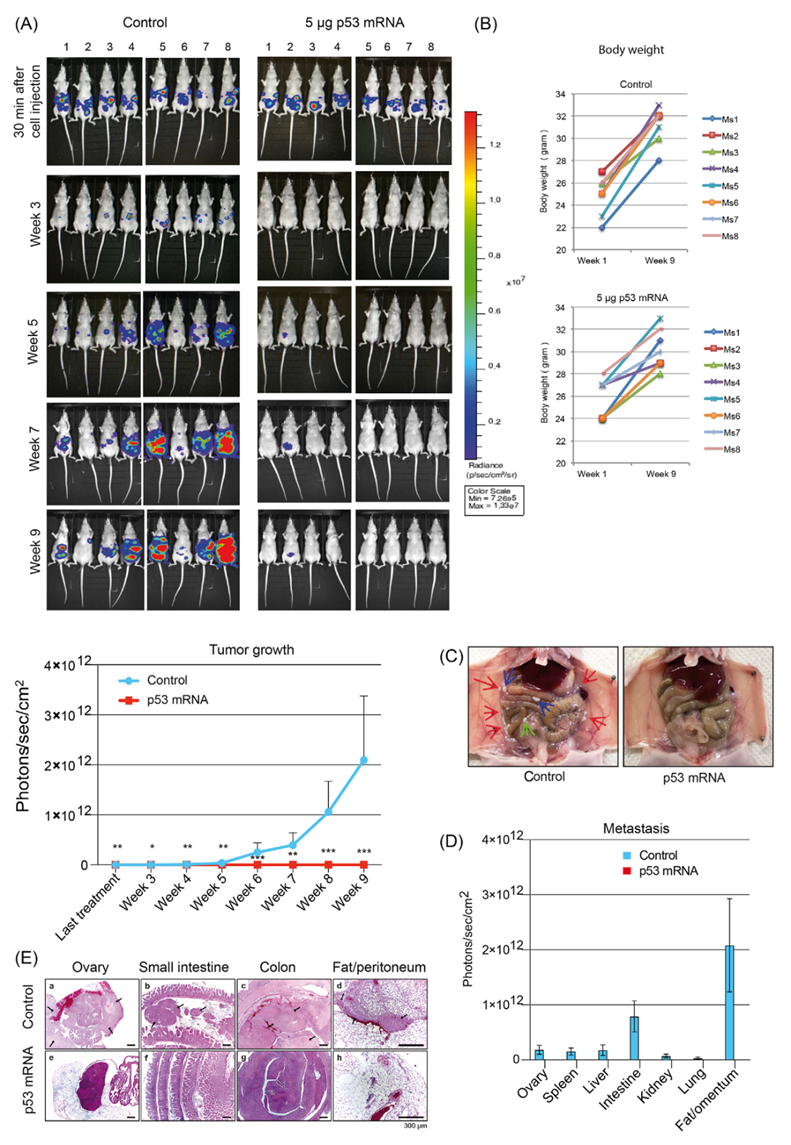
图8 腹腔内注射OVCAR-8细胞后腹腔内治疗小鼠脂质体p53-mRNA防止肿瘤形成和异种移植小鼠模型的器官播散。
结论:
该研究证明了IVT mRNA激活HGSOC中TP53肿瘤抑制基因的有效性。脂质体IVT mRNA可有效、持续地表达WT p53,并精确挽救p53功能;从而抑制HGSOC细胞增殖,降低染色体不稳定性,触发细胞死亡。在不同的小鼠模型中,p53-mRNA治疗导致了剂量依赖性的肿瘤生长和腹膜腔内播散的减少。这些发现表明,基于IVT-mRNA的方法有希望在癌细胞中重新激活p53,并可能为HGSOC提供一个有价值的治疗选择。
实验结果:
细胞培养和转染,集落形成试验,类器官,免疫印迹,细胞周期、细胞活力和增殖分析,荧光素酶检测,乳酸脱氢酶细胞毒性测定,RNA测序,TCF/LEF报告基因检测,小鼠实验,活体成像系统,组织学检查
参考文献:
Raab M, Kostova I, Peña-Llopis S, Fietz D, Kressin M, Aberoumandi SM, et al. Rescue of p53 functions by in vitro-transcribed mRNA impedes the growth of high-grade serous ovarian cancer. Cancer Commun (Lond). 2024 Jan;44(1):101-126. doi: 10.1002/cac2.12511.






