CircPCNXL2-肝内胆管癌治疗的靶点
据报道,circRNAs在许多癌症的进展中发挥重要作用。然而,circRNA在肝内胆管癌(ICC)中的功能尚不清楚。circPCNXL2在ICC组织和细胞系中表达上调,促进ICC体外和体内的增殖和转移。从机制上看,circPCNXL2可以直接结合到STRAP上,诱导STRAP与MEK1/2相互作用,通过激活ERK/MAPK通路,促进ICC的肿瘤发展。此外,circPCNXL2可以通过海绵化miR-766-3p调控SRSF1的表达,从而促进ICC的生长。最后,circPCNXL2在体内可以部分抑制曲美替尼的抗肿瘤活性。总之,circPCNXL2通过与STRAP相互作用激活ERK信号通路,以及调节miR-766-3p/SRSF1轴,在ICC的进展中发挥了至关重要的作用。这些发现表明circPCNXL2可能是一种有希望的ICC生物标志物和治疗靶点。本文于2024年2月发表于“Molecular Cancer”(IF=37.3)上。
技术路线

结果:
1)circPCNXL2在ICC中上调
为了评估circRNAs在ICC中的作用,我们分析了来自7个ICC及其邻近组织的RNA-seq数据。我们发现ICC中89个circRNA表达上调,67个circRNA表达下调。has_circ_0016956 (circPCNXL2)是上调最多的circRNA之一,通过qRT-PCR在我们的76对ICC组织中证实了其过表达(图1a-c)。高circPCNXL2组的患者表现出较差的总生存期(OS)(图1d)。circPCNXL2在4种ICC细胞系中的表达也较高,我们选择了HuCCT1和RBE细胞进行后续研究(图1e)。为了确认circPCNXL2的环状结构,我们对qRT-PCR产物进行Sanger测序,确认其首尾反向剪接(图1f)。我们只发现circPCNXL2通过发散引物从cDNA中扩增出来(图1g)。经RNase R和放线菌素D处理后,我们观察到circPCNXL2比线性PCNXL2表现出更大的稳定性(图1h-i)。这些结果证明了circPCNXL2的环状特性。通过荧光原位杂交(FISH)和细胞质及细胞核RNA纯化分析,circPCNXL2转录物主要存在于HuCCT1和RBE的细胞质中(图1j-l)。上述发现提示circPCNXL2在ICC组织中过表达,且主要位于ICC细胞的细胞质中。
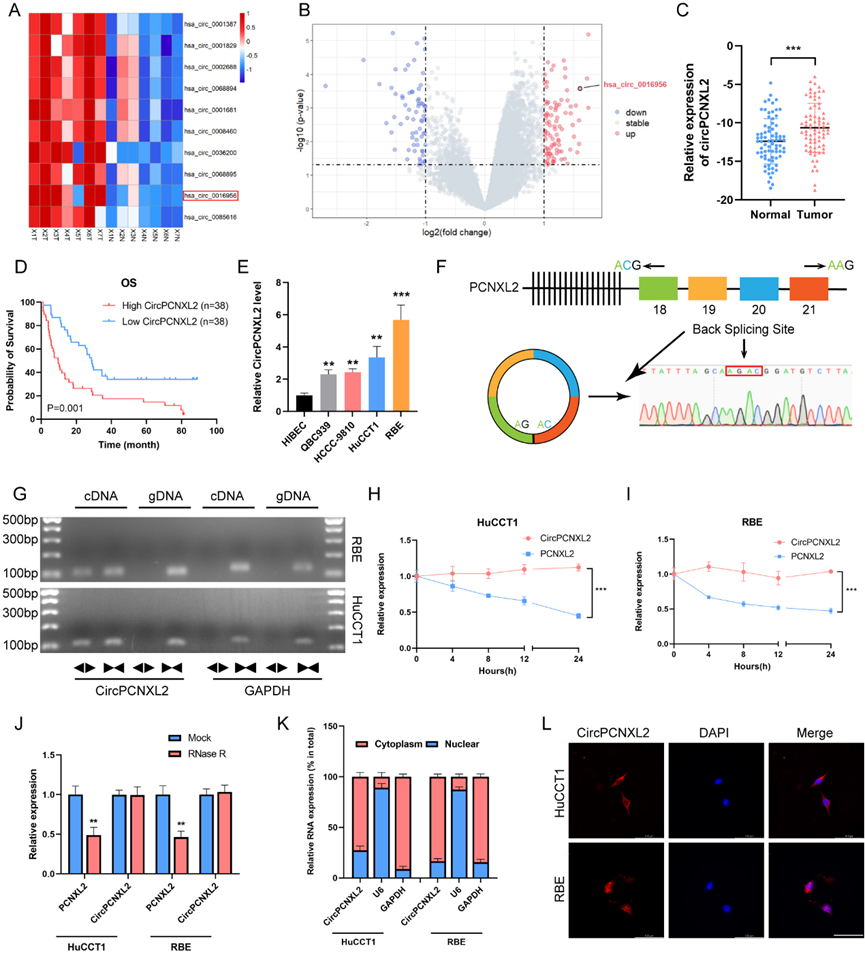
2)CircPCNXL2在体外促进ICC的增殖和迁移
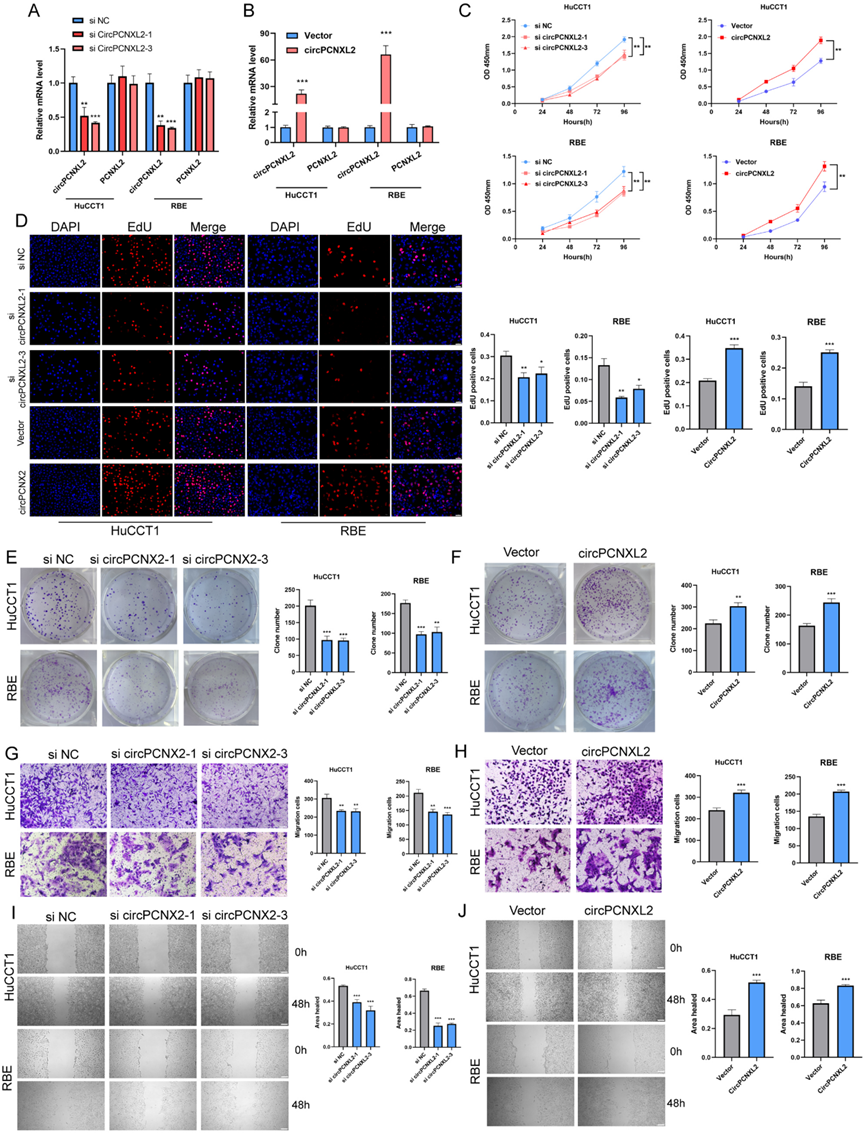
为了阐明circPCNXL2在ICC中的生物学功能,我们利用靶向剪接连接的siRNA敲低circPCNXL2的表达,并合成circPCNXL2质粒过表达circPCXNL2。通过qRT-PCR验证siRNA和质粒的效率(图2a-b)。首先,通过CCK-8、EdU和克隆形成实验检测circPCNXL2对细胞增殖的影响。结果表明,敲低circPCNXL2抑制了HuCCT1和RBE细胞的增殖。相反,在circPCNXL2过表达组中发现了相反的效果(图2c-f)。与此一致的是,通过transwell实验和伤口愈合实验,circPCNXL2敲低会阻碍迁移能力,而过表达circPCNXL2则会促进迁移能力(图2g-j)。这些发现表明circPCNXL2在ICC细胞中的致癌作用。
3)CircPCNXL2在体内促进ICC的肿瘤生长和转移
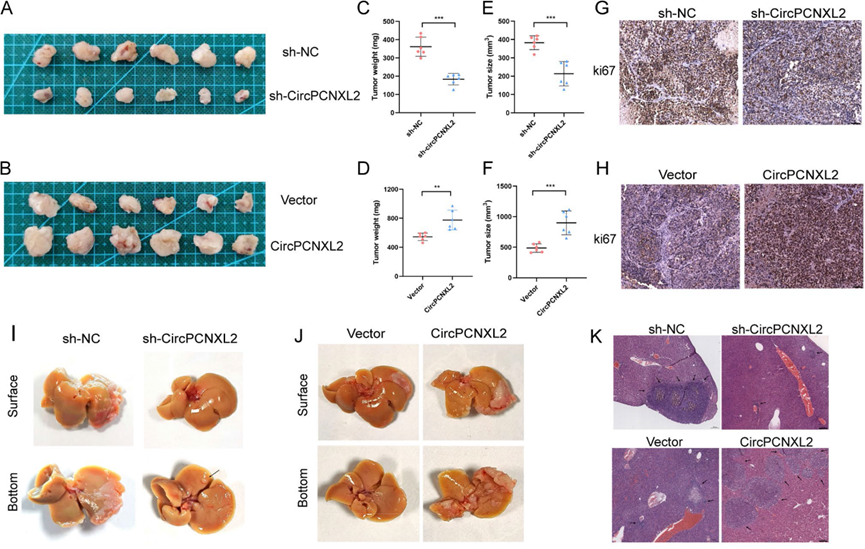
为了阐明circPCNXL2对体内ICC的影响,我们构建异种移植瘤模型。circPCNXL2敲低的肿瘤体积较小,而circPCNXL2过表达的RBE细胞的肿瘤生长速度比对照组快(图3a-f)。免疫组化染色观察到circPCNXL2敲低组的Ki-67水平较弱。相反,circPCNXL2过表达导致Ki-67染色更强,提示Ki-67与circPCNXL2表达水平之间存在相关性(图3g-h)。然后,我们构建肝转移模型,研究circPCNXL2在ICC体内的转移特征。结果表明,注射敲低circPCNXL2的HuCCT1细胞后,小鼠肝脏转移结节的数量显著减少。并且,circPCNXL2过表达增强了肝脏播散能力(图3i-k)。这些发现表明circPCNXL2促进了体内ICC细胞的转移。
4)CircPCNXL2调节ICC中ERK/MAPK信号通路的激活
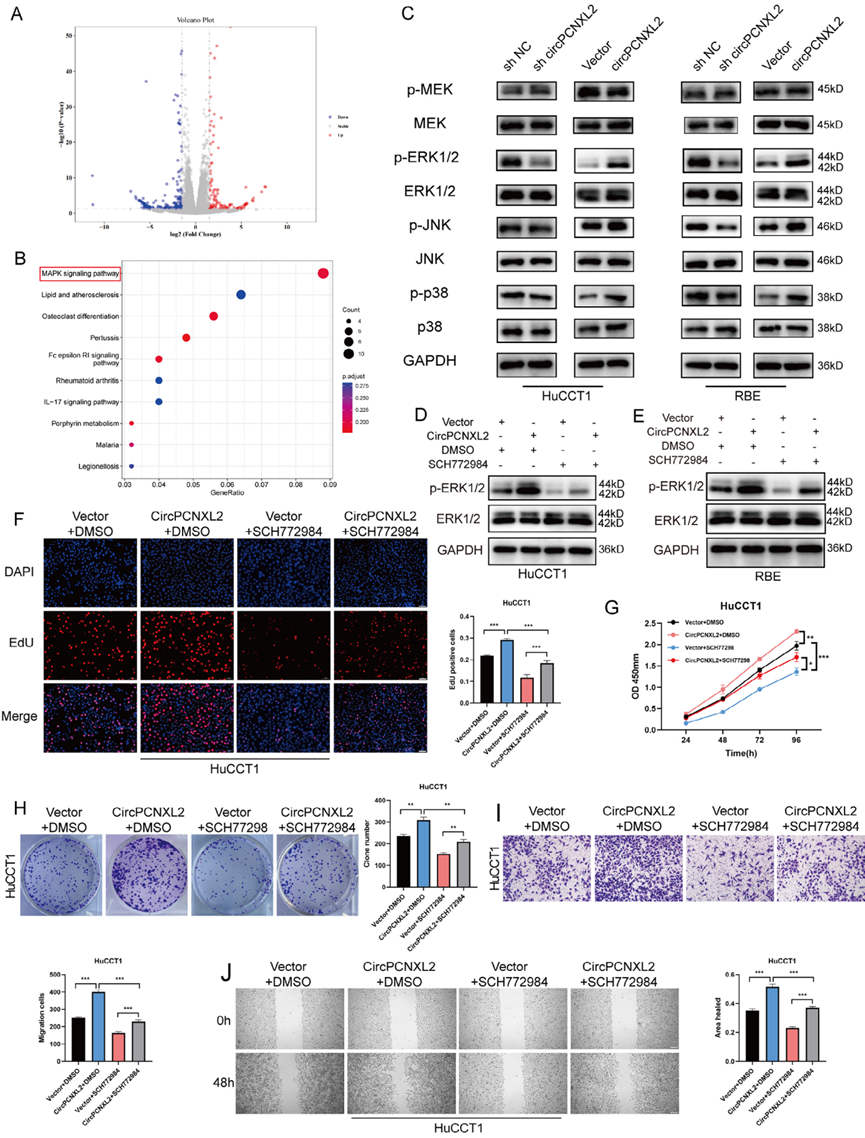
为了剖析circPCNXL2促进ICC细胞增殖和转移的潜在机制,我们通过RNA-seq在过表达circPCNXL2的RBE细胞中鉴定了278个差异表达基因(DEGs) (图4a)。KEGG通路分析显示,MAPK信号通路是最富集的通路(图4b)。据报道,MAPK信号通路调节细胞增殖和迁移等关键细胞功能。基于此,我们假设circPCNXL2可能通过MAPK途径促进ICC的生长和转移。免疫印迹结果显示,在HuCCT1和RBE细胞中,circPCNXL2过表达时,MAPK通路中三个亚组的磷酸化水平均增强,而在circPCNXL2敲低组中,磷酸化水平均降低(图4c)。ERK磷酸化的变化在三个亚组中最为显著。因此,我们假设circPCNXL2主要通过ERK/MAPK信号通路促进ICC的肿瘤发生。
为了了解ERK/MAPK通路在circPCNXL2介导的ICC进展中的意义,我们在体外添加了一种高选择性ERK抑制剂SCH772984来阻断ERK的磷酸化。我们通过Western Blot验证了SCH772984能够有效抑制ERK通路的活性(图4d-e)。功能上,EdU实验、CCK8实验、克隆形成实验、transwell实验和伤口愈合实验表明,circPCNXL2过表达促进了增殖和迁移,而SCH772984可以消除这一作用(图4f-j)。这些结果共同表明circPCNXL2通过激活ERK/MAPK信号通路促进ICC的生长和迁移。
5)CircPCNXL2与STRAP相互作用介导ERK/MAPK信号通路激活
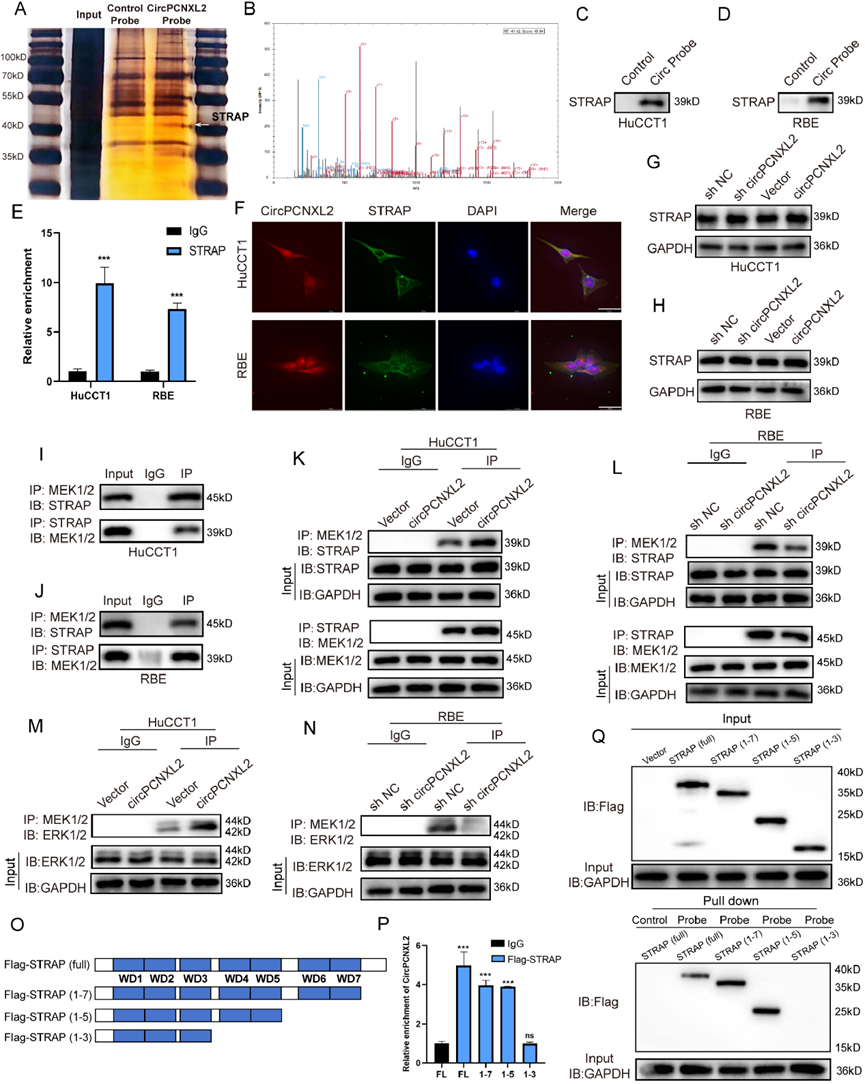
为了研究circPCNXL2如何调节ICC中ERK的磷酸化,使用circPCNXL2的生物素化探针在RBE裂解物中进行RNA下拉,然后进行银染色和质谱分析。然后,我们在大约40 KD处观察到一个特定的条带,质谱结果表明STRAP可能能够与circPCNXL2结合(图5a-b)。接下来,我们通过RNA下拉和RIP实验证实了HuCCT1和RBE细胞中circPCNXL2和STRAP之间的相互作用(图5c-e)。我们通过FISH检测和免疫荧光证实了circPCNXL2和STRAP的共定位(图5f)。有趣的是,circPCNXL2敲低或过表达对STRAP的表达没有影响(图5g-h)。我们推测circPCNXL2可能在促进ERK激活中起支架作用。据报道,STRAP可以与MEK1/2相互作用,并参与MEK1/2与ERK1/2的相互作用。为了测试在ICC中STRAP是否与MEK1/2相互作用,我们对HuCCT1和RBE进行免疫沉淀和Western Blot检测。结果表明,MEK1/2被抗STRAP抗体共免疫沉淀,而STRAP也被抗MEK1/2抗体共免疫沉淀。结果表明,在ICC细胞中,STRAP可以与MEK1/2结合(图5i-j)。然后,为了研究circPCNXL2是否对ICC中STRAP和MEK1/2之间的相互作用有任何影响,我们进行了免疫沉淀实验。我们观察到,circPCNXL2过表达可以促进STRAP和MEK1/2之间的关联,而两者的蛋白水平没有变化,相反,circPCNXL2敲低会减弱ICC细胞中STRAP-MEK1/2的相互作用(图5k-l)。此外,MEK1/2抗体免疫沉淀实验的进一步结果证实,circPCNXL2也参与ERK1/2-MEK1/2相互作用,并在HuCCT1和RBE细胞中促进ERK1/2的磷酸化(图5m-n)。此外,为了解剖circPCNXL2和STRAP之间相互作用的精确结合域,设计了一系列flag标记的STRAP缺失突变体,用于RIP和RNA下拉实验。结果显示,第4和第5个WD-40结构域负责STRAP与circPCNXL2的结合(图50-q)。
6)CircPCNXL2通过海绵miR-766-3p上调SRSF1的表达
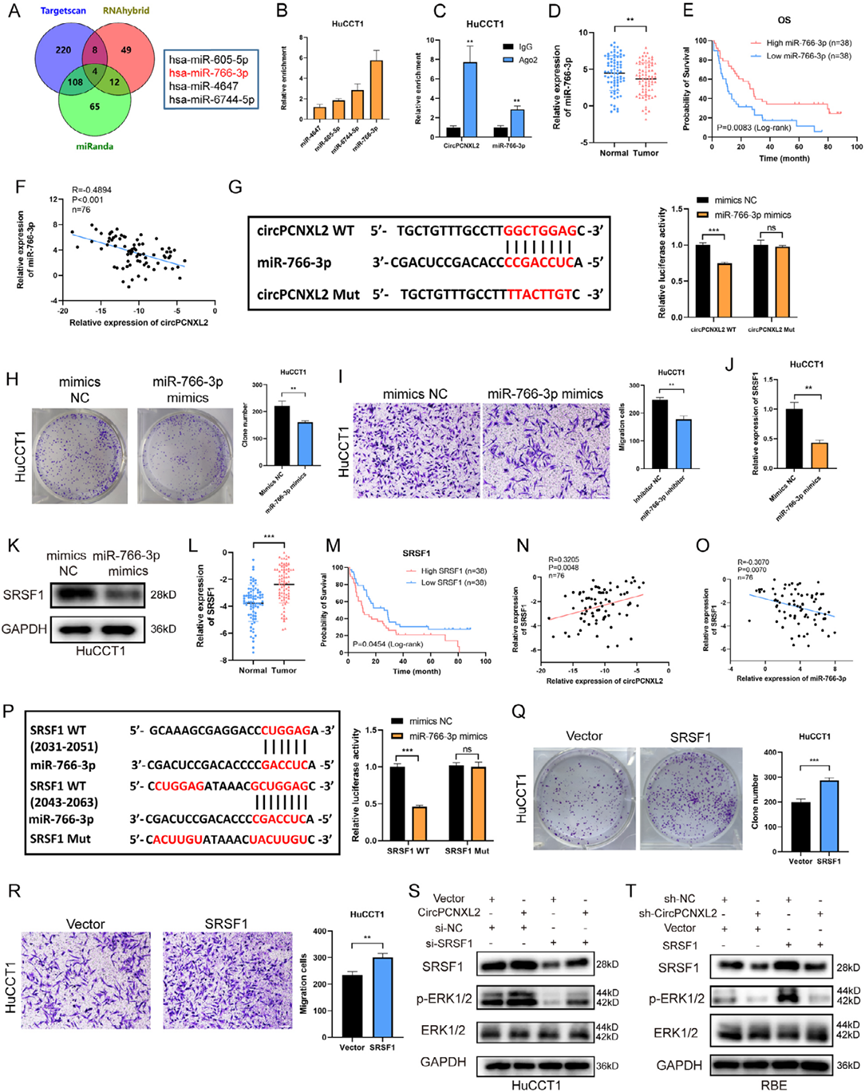
据报道,CircRNAs可能以许多其他方式发挥功能,例如编码功能肽和充当miRNA海绵。然而,在circRNADb中没有任何假定的开放阅读框被注释,这表明circPCNXL2可能无法编码蛋白质。RIP显示,在HuCCT1和RBE细胞中, AGO2抗体显著富集circPCNXL2,这表明circPCNXL2可能在ICC中起miRNA抑制剂的作用。然后,我们通过重叠Targetscan、miRanda和RNAhybrid的miRNA靶标预测,鉴定了4个候选miRNA (miR605-5p、miR-766-3p、miR-4647和miR-6744-5p)(图6a)。接下来,使用生物素标记的circPCNXL2探针进行RNA下拉实验,结合潜在的miRNA, miR766-3p是HuCCT1和RBE细胞中富集程度最高的miRNA(图6b)。RIP检测结果表明,AGO2抗体富集miR-766-3p(图6c)。然后我们证实,与正常组织相比,miR-766-3p在ICC组织中下调,并且ICC患者中miR-766-3p的低水平与较差的生存率相关(图6d-e)。此外,我们观察到ICC组织中miR-766-3p的表达与circPCNXL2水平呈负相关(图6f)。我们根据circPCNXL2与miR-766-3p之间的结合区域设计了circPCNXL2的突变质粒,双荧光素酶报告实验的结果表明,与对照组相比,共转染野生型circPNCXL2和miR-766-3p模拟物的荧光素酶活性显著降低,而突变型circPCNXL2组没有发现差异(图6g)。miR-766-3p模拟物显著抑制HuCCT1细胞的增殖和迁移,miR-766-3p抑制剂促进RBE细胞的ICC进展(图6h-i)。综上所述,miR-766-3p可以抑制ICC细胞的肿瘤发生。
在之前的研究中,miR-766-3p可以通过直接靶向SRSF1抑制肾细胞癌的进展。因此,我们假设SRSF1也可能是ICC中miR-766-3p的下游基因。转染miR-766-3p模拟物的HuCCT1细胞中SRSF1 mRNA和蛋白水平降低,转染miR766-3p抑制剂的RBE细胞中SRSF1 mRNA和蛋白水平升高(图6j-k)。然而,SRSF1在ICC进展中的作用尚不清楚。然后,我们使用qRT-PCR检测了SRSF1在组织中的表达,发现与正常组织相比,SRSF1在ICC组织中表达上调,而在TCGA数据库中也观察到类似的结果(图6l)。SRSF1的高表达是ICC患者的一个致癌因素(图6m)。此外,qRT-PCR结果显示SRSF1表达与circPCNXL2表达呈正相关,而与miR-766-3p的表达呈负相关(图6n-0)。然后,我们根据SRSF1与miR-766-3p的结合区域设计了SRSF1的突变质粒,双荧光素酶报告实验的结果证实了SRSF1与miR-766-3p的相互作用(图6p)。此外,克隆形成和transwell实验结果表明,SRSF1过表达显著促进了HuCCT1细胞的增殖和迁移。在转染SRSF1下调的RBE细胞中发现了相反的结果(图6q-r)。我们还证实SRSF1可以促进HuCCT1和RBE细胞中ERK的磷酸化,这可以通过circPCNXL2过表达或敲低来拯救(图6s-t)。综上所述,circPCNXL2可以通过miR766-3p/SRSF1/ERK通路调控ICC的增殖和迁移。
7)CircPCNXL2在体内可减轻曲美替尼的抗肿瘤作用
曲美替尼是一种口服MEK抑制剂,已被批准单独或联合用于治疗黑色素瘤、非小细胞肺癌等癌症。为了研究circPCNXL2对曲美替尼的影响,我们在体内应用曲美替尼抑制MEK/ERK通路,并利用circPCNXL2过表达的HuCCT1细胞建立皮下异种移植模型和肝转移模型。在异种移植物模型中,曲美替尼抑制肿瘤生长,这种抑制作用通过circPCNXL2过表达而恢复(图7a-c)。免疫组化染色显示,曲美替尼组Ki-67和p-ERK的染色最弱(图7d)。circPCNXL2的上调显著减弱了曲美替尼在ICC中的抗肿瘤作用。在肝转移模型中也观察到类似的结果。曲美替尼治疗减少了肝转移灶的数量,可以通过过表达circPCNXL2来恢复(图7e-f)。综上所述,这些数据证明circPCNXL2通过激活体内ERK的磷酸化来抑制曲美替尼在ICC中的抗肿瘤作用,这可能是一种很有前景的ICC治疗策略。

结论:
我们的研究表明circPCNXL2在ICC中上调,并通过与STRAP相互作用促进ERK的磷酸化,在ICC的发展中发挥肿瘤启动子的作用。此外,circPCNXL2作为miR-766-3p的海绵,导致SRSF1的上调,进而激活ICC中的MEK/ERK通路(图7g)。总的来说,我们的研究结果表明circPCNXL2可以作为ICC患者的诊断和预后生物标志物。此外,circPCNXL2STRAP-MEK-ERK轴是一个有希望在ICC中进一步研究的翻译治疗靶点。
实验方法:
RNA-seq,动物实验,FISH,RNA pull‑down,RIP,免疫共沉淀,双荧光素酶报告基因实验,qRT-PCR,WB,IHC,CCK-8,Edu,克隆形成实验,创伤愈合实验
参考文献:
Liu S, Wang Y, Wang T, Shi K, Fan S, Li C, Chen R, Wang J, Jiang W, Zhang Y, Chen Y, Xu X, Yu Y, Li C, Li X. CircPCNXL2 promotes tumor growth and metastasis by interacting with STRAP to regulate ERK signaling in intrahepatic cholangiocarcinoma. Mol Cancer. 2024 Feb 17;23(1):35. doi: 10.1186/s12943-024-01950-y.






