肿瘤细胞来源的LC3B+细胞外囊泡通过HSP90α-IL-6/IL-8轴介导HCC肿瘤微环境与免疫治疗效果之间的串扰
肝癌是全球癌症相关死亡的第三大原因,其中肝细胞癌(hepatocellular cancer, HCC)占70%-85%。最近,ICIs治疗在晚期HCC患者中显示出有希望的疗效和可控的安全性,这表明靶向肿瘤微环境是一种治疗癌细胞的策略。肿瘤微环境中慢性炎症和炎症介质水平增加,如IL-6和IL-8,可以将免疫调节反应重定向到促癌方向。肿瘤细胞衍生的细胞外囊泡(EV)已经成为一种新的细胞间通讯模式,充当生物活性分子的载体来影响肿瘤微环境。在这项研究中,作者发现血浆IL-6和IL-8在肝癌患者中高度表达,这与总生存期短(OS)相关,并且主要由单核细胞和中性粒细胞分泌。此外,证明了LC3B+EVs上携带的HSP90α对于LC3B+EVs诱导的IL-6和IL-8分泌至关重要,这抑制了CD8+T细胞活性。使用体外研究的组合发现PD-1和HSP90α、IL-6或IL-8的联合阻断可以协同恢复CD8+T细胞功能。最后,MAP1LC3B、HSP90AA1、IL6或IL8高表达的患者抗PD-1/PD-L免疫治疗效果较低。总体而言,靶向HSP90α、IL-6或IL-8与PD-1抑制剂联合使用是HCC患者的有效新策略。
该研究于2024年2月3日发表在《Clinical Immunology》,IF:8.6。
技术路线
主要研究结果
1. 肝癌患者血浆高IL-6、IL-8与预后不良的关系
为了探讨肝癌患者可能存在的免疫系统失调,采用流式荧光免疫微珠法检测外周血中12种细胞因子(IFN-α、IFN-γ、TNF-α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12p70和IL-17)。发现肝癌患者中只有IL-6和IL-8显著高于健康供者(图1A和B)。此外,为了阐明与肝癌患者预后相关的IL-6或IL-8基因,根据Kaplan-Meier Plotter网站的数据进行了总生存期(OS)分析。结果表明,IL6,特别是IL8的高表达与较短的OS相关,并预测预后不良(图1C)。还发现在有或没有肝炎病毒感染或饮酒的肝癌患者中,IL8的高表达都与较短的OS相关(图1D和E)。这些发现表明IL-6和IL-8可能参与肝癌的进展。
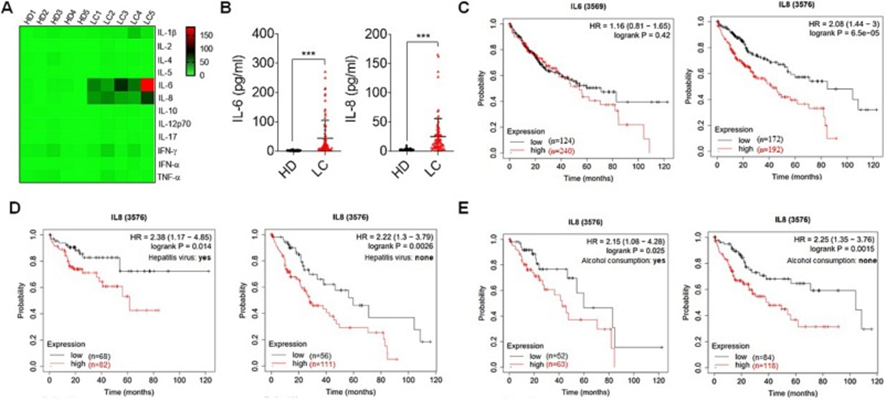
图1:肝癌患者血浆白细胞介素-6和白细胞介素-8水平较高,与较差的生存率相关
2. 肝癌细胞来源的EVs在体外作为IL-6和IL-8分泌的关键调节因子
为了了解肝癌细胞分泌IL-6和IL-8的关键因素,在抗CD3/抗CD28存在下,将肝癌细胞与健康供体的白细胞共孵育。值得注意的是,肝癌细胞可以诱导白细胞分泌IL-6和IL-8。当通过transwell室与白细胞分离时,IL-6和IL-8的分泌也增加了(图2A)。此外,通过在14,000 g离心30分钟从肿瘤细胞培养基中耗尽EVs,导致白细胞产生IL-6和IL-8的显著减少(图2B)。这些数据表明肿瘤细胞来源的大EVs是诱导细胞因子分泌的关键物质之一。
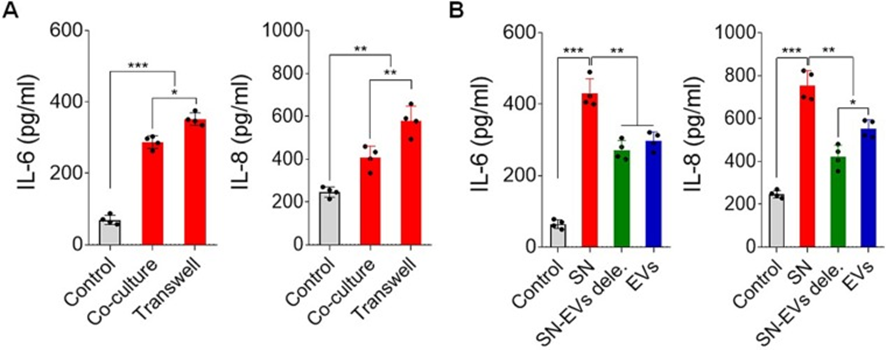
图2:肝癌细胞来源的EVs是诱导白细胞分泌IL-6和IL-8的关键物质之一
3. 肝癌患者血浆LC3B+EVs与IL-6、IL-8的相关性
之前的观察突出表明,携带HSP90α的LC3B+EVs是能够促进CD4+T细胞促进肿瘤生长和转移的优势EVs。与作者之前的研究一致,肝癌患者血浆中LC3B+EVs和HSP90α+LC3B+EVs的比例明显高于健康供体(HD)组(图3A、B、C和D)。正如预期的那样,相关分析结果显示,LC3B+EVs,特别是HSP90α+LC3B+EVs的水平与IL-6和IL-8水平显著正相关(图3E)。与这一结果一致的是,基于TIMER 2.0的LC3B蛋白编码基因MAP1LC3B和HSP90α蛋白编码基因HSP90AA1与IL6和IL8呈正相关(图3F和G)。此外,GEPIA2数据库还显示肝癌患者MAP1LC3B和HSP90AA1表达较高,预后较差(图3H和I)。综上所述,这些结果表明肿瘤来源的LC3B+EVs可能是诱导IL-6和IL-8分泌的关键物质。
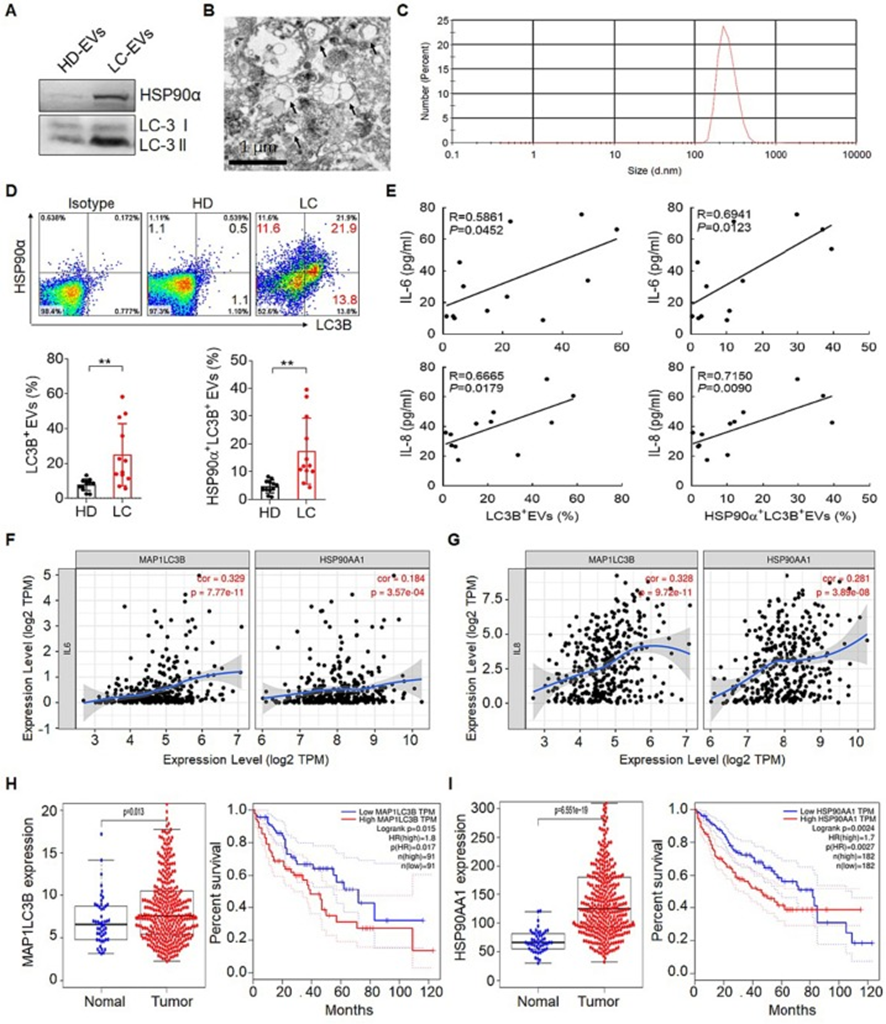
图3:肝癌患者血浆LC3B+EVs水平较高,与预后不良相关
4. LC3B+EVs通过HSP90α促进白细胞来源的IL-6和IL-8分泌
为了确定LC3B+EVs是否影响体外IL-6和IL-8分泌,首先从人肝癌细胞的培养上清液中分离并鉴定了LC3B+EVs。HSP90α和自噬体标记LC3-I/II在LC3B+EVs中高度丰富,而CD63和CD9也存在,但水平要低得多(图4A、B和C)。与自噬体的特征相似,LC3B+EVs被发现具有直径为200至600 nm的双膜结构(图4D和E)。在抗CD3和抗CD28激活期间用LC3B+EVs处理人类白细胞后,发现LC3B+EVs在上调IL-6和IL-8分泌方面比LC3B−EVs更有效,这表明LC3B+EVs是指导白细胞的主导EVs(图4F)。
为了确定LC3B+EVs上存在的HSP90α在诱导白细胞分泌IL-6和IL-8中的作用,用HSP90α抗体阻断LC3B+EVs表面的HSP90α减弱了LC3B+EVs诱导的IL-6和IL-8分泌,表明膜结合的HSP90α在LC3B+EVs上起着重要作用(图4G)。此外,用HSP90α抗体预处理的肿瘤细胞培养上清液(SN)或超速离心耗尽EVs进一步证实了上述结果(图4H)。为了进一步证实HSP90α对LC3B+EVs的特异性作用,用HSP90αsiRNA转染肿瘤细胞。转染后,发现HSP90α在细胞和纯化的LC3B+EVs中的表达都明显降低(图4I)。ELISA检测显示,与转染非靶向对照siRNA的细胞的LC3B+EVs相比,转染HSP90α-siRNA的细胞的LC3B+EVs诱导白细胞产生IL-6和IL-8的能力降低(图4J)。这些结果表明,携带HSP90α的LC3B+EV是诱导IL-6和IL-8分泌的关键生物活性分子。
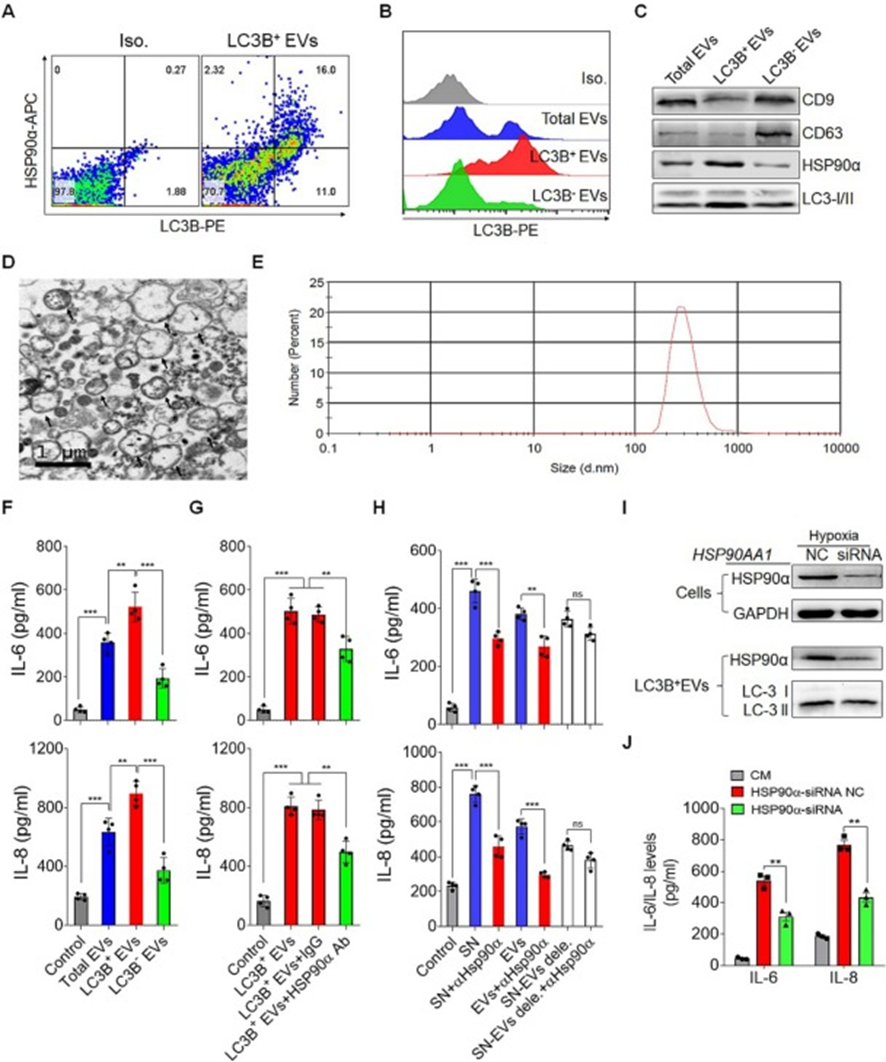
图4:LC3B+EVs上的HSP90α对白细胞中IL-6和IL-8的诱导至关重要
5. IL-6和IL-8主要由单核细胞和中性粒细胞分泌
IL-6和IL-8可由许多细胞产生,但主要来源仍不清楚。肝癌患者流式细胞术分析显示,肝癌患者的IL-6和IL-8产生自CD4+T细胞、CD8+T细胞、B细胞、CD14+单核细胞和中性粒细胞的比例较高,尤其是CD14+单核细胞(图5A和B)。此外,根据FACS分析结果,可以发现IL-6和IL-8主要由CD14+单核细胞和中性粒细胞分泌(图5C和D)。上述结果提示IL-6和IL-8主要来自肝癌患者外周血中的单核细胞和中性粒细胞。
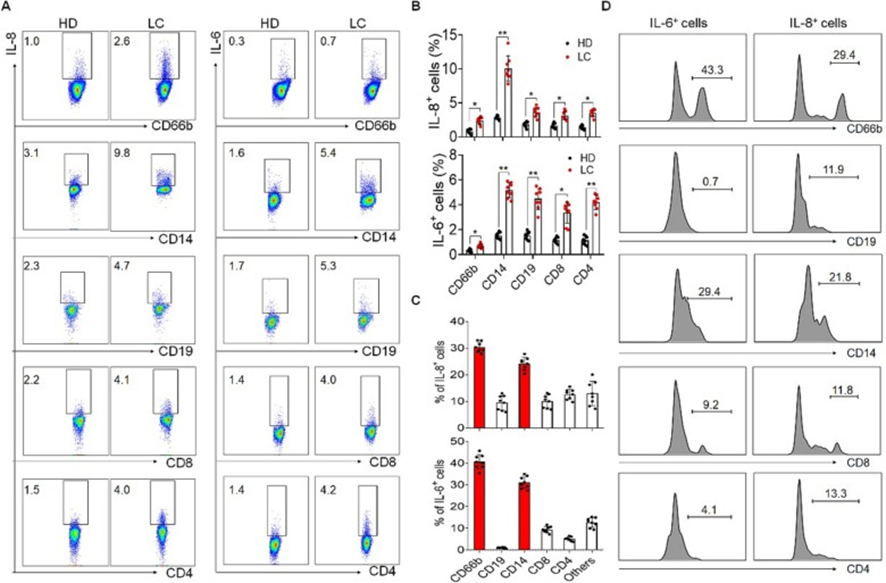
图5:IL-6和IL-8主要由肝癌中的单核细胞和中性粒细胞分泌
6. IL-6和IL-8有助于免疫抑制微环境
为了评估IL-6 / IL-8与炎症反应之间的关系,检查了血浆IL-6 / IL-8水平与选定的循环免疫细胞群体之间的关联。循环IL-6 / IL-8水平与血液中性粒细胞、单核细胞、单核细胞-淋巴细胞比值(MLR)、中性粒细胞-淋巴细胞比值(NLR)正相关,与淋巴细胞计数数量负相关(图6A)。此外还发现高表达IL-6 / IL-8肝癌患者中CD-L1、CD14+单核细胞上CD163和CD8+T细胞上PD-1的表达显著增加(图6B)。与此现象一致的是,在TIMER 2.0数据库中发现IL-6 、 IL-8水平与巨噬细胞、中性粒细胞浸润水平或PDCD1、CD274、CD163表达水平之间存在显著相关性(图6C)。此外,与上述发现一致,TIMER 2.0数据库还显示,MAP1LC3B、HSP90AA1 mRNA水平高的肝癌患者显示出高的巨噬细胞和中性粒细胞浸润水平,或PDCD1、CD274、CD163表达水平(图6D)。这些发现表明,高水平的IL-6和IL-8有助于肝癌患者的免疫抑制微环境。
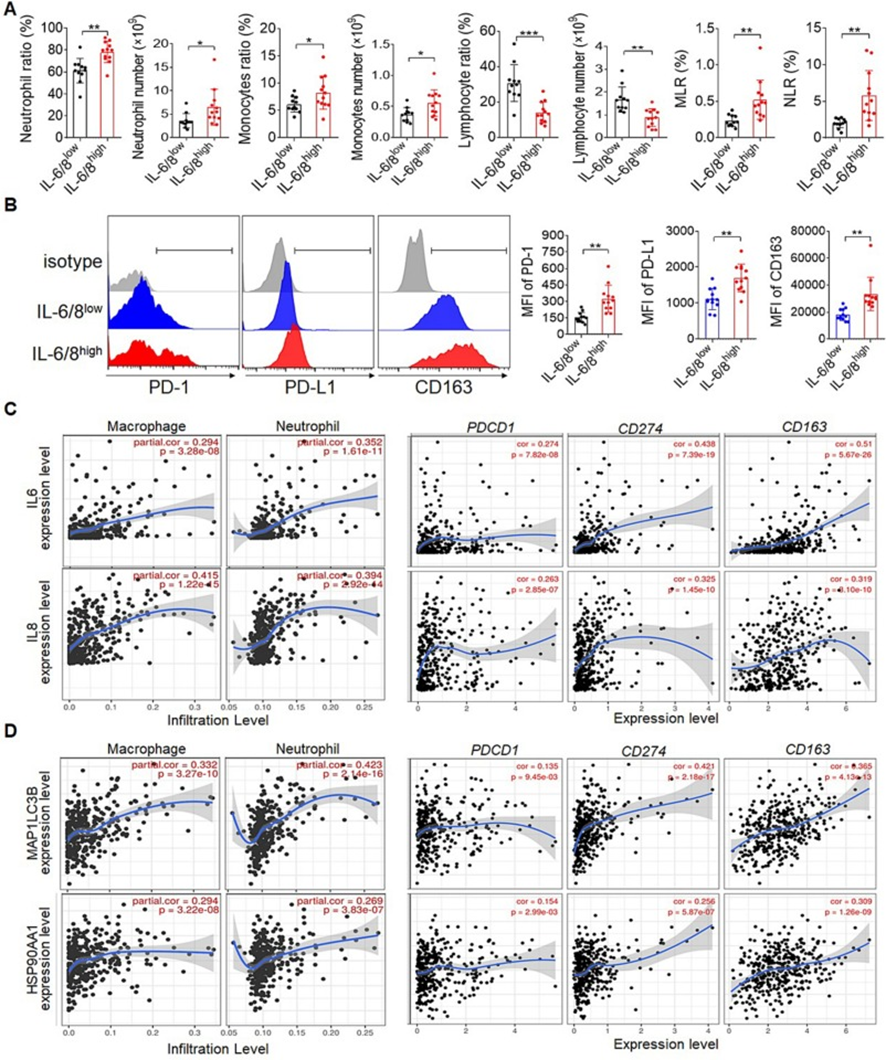
图6:白细胞介素-6和白细胞介素-8与免疫抑制微环境显著相关
7. LC3B+EVs通过HSP90α-IL-6/IL-8轴促进免疫抑制功能
为了进一步确保LC3B+EVs诱导的IL-6和IL-8分泌有助于免疫抑制功能,在体外用LC3B+EVs联合HSP90α、IL-6和IL-8阻断抗体处理白细胞,并通过FACS分析。正如预期的那样,LC3B+EVs处理后,总CD8+T细胞中IFN-γ+CD8+T细胞的百分比降低,而阻断HSP90α、IL-6或IL-8显著逆转了LC3B+EVs阻断CD8+T细胞产生IFN-γ的情况(图7A和B)。进一步发现培养上清液中IFN-γ和TNF-α的水平升高(图7C)。综上所述,这些数据表明LC3B+EVs诱导的白细胞分泌的细胞因子,包括IL-6和IL-8,参与了适应性免疫抑制功能。
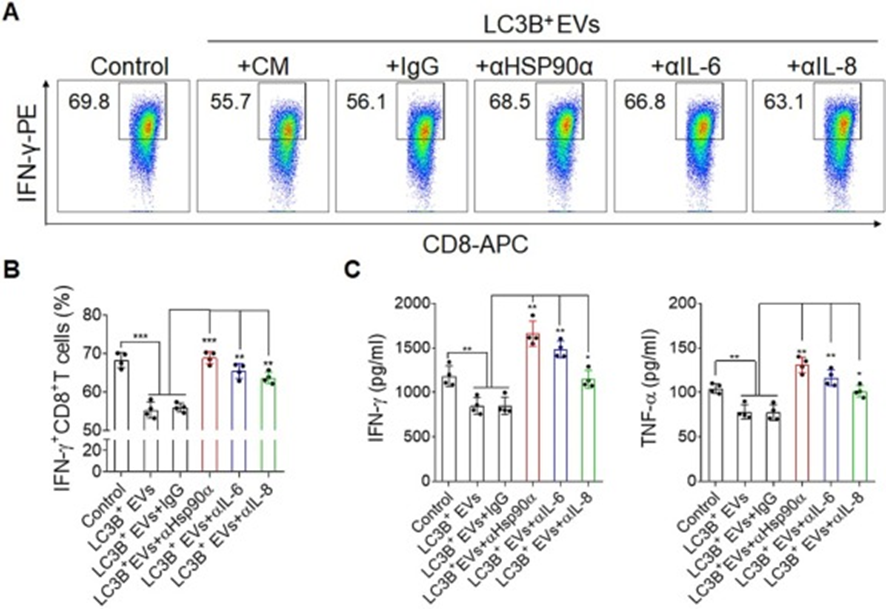
图7:LC3B+EVs通过HSP90α-IL-6/IL-8轴促进免疫抑制功能
8. 联合阻断PD-1和HSP90α、IL-6、IL-8可恢复T细胞功能
作者评估阻断HSP90α、IL-6或IL-8是否能增强PD-1诱导的T细胞活力。为此,分离了健康供者的白细胞,并在抗CD3/CD28存在下用LC3B+EVs处理,这抑制了CD8+T细胞的细胞因子分泌功能(图8A和B)。令人惊讶的是,抗PD-1阻断抗体增加了IFN-γ+CD8+T细胞的比例,而与HSP90α、IL-6或IL-8阻断抗体联合处理进一步增强了这一比例(图8A和B)。此外,抗PD-1阻断抗体也增加了培养上清液中IFN-γ和TNF-α的分泌,并通过联合处理进一步增强了这一比例(图8C)。值得注意的是,与PD-1、IL-6和IL-8阻断抗体联合处理并没有进一步协同增强CD8+T细胞的功能。这些结果表明,靶向HSP90α的LC3B+EVs、IL-6或IL-8可以与抗PD-1单克隆抗体协同增强CD8+T细胞的功能,这可能为临床治疗肝癌提供一种新的方式。
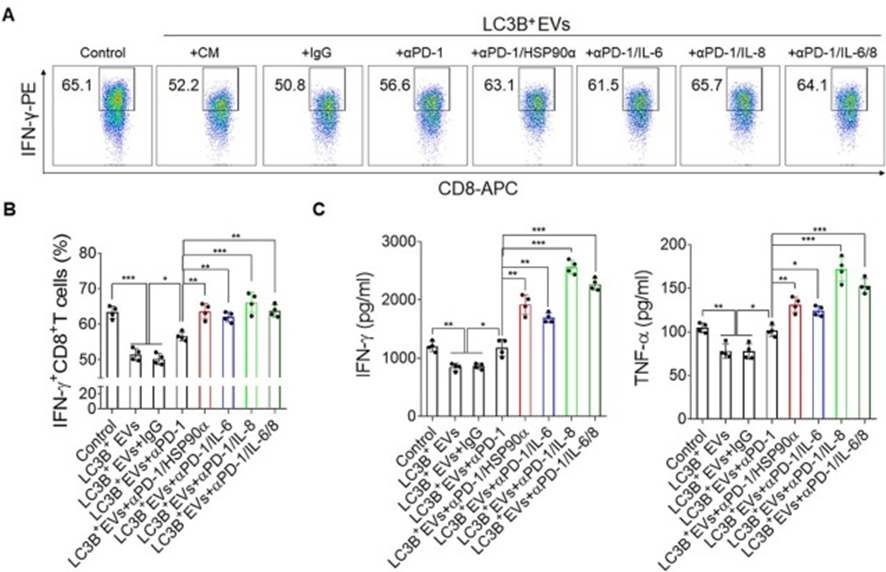
图8:联合阻断PD-1和HSP90α、IL-6或IL-8增强CD8+T细胞功能
9. LC3B+EVs-HSP90α-IL-6/IL-8轴预测免疫治疗疗效
为了进一步探讨LC3B+EVs-HSP90α-IL-6/IL-8信号轴与免疫治疗之间的关系,首先分析了来自癌症基因组图谱(TCGA)数据集的选定肿瘤队列中的肿瘤突变负担(TMB),这是与免疫检查点抑制剂(ICIs)疗效相关的潜在因素,并发现MAP1LC3B、HSP90AA1、IL6或IL8转录本表达水平与TMB之间的低相关性(图9A)。这些结果表明LC3B+EVs-HSP90α-IL-6/IL-8轴介导的免疫治疗效果与TMB无关。随后,来自TCGA数据集的患者根据IPS分为低免疫反应组和高免疫反应组。Kaplan-Meier生存曲线显示,高免疫反应组中使用PD-1/PD-L1抑制剂治疗的肝癌患者的整体生存率(OS)(图9B)和PFS(图9C)与低免疫反应组患者相比。在高免疫反应队列中,高MAP1LC3B和HSP90AA1表达水平均与PD-1/PD-L1抑制剂治疗的肝癌患者OS预后较差相关(图9D)。同时,尽管没有显著差异,但IL6或IL8低的患者比IL6或IL8高的患者预后相对更好(图9D)。然而,低免疫反应组HSP90AA1或IL8高表达的患者OS明显比IL6或IL8低的患者差(图9E)。这些结果表明,LC3B+EVs-HSP90α-IL-6/IL-8轴对PD-1/PD-L1抑制剂治疗的肝癌患者预后较差。
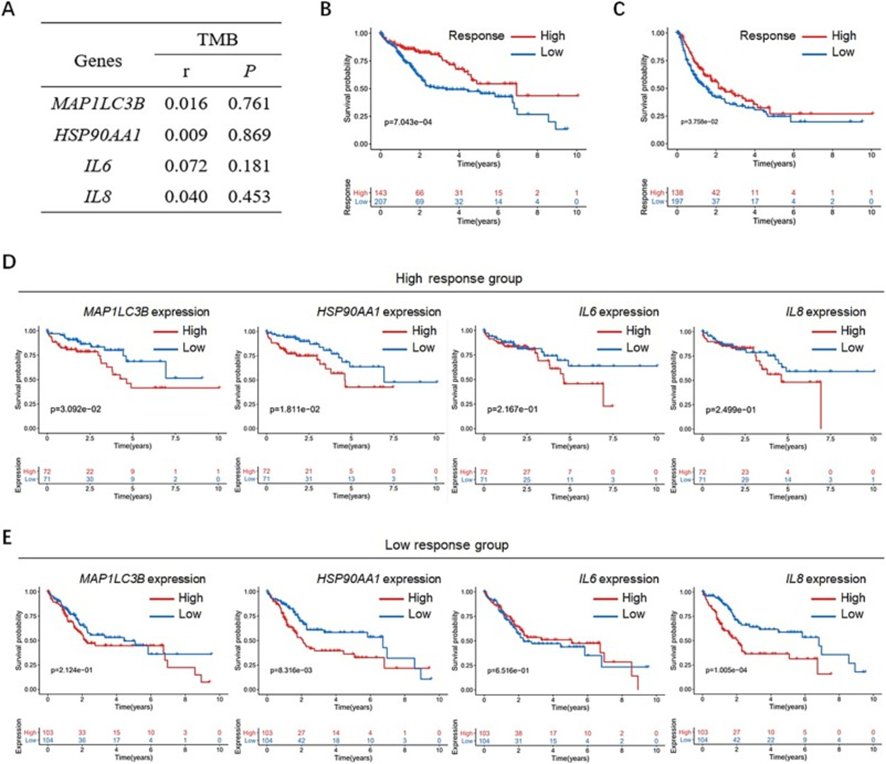
图9:PD-1/PD-L1抑制剂治疗肝脏患者MAP1LC3B、HSP90AA1、IL6、IL8水平与TMB、免疫治疗效果的关系
结论
作者发现携带HSP90α-IL-6/IL-8轴的LC3B+EVs在驱动肝癌患者CD8+T细胞功能障碍中的基本作用。阻断LC3B+EVs-HSP90α-IL-6/IL-8信号轴可与PD-1/PD-L1抑制剂协同恢复CD8+T细胞功能。基于复杂的肿瘤免疫微环境和发现,未来的临床评估侧重于抑制多个靶点,包括靶向LC3B+EVs上的HSP90α、IL-6或IL-8,联合ICI可能会改善肝癌患者的预后。
参考文献
Astier Clémence, Ngo Carine, Colmet-Daage Léo, Marty Virginie, Bawa Olivia, Nicotra Claudio, Ngo-Camus Maud, Italiano Antoine, Massard Christophe, Scoazec Jean-Yves, Smolenschi Cristina, Ducreux Michel, Hollebecque Antoine, Postel-Vinay Sophie. (2024). Molecular profiling of biliary tract cancers reveals distinct genomic landscapes between circulating and tissue tumor DNA. Exp Hematol Oncol, 13(1), 2. doi:10.1186/s40164-023-00470-7.






