Mic19耗竭会损害内质网-线粒体接触和线粒体脂质代谢,并引发肝病
内质网(ER)与线粒体接触对于调节脂质转运、合成和代谢至关重要。然而,内质网-线粒体接触的分子机制和生理功能仍不清楚。研究人员发现MICOS(线粒体接触位点和嵴组织系统)复合物的一个关键亚基Mic19通过EMC2-SLC25A46-Mic19轴调控ER-线粒体接触。Mic19肝脏特异性敲除(LKO)会导致小鼠肝细胞内质网与线粒体接触减少、线粒体脂质代谢紊乱、线粒体嵴紊乱和线粒体未折叠蛋白应激反应,损害肝脏线粒体脂肪酸β氧化和脂质代谢,从而可能自发引起小鼠非酒精性脂肪性肝炎(NASH)和肝纤维化。然而,Mic19 LKO肝细胞中Mic19的重新表达可阻断小鼠肝病的发展。此外,Mic19过表达还能抑制MCD诱导的脂肪肝。因此,作者的研究结果揭示了EMC2-SLC25A46-Mic19轴是调节ER-线粒体接触的途径,并揭示了ER-线粒体接触受损可能是与NASH和肝纤维化发展相关的机制。本文于2024年1月发表在《Nature Communications》,IF:16.6。
技术路线
主要实验结果:
1.Mic19参与调节ER-线粒体接触
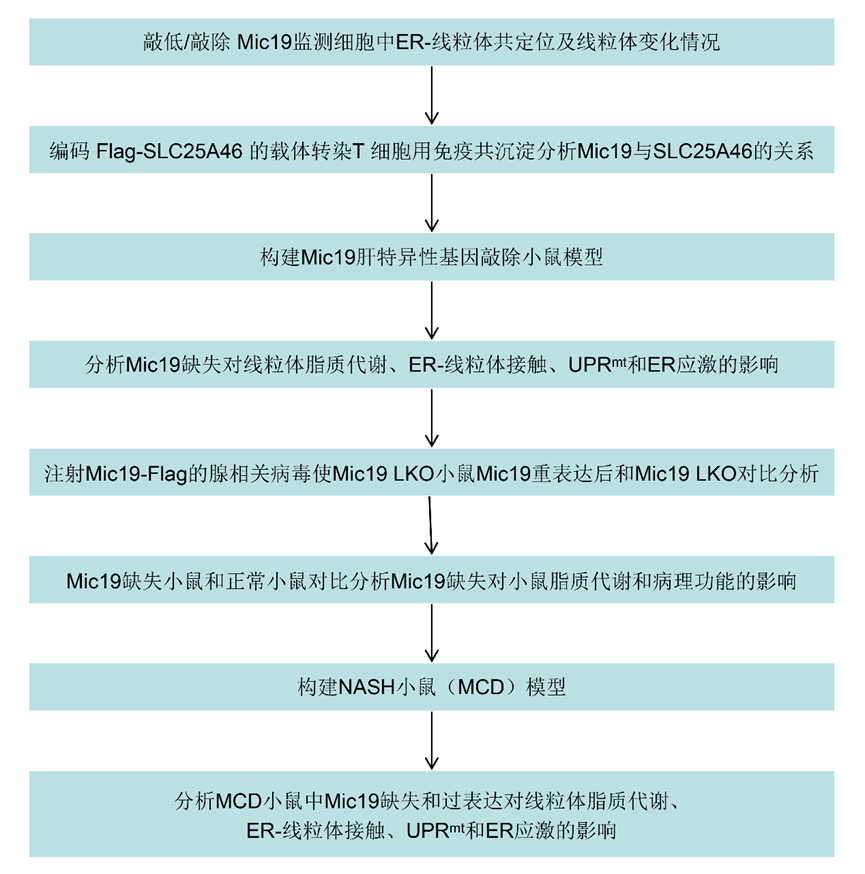
线粒体可与细胞内质网(ER)接触,以调节重要的细胞稳态功能。MAMs是ER和线粒体之间的物理联系,对细胞稳态至关重要。Monteiro-Cardoso等人最近报道,脂质转移蛋白ORP5和ORP8主要位于MAM亚结构域,并与MICOS复合物物理连接。Mic19是MICOS复合物的一个关键亚基,对MICOS和SAM复合物的完整性至关重要。作者随后研究了Mic19在线粒体-ER接触中的作用。HIS-SIM分析显示,在Mic19敲除(KD)或敲除(KO)的HeLa或COS7细胞中,ER和线粒体的共定位减少(图1a-d)。此外,透射电子显微镜(TEM)分析表明,Mic19 KO导致线粒体超微结构异常,包括线粒体嵴连接(CJs)缺失和线粒体嵴排列改变,但线粒体长度没有变化(图1e-g)。此外,Mic19KO导致ER与线粒体之间的距离显著增加,并导致ER-线粒体接触数量减少(图1h,i),表明Mic19耗竭会减少ER-线粒体接触。此外,作者还研究了Mic19耗竭对线粒体数量和含量的影响,这可能会损害ER-线粒体接触。HIS-SIM成像和Western blotting(WB)分析表明,线粒体数量和含量(线粒体标记蛋白,包括Tom20、Tom40、Tim23、SDHA和Cox4)在Mic19KO细胞中没有变化。此外,mito-keima检测显示,与对照细胞相比,Mic19 KO细胞的线粒体自噬没有发生变化。因此,这些结果表明,Mic19参与了ER-线粒体接触的调控。
图一:Mic19耗竭减少ER-线粒体接触。
2.Mic19通过EMC2-SLC25A46-Mic19轴调节ER-线粒体接触
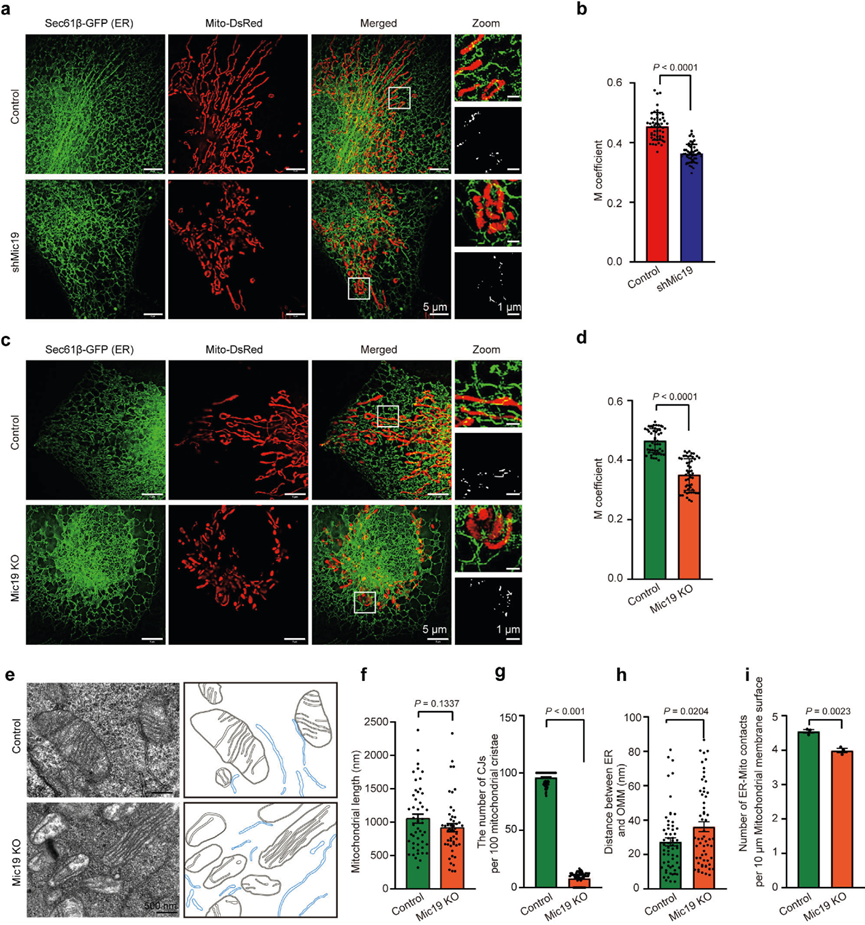
线粒体外膜蛋白SLC25A46与MICOS复合物相互作用,并通过EMC235维持与ER的相互作用。因此,作者研究了Mic19调控的ER与线粒体之间的串扰是否与SLC25A46有关。使用抗Flag或抗SLC25A46抗体进行免疫共沉淀(co-IP)分析表明,Flag-SLC25A46偶联珠或SLC25A46偶联珠能沉淀Mic19、Mic60和EMC2,而对照珠不能,表明SLC25A46能与Mic19、Mic60和EMC2相互作用(图2a,b)。此外,Mic19 KO会降低细胞中SLC25A46的蛋白水平(图2c,d),SLC25A46 KD也会导致Mic19蛋白的轻微减少(图2e,f)。此外,MG132处理不能抑制CHX(环己亚胺,蛋白质合成抑制剂)诱导的对照组和Mic19 KO细胞中SLC25A46的减少(降解),表明Mic19KO引起的SLC25A46降解独立于泛素-蛋白酶体途径。然后,作者探讨了线粒体蛋白酶对Mic19 KO诱导的SLC25A46降解的影响。WB分析显示,OMA1或Yme1L的缺失会显著抑制Mic19KO细胞中SLC25A46的降解,这表明线粒体蛋白酶OMA1和Yme1L有助于Mic19 KO引起的SLC25A46降解。此外,WB分析显示,CLS1基因敲除降低了细胞中Mic19、Mic60和SLC25A46的蛋白水平,这表明SLC25A46和MICOS亚基的降解可能是心磷脂依赖性的。
此外,HIS-SIM成像显示,SLC25A46 KD显著减少了HeLa细胞中ER-线粒体的接触(图2g,h)。此外,TEM分析显示,SLC25A46 KD导致HeLa细胞中CJs减少,但线粒体长度没有改变(图2i-k);而且,SLC25A46 KD显著增加了ER和线粒体之间的距离,减少了线粒体-ER接触的数量(图2l,m),表明SLC25A46调控ER-线粒体接触。值得注意的是,通过mito-keima检测,SLC25A46 KD细胞的线粒体自噬没有发生变化。因此,这些结果表明,Mic19与SLC25A46相互作用形成EMC2-SLC25A46-Mic19轴,有助于调控ER-线粒体接触。
图二:Mic19通过EMC2-SLC25A46-Mic19轴参与线粒体和ER之间的相互作用。
3.Mic19基因缺失诱导线粒体脂质代谢紊乱
ER-线粒体接触对于磷脂在ER和线粒体之间的运输至关重要,可调节线粒体的脂质代谢。作者将Mic19flox/flox与在小鼠肝细胞中特异表达Cre的Albumin-Cre转基因小鼠杂交,产生了Mic19肝特异性基因敲除(LKO)小鼠。WB分析表明,Mic19在小鼠肝脏中被特异性消耗,但在小鼠的其他器官,包括肌肉、心脏、脾脏、肾脏和大脑中也有表达。然后,作者分离了线粒体部分,分析了3个月大的Mic19 LKO小鼠肝脏中线粒体磷脂的含量。脂质组学分析表明,Mic19 LKO小鼠肝脏线粒体部分的磷脂酸(PA)、心磷脂(CL)、磷脂酰胆碱(PC)、磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)的丰度下降(图3a,b),表明Mic19的缺失损害了线粒体磷脂的代谢。CL是线粒体特有的磷脂,主要位于IMM38,对线粒体结构和功能的维持至关重要。由于EMC2-SLC25A46-Mic19轴调控线粒体-ER接触,作者研究了EMC2-SLC25A46-Mic19轴在CL代谢中的作用。作者分离了细胞的线粒体部分,并对纯化的线粒体部分进行了WB分析。进一步的脂质组学分析表明,Mic19KO或SLC25A46 KD细胞线粒体部分的CL水平下降(图3c-f)。此外,作者还通过10-N-壬基吖啶橙(NAO,一种心磷脂结合染料)染色分析了对照组、Mic19 KO和SLC25A46 KD细胞中的CL水平。共聚焦成像和流式细胞术分析表明,Mic19或SLC25A46的缺失导致CL显著减少(图3g-j),表明Mic19或SLC25A46的缺失会影响CL的代谢。此外,TMRM染色和流式细胞仪分析显示,Mic19KO和SLC25A46 KD降低了细胞线粒体膜电位,这可能是由于CL代谢受损所致。此外,WB分析显示,在Mic19 KO或SLC25A46 KD细胞中,CLS1(心磷脂合成酶1)和Tafazzin(TAZ,催化转酰形成成熟的心磷脂)的蛋白水平没有变化。此外,Mic19 LKO小鼠肝脏中的CLS1或TAZ蛋白水平也保持不变。这些数据表明,Mic19或SLC25A46的缺失并不影响线粒体合成CL的能力。值得注意的是,虽然CLS1和TAZ的蛋白水平没有变化,但许多其他因素也可能导致心磷脂水平降低:磷脂合成酶的活性可能受到抑制,包括酶失活修饰;此外,底物限制也可能是一个因素。因此,Mic19基因缺失通过EMC2-SLC25A46-Mic19轴诱导线粒体脂质代谢紊乱。EMC2-SLC25A46-Mic19轴共同调节ER-线粒体接触并参与线粒体脂质代谢。
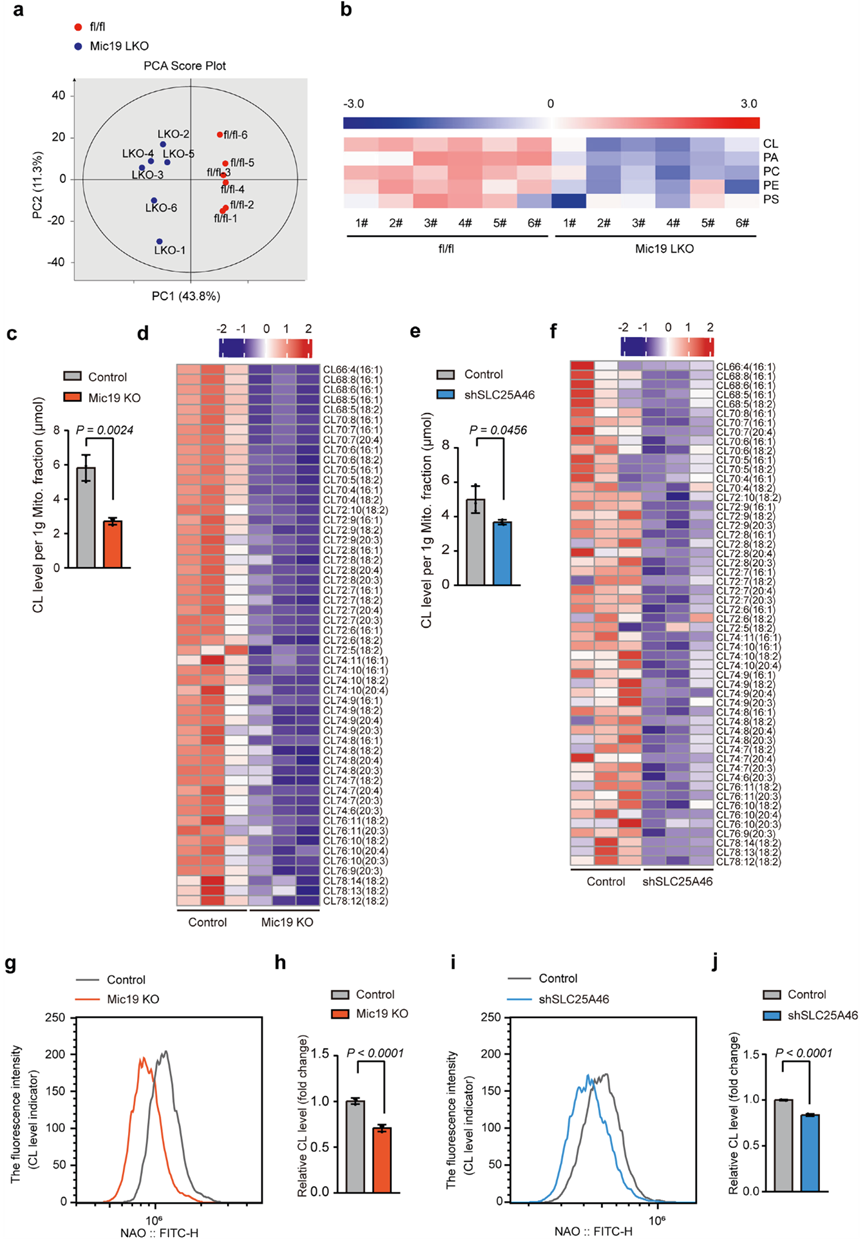
图三:线粒体和ER之间的异常串联导致线粒体中的心磷脂减少。
4.Mic19基因敲除导致小鼠肝脏线粒体膜紊乱和线粒体未折叠蛋白反应
ER-线粒体接触对于调控线粒体的多种功能至关重要。为了研究EMC2-SLC25A46-Mic19轴介导的ER-线粒体接触的生物学和生理功能,作者培养了Mic19 LKO小鼠。Mic19 LKO导致包括Mic10、Mic60和Mic13在内的MICOS复合体亚基显著减少,并导致SLC25A46显著减少(图4a,b)。由于Mic19的缺失会影响CL的产生(图3g、h),而CL对线粒体膜的组织至关重要,并与氧化应激和线粒体功能障碍有关,因此作者评估了Mic19 LKO对小鼠肝脏线粒体膜超微结构的影响。TEM分析表明,与对照组(Mic19flox/flox小鼠肝细胞)相比,Mic19 LKO小鼠肝细胞显示ER与线粒体之间的距离增加,ER-线粒体接触数量减少(图4c-e),证实Mic19 LKO损害了ER-线粒体接触。此外,Mic19 LKO小鼠肝细胞线粒体嵴明显减少,CJs急剧减少(图4c,f,g),此外Mic19 LKO小鼠肝线粒体嵴膜急剧紊乱(图4c)。因此,Mic19 LKO会导致小鼠肝脏线粒体膜重塑,尤其是线粒体嵴膜的紊乱。
线粒体嵴是线粒体氧化磷酸化的主要部位,而氧化磷酸化对细胞能量的产生至关重要。作者通过对从小鼠肝脏中分离出来的线粒体进行Blue Native-PAGE分析,评估了Mic19 LKO诱导的嵴解离对线粒体氧化磷酸化的影响。引人注目的是,在Mic19 LKO小鼠肝脏线粒体中,复合体I、复合体III、复合体IV和复合体V的水平显著下降,而复合体II的水平却没有下降。接下来,作者利用Oroboros O2k系统的高分辨率呼吸测定法分析了3个月大的Mic19flox/flox和Mic19 LKO小鼠肝细胞的耗氧率。在各种线粒体复合物抑制剂的作用下,Mic19 LKO小鼠肝脏的耗氧量持续低于Mic19flox/flox小鼠肝脏的耗氧量(图4h),表明Mic19 LKO导致小鼠肝脏线粒体氧化磷酸化缺陷。此外,Mic19 LKO小鼠肝脏显示ATP生成减少和ROS水平升高,表明Mic19 LKO诱导的线粒体膜紊乱导致线粒体应激或功能障碍。线粒体应激或功能障碍期间,线粒体未折叠蛋白反应(UPRmt)被激活,导致包括线粒体蛋白酶和伴侣蛋白在内的保护基因转录上调。因此,作者研究了Mic19 LKO是否会触发小鼠肝脏中的UPRmt。WB分析表明,在Mic19 LKO小鼠肝脏中,UPRmt相关蛋白包括线粒体蛋白酶(LONP1、ClpP)、线粒体伴侣HSP60和SOD2(UPRmt的替代标记物)的蛋白水平显著升高,而Tom40(线粒体标记物)的蛋白水平没有升高(图4i、j),表明Mic19 LKO在体内导致了UPRmt。
此外,作者还评估了Mic19 LKO对小鼠肝脏ER稳态的影响。作者测试了Mic19 LKO对ER应激的影响。作者通过WB分析测定了多种标记物的表达,包括GRP78(ER应激整体传感器)、Atf6(内质网稳态调节因子)、p-eIF2α(翻译起始因子eIF2磷酸化)和Chop(ER应激下游蛋白)。与对照组相比,Mic19 LKO小鼠肝脏中的GRP78、Atf6、Chop和p-eIF2α蛋白水平显著升高(图4k、l)。此外,ER应激抑制剂TUDCA(tauroursodeoxycholate)能显著抑制Mic19 LKO诱导的小鼠GRP78、Atf6、Chop和p-eIF2α的上调。这些结果表明,Mic19 LKO触发了小鼠肝脏的ER应激。
综上所述,Mic19 LKO引起的ER-线粒体接触减少与UPRmt和ER应激高度相关。
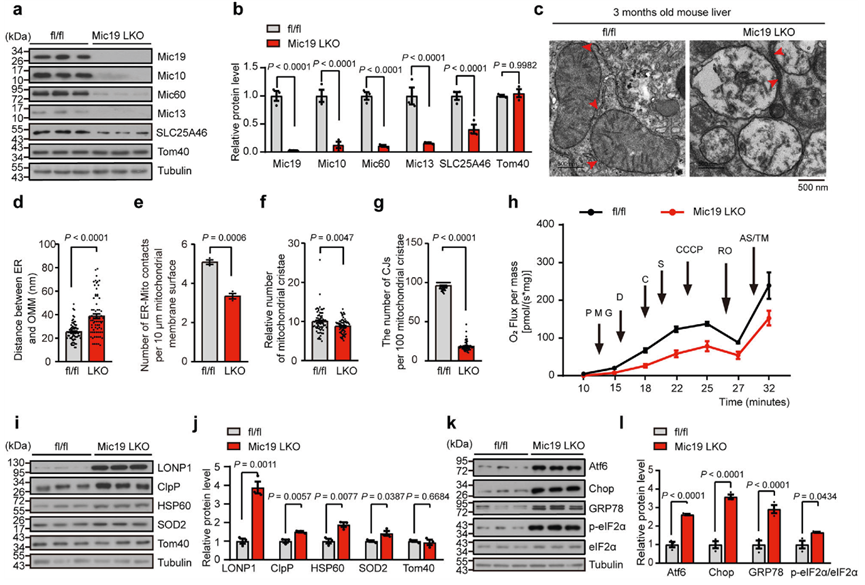
图四:Mic19 LKO会导致小鼠出现UPRmt和ER应激。
5.Mic19 LKO会损害小鼠肝脏的脂肪酸代谢
为了进一步研究Mic19介导的ER-线粒体接触的生理功能和线粒体脂质代谢紊乱,作者研究了Mic19 LKO对小鼠脂质代谢的影响。在正常饮食条件下,Mic19 LKO小鼠的体重比同窝对照小鼠(Mic19flox/flox)显著下降,这并不是由于食物和水摄入量减少,因为Mic19 LKO小鼠的食物和水摄入量显著增加。此外,Mic19 LKO小鼠3个月大时肝脏甘油三酯(TG)水平显著升高,但肌肉甘油三酯、血清TG、肝脏胆固醇和血清极低密度脂蛋白(VLDL)水平没有变化(图5a-e)。此外,Mic19 LKO小鼠肝脏和血清游离脂肪酸(FFA)水平显著升高(图5f、g)。然而,Mic19 LKO小鼠肝脏中丙二酰-CoA水平和大多数脂肪生成相关基因(包括Mlycd、Fasn、Gpat2、Agpat1、Lpin1和Dgat2)的mRNA水平均无变化。此外,WB分析表明,在Mic19小鼠肝脏中,p-Acc1/Acc1(比值)和Fasn(负责从头合成脂肪酸的主要酶)没有发生变化,这表明Mic19 LKO可能不会影响脂肪酸的合成。这些数据表明,Mic19 LKO损伤了小鼠肝脏的脂肪酸代谢而非合成。为了进一步探索其潜在机制,作者提取了对照组和Mic19 LKO小鼠肝脏RNA进行测序。作者发现Mic19 LKO小鼠肝脏中有3145个基因上调,3133个基因下调。有趣的是,与脂质代谢相关的基因,尤其是与脂肪酸代谢相关的基因(细胞色素P450、亚油酸和花生四烯酸的代谢)在Mic19 LKO小鼠肝脏中被下调(图5h)。因此,作者对小鼠肝脏的线粒体脂肪酸氧化进行了分析。qRT-PCR分析显示,在禁食条件下,Mic19 LKO小鼠肝脏中一些线粒体β氧化基因包括Cpt1a、Cpt2、Acad9和Acads的mRNA水平显著下降(图5i)。然而,ER应激抑制剂TUDCA抑制了Mic19 LKO诱导的这些与线粒体β氧化有关的基因的减少。此外,在喂养和禁食条件下,Mic19 LKO小鼠肝脏中乙酰-coA的水平也明显降低(图5j)。这些数据表明,Mic19 LKO损伤了小鼠肝脏线粒体脂肪酸的β-氧化。
此外,众所周知,线粒体脂肪酸β氧化可导致肝脏在禁食条件下产生酮体(生酮)。作者发现,在Mic19 LKO小鼠肝脏中,β-羟基丁酸(βHB,酮体之一)的生酮产物明显减少(图5k),生酮相关基因Hmgcs2和Hmgcl的mRNA水平下降(图5l),表明Mic19 LKO小鼠肝脏的生酮过程受损。
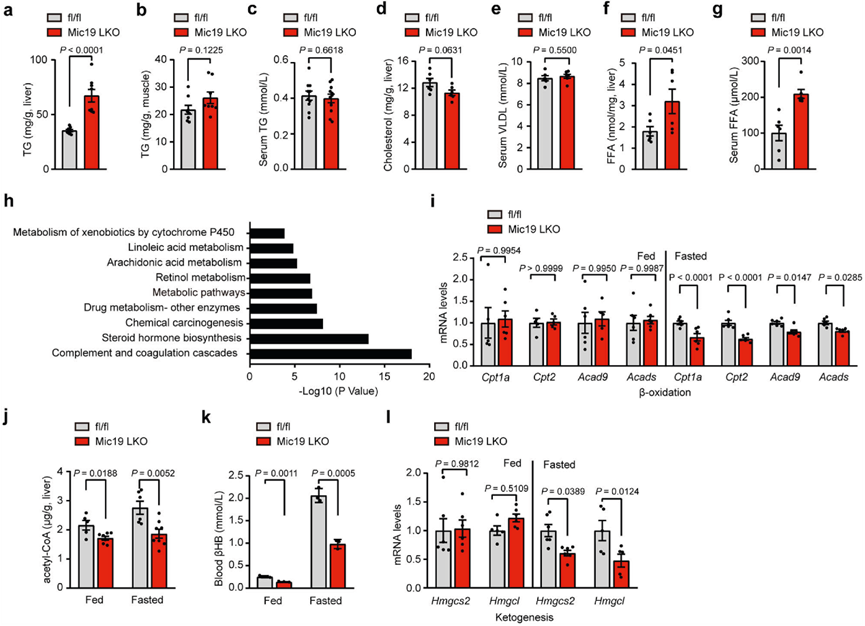
图五:Mic19 LKO影响小鼠的脂肪酸代谢。
此外,在小鼠代谢笼实验中,Mic19 LKO小鼠的耗氧量(VO2)和二氧化碳产生率(VCO2)也显著增加。脂肪组织是调节能量平衡的重要器官,它不仅储存能量,还是新陈代谢的调节器。包括eWAT(附睾白色脂肪组织)和iWAT(腹股沟白色脂肪组织)在内的脂肪组织重量略有下降。然而,qRT-PCR分析显示,在Mic19 LKO小鼠iWAT中,一些线粒体β氧化基因(包括Cpt1a、Cpt2和Acads)的mRNA水平显著升高。这些结果表明,Mic19 LKO小鼠iWAT中脂肪分解增加,这可能是肝组织中β氧化功能受损的代偿反应,从而增加了Mic19小鼠的能量消耗。
因此,Mic19 LKO增加了小鼠肝脏中脂肪酸和总胆固醇的水平,这很可能是由于肝线粒体β氧化作用的减少。
6.Mic19 LKO会导致非酒精性脂肪性肝炎(NASH)和肝纤维化
由于Mic19 LKO会损害小鼠肝脏线粒体的β氧化功能,作者随后评估了Mic19 LKO对小鼠病理功能的影响。与对照组相比,Mic19 LKO使小鼠3个月大时丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的活性显著升高(图6a、b),表明Mic19 LKO会导致小鼠肝损伤。此外,Mic19 LKO小鼠(3个月大)的肝脏显示出大量脂肪堆积(图6c)。此外,苏木精和伊红(H&E)染色以及油红O染色显示,Mic19 LKO小鼠(3个月大)的肝脏出现了明显的脂肪变性(图6d、e)。进一步的TEM分析显示,与对照组小鼠相比,Mic19 LKO小鼠(3个月大)肝脏中脂滴(LDs)的数量和大小明显增加(图6f-h)。此外,在喂养或禁食条件下,Mic19 LKO小鼠肝脏(3月龄)的CD36(脂肪酸转运体,脂肪肝的标志物)mRNA水平是对照组小鼠肝脏的10倍以上,表明脂质摄取可能是Mic19 LKO诱导小鼠肝脏脂质积累的原因之一。这些数据表明,Mic19 LKO会导致3个月大的小鼠出现脂肪肝。此外,作者还研究了Mic19 LKO诱导的脂肪积累是否会导致肝脏炎症。作者检测了编码炎症细胞因子和趋化因子的基因的表达。qRT-PCR分析显示,在Mic19 LKO小鼠(3月龄)肝脏中,炎症相关基因Cxcl10、Cd68和Tnf的mRNA水平显著升高。免疫组化分析CD68染色进一步显示Mic19 LKO小鼠(3个月大)肝脏中单核细胞/巨噬细胞明显增加,证实Mic19 LKO会导致3个月大小鼠慢性肝脏炎症。此外,Masson三色染色显示,对照组和Mic19 LKO小鼠(3个月大)的肝脏没有差异。因此,作者的数据表明,Mic19 LKO会导致小鼠(3个月大)发生非酒精性脂肪性肝炎(NASH)。
慢性肝脏炎症可导致肝纤维化。作者接下来研究了Mic19 LKO是否会导致肝纤维化,这是肝病自然进展的结果。在正常饮食条件下,Mic19 LKO小鼠(7个月大)的体重仍然低于同窝对照组。此外,7个月大的Mic19 LKO小鼠血清中的谷丙转氨酶(ALT)和谷草转氨酶(AST)仍然显著升高(图6i、j)。然而,与对照组相比,Mic19 LKO小鼠在7个月大时并未出现明显的脂肪堆积(图6k)。此外,对照组和Mic19 LKO小鼠(7个月大)的肝脏TG水平没有差异(图6l),这可能是由于小鼠的代偿效应。H&E染色显示Mic19 LKO小鼠(7个月大)肝脏中炎症和坏死区域明显增加(图6m),qRT-PCR分析显示Mic19 LKO小鼠(7个月大)肝脏中炎症相关基因包括Cxcl10、Cd68和Tnf的mRNA水平明显增加。此外,Masson三色染色显示,与对照组相比,Mic19 LKO(7个月)导致小鼠肝脏细胞外胶原蛋白急剧积累(图7n),表明Mic19 LKO导致小鼠(7个月)肝纤维化。此外,qRT-PCR分析表明,在Mic19 LKO小鼠(7个月大)中,编码纤维化标志物(包括Col1a1和Col3a1)的基因的mRNA水平显著升高。此外,Mic19 LKO小鼠(7个月大)体内的羟脯氨酸(肝组织中的纤维化标志物)、血清碱性磷酸酶(ALP,肝病标志物)和γ-谷氨酰转肽酶(γ-GT,肝细胞损伤标志物)水平也显著升高。这些数据表明,Mic19 LKO会导致肝纤维化逐渐加重。总之,Mic19 LKO会逐渐引发小鼠的NASH和肝纤维化。
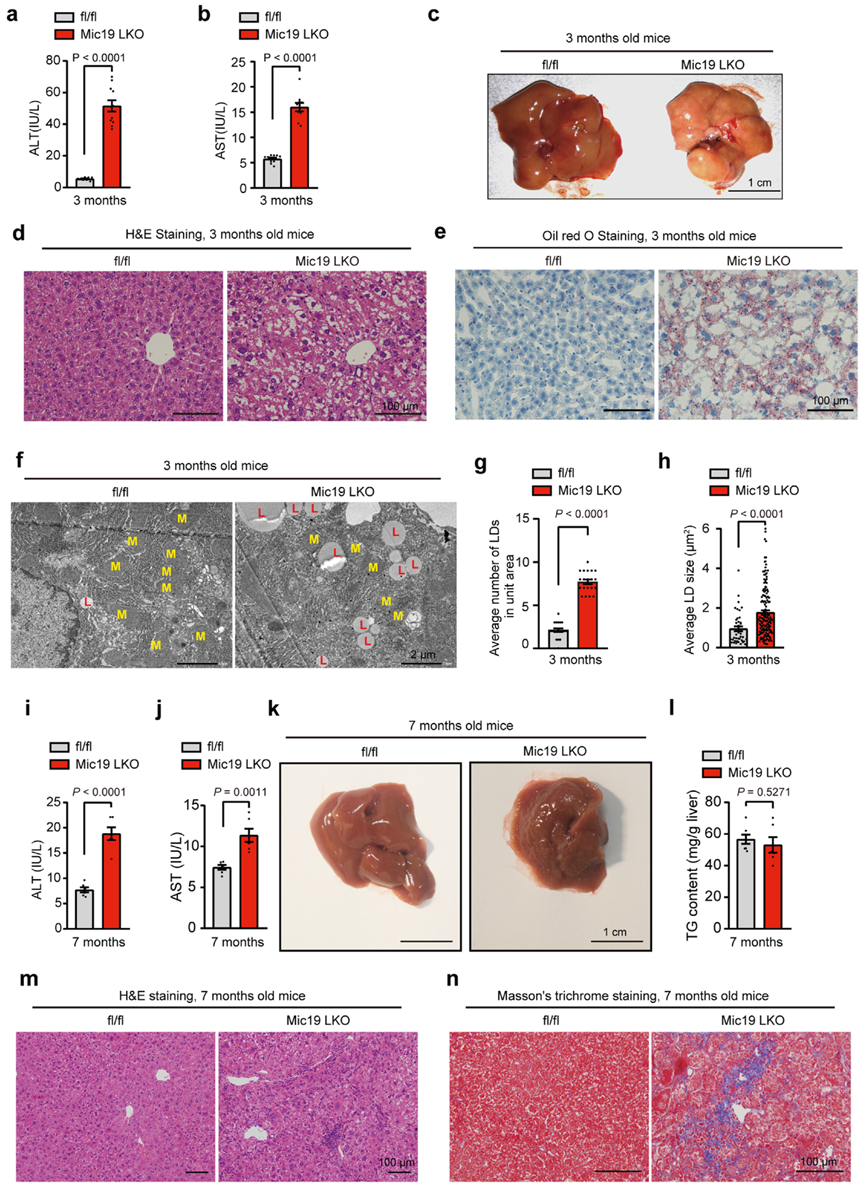
图六:Mic19 LKO导致小鼠患上非酒精性脂肪肝。
7.Mic19 LKO小鼠体内重新表达Mic19可恢复肝脏脂质代谢并阻止肝脏疾病的发生
为了确定Mic19 LKO小鼠的改变是否归因于Mic19功能缺失机制,作者给8周龄的Mic19 LKO小鼠尾部静脉注射编码对照组或Mic19-Flag的腺相关病毒(AAV),使Mic19在小鼠肝脏中重新表达。在Mic19 LKO小鼠肝脏中重新表达Mic19后(图7a),小鼠的体重恢复到对照组(Mic19flox/flox)小鼠的体重,UPRmt相关蛋白包括LONP1、ClpP、HSP60和SOD2的蛋白水平明显低于Mic19 LKO小鼠肝脏的蛋白水平,与对照组小鼠肝脏的蛋白水平没有差异(图7b,c),表明Mic19的再表达极大地抑制了Mic19 LKO诱导的UPRmt。此外,作者还研究了Mic19重表达对小鼠ER应激的影响。WB显示,重表达Mic19 LKO小鼠肝脏中的GRP78、Atf6、Chop和p-eIF2α蛋白水平显著低于Mic19 LKO小鼠肝脏中的水平,但与对照组小鼠肝脏中的水平相似,表明重表达Mic19显著减轻了Mic19 LKO引起的小鼠ER应激。
然后,作者研究了Mic19重表达对小鼠肝脏脂质代谢的影响。在Mic19 LKO小鼠肝脏中重新表达Mic19后,其肝甘油三酯(TG)水平明显低于Mic19 LKO小鼠(图7d)。同样,油红O染色显示,Mic19的再表达极大地抑制了Mic19 LKO引起的肝脂肪变性(图7e)。此外,与Mic19 LKO相比,Mic19的再表达显著下调了肝脏炎症相关基因(包括Cxcl10、Cd68和Tnf)的mRNA水平(图7f)。此外,Mic19的再表达还显著降低了小鼠血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)的水平(图7g、h)。这些数据表明,重新表达Mic19可通过恢复肝脏脂质代谢阻断Mic19 LKO诱发的NASH。
作者还研究了重新表达Mic19是否能抑制Mic19 LKO引起的小鼠(7个月大)肝纤维化。H&E和Masson的三色染色显示,Mic19的再表达显著减少了Mic19 LKO(7个月)导致的小鼠肝脏坏死和细胞外胶原蛋白的积累(图7i-l)。此外,qRT-PCR分析表明,Mic19重表达Mic19 LKO小鼠(7个月大)肝脏中编码纤维化标志物Col1a1和Col3a1的基因的mRNA水平明显低于Mic19 LKO小鼠肝脏中的水平(图7m)。这些数据表明,Mic19的再表达可阻断Mic19 LKO(7个月)诱发的小鼠肝纤维化。因此,在Mic19 LKO小鼠中重新表达Mic19可以通过恢复肝脏脂质代谢来阻止Mic19 LKO引发的NASH和肝纤维化。
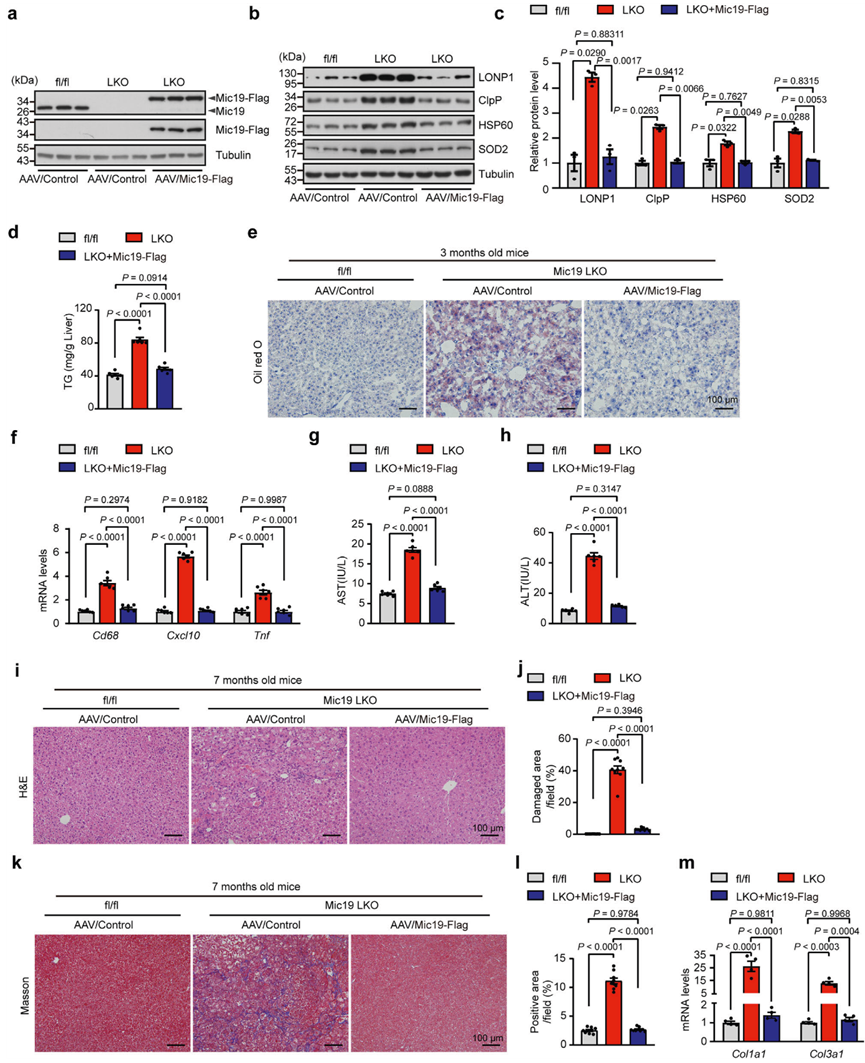
图七:重新表达Mic19可改善Mic19 LKO小鼠的肝损伤。
8.Mic19过表达抑制MCD诱导的脂肪肝
为了进一步证实Mic19与NASH之间的联系,作者建立了NASH小鼠模型(称为MCD),该模型由蛋氨酸和胆碱缺乏饮食与45%高脂饮食(HFD)组成,并在饮用水中补充0.1%的L-蛋氨酸。H&E和油红O染色显示,MCD小鼠的脂肪堆积明显增加(图8a、b)。此外,MCD小鼠肝脏中的总胆固醇水平和炎症相关基因Cd68、Cxcl10和Tnf的mRNA水平也明显升高(图8c,d)。这些数据表明,MCD会导致小鼠的NASH(脂肪肝和肝脏炎症)。然后,作者检测了Mic19在对照组和MCD小鼠中的表达。MCD小鼠肝脏中Mic19和Mic60蛋白的表达量明显低于对照组(图8e,f)。此外,TEM分析显示,MCD小鼠肝细胞中线粒体嵴明显减少,线粒体嵴连接点数量急剧下降(图8g-i),表明MCD诱导线粒体嵴重塑,这与MCD小鼠肝脏中Mic19蛋白水平较低的数据一致。有趣的是,与对照组相比,MCD小鼠肝细胞中的ER线粒体接触明显减少(图8g、j)。
然后,作者研究了过表达Mic19对MCD诱导的肝病的影响。将编码Mic19-Flag的腺相关病毒经尾静脉注射到8周龄的MCD小鼠体内。MCD小鼠肝脏过表达Mic19-Flag后,TG水平和炎症相关基因Cd68、Cxcl10和Tnf的mRNA水平的上调均被抑制,并恢复到与正常饮食小鼠相似的水平(图8k-m)。此外,H&E染色显示,Mic19-Flag的过表达显著抑制了MCD引起的小鼠肝脏脂肪变性(图8n)。因此,Mic19的过表达抑制了MCD诱导的脂肪肝。这些结果与Mic19抑制小鼠肝病的功能一致。
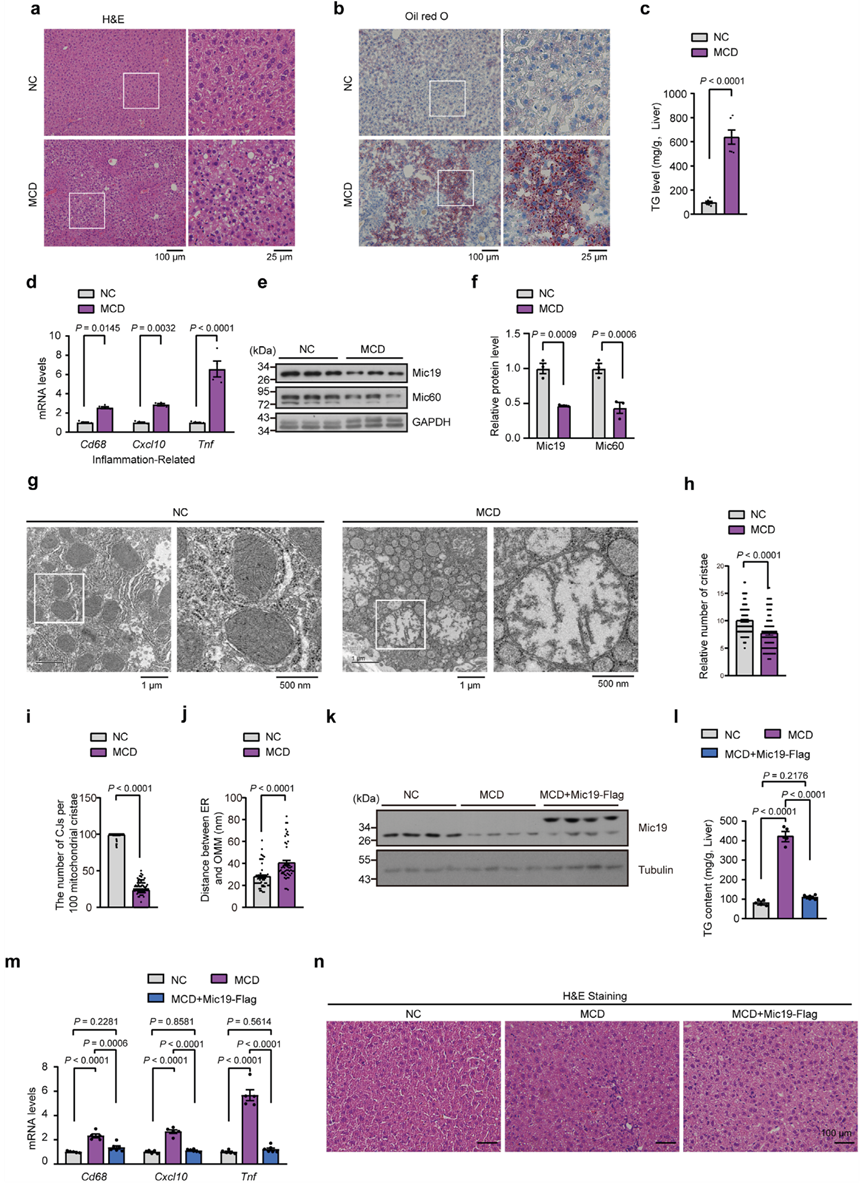
图八:患有MCD诱导的脂肪肝的小鼠模型显示肝脏的Mic19水平较低。
实验方法:
蛋白免疫印迹(WB)、免疫共沉淀(co-IP)、免疫荧光(IF)、免疫染色和共聚焦成像、透射电子显微镜(TEM)、流式细胞术、qRT-PCR、免疫组化分析
参考文献:
Dong J, Chen L, Ye F, Tang J, Liu B, Lin J, Zhou PH, Lu B, Wu M, Lu JH, He JJ, Engelender S, Meng Q, Song Z, He H. Mic19 depletion impairs endoplasmic reticulum-mitochondrial contacts and mitochondrial lipid metabolism and triggers liver disease. Nat Commun. 2024 Jan 2;15(1):168. doi: 10.1038/s41467-023-44057-6. PMID: 38168065; PMCID: PMC10762189.






