M1巨噬细胞通过细胞外囊泡转移线粒体诱导胰腺β细胞铁死亡
细胞外囊泡(EVs)不仅对疾病的发病机制产生重大影响,而且对其治疗干预作用也有重大影响,这取决于在其起源细胞中观察到的差异。线粒体可以通过EVs在细胞之间运输,以促进病理变化。在这项研究中,我们发现来源于M1巨噬细胞(M1 EVs)的EVs包裹炎性线粒体,可以穿透胰腺β细胞。炎性线粒体与胰腺β细胞的线粒体融合,导致脂质过氧化和线粒体破坏。此外,线粒体DNA(mtDNA)片段被释放到胞质溶胶中,激活STING通路并最终诱导细胞凋亡。脂肪来源干细胞(ADSC)释放的EVs在抑制M1巨噬细胞反应方面的潜力显示出希望。随后,利用ADSC-EVs并用F4/80抗体修饰以特异性靶向巨噬细胞,旨在体内治疗胰腺β细胞的铁死亡。总之,该数据进一步证明,M1表型巨噬细胞分泌的EVs在β细胞铁死亡中起主要作用,并且修饰的ADSC-EVs表现出相当大的潜力,可以作为靶向递送到巨噬细胞的载体。
技术路线: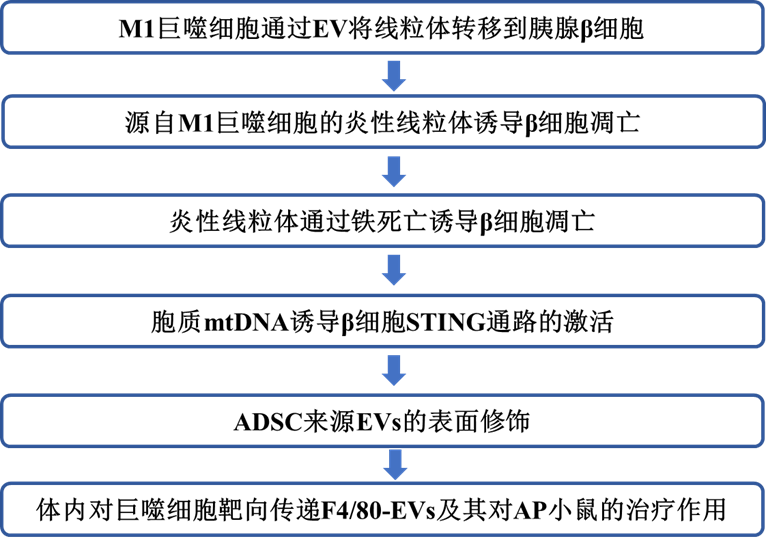
主要研究结果:
1 M1巨噬细胞通过EV将线粒体转移到胰腺β细胞
为阐明来源于M1巨噬细胞的EVs(M1 EVs)对β细胞凋亡作用的分子机制,首先从正常小鼠胰腺组织中分离胰腺驻留巨噬细胞在体外培养,并命名为M0巨噬细胞。然后将M0巨噬细胞极化为M1和M2表型。随后,通过超速离心分离EV。使用蛋白质组学技术分析了这些EV的蛋白质图谱,并对其功能和亚细胞定位注释进行了分类。主要类别包括细胞质、外泌体、溶酶体、细胞核、线粒体和质膜(图1a)。这些数据表明,线粒体成分在被M1巨噬细胞分泌之前被封闭在EVs内。为进一步验证线粒体通过EVs转移,通过蛋白质印迹和免疫电子显微镜在EVs中评估了ATP5A(一种特异性线粒体标记物)的存在。图1b、图c所示结果表明,ATP5A在M1 EV中阳性表达。此外,位于线粒体基质内的蛋白质VDAC、COX IV和PDHA也在M1 EV中表现出阳性表达,这通过蛋白质印迹分析得到了证实(图1d)。这些蛋白质分别构成线粒体外膜和线粒体内膜,并参与电子传输链的最后阶段。本研究调查了M1巨噬细胞分泌的EVs中线粒体成分的存在。然而,是否所有线粒体都被包裹在这些EV内还有待确认。为解决这一问题,对从M1 EV中提取的DNA进行了全基因组PCR分析。结果显示,成功扩增了66个对应于整个线粒体DNA(mtDNA)基因组的扩增子。随后的扩增子测序证实了EVs内完整线粒体的包封,随后将其运输出细胞(图1e)。
为直观检测线粒体通过EVs转运从M1巨噬细胞转移到胰腺β细胞,使用GFP标记M1巨噬细胞中的线粒体,而使用Mito TrackerDeep Red标记β细胞(β TC-6细胞)中的线粒体。随后,使用Transwell单元培养细胞,48小时后观察到GFP荧光。然而,用GW4869预处理的M1巨噬细胞荧光强度显著降低(图2a)。GW4869是一种公认的巨噬细胞外泌体释放抑制剂,如作者的研究所示,在减少M1巨噬细胞中EVs的释放方面表现出显著的功效。
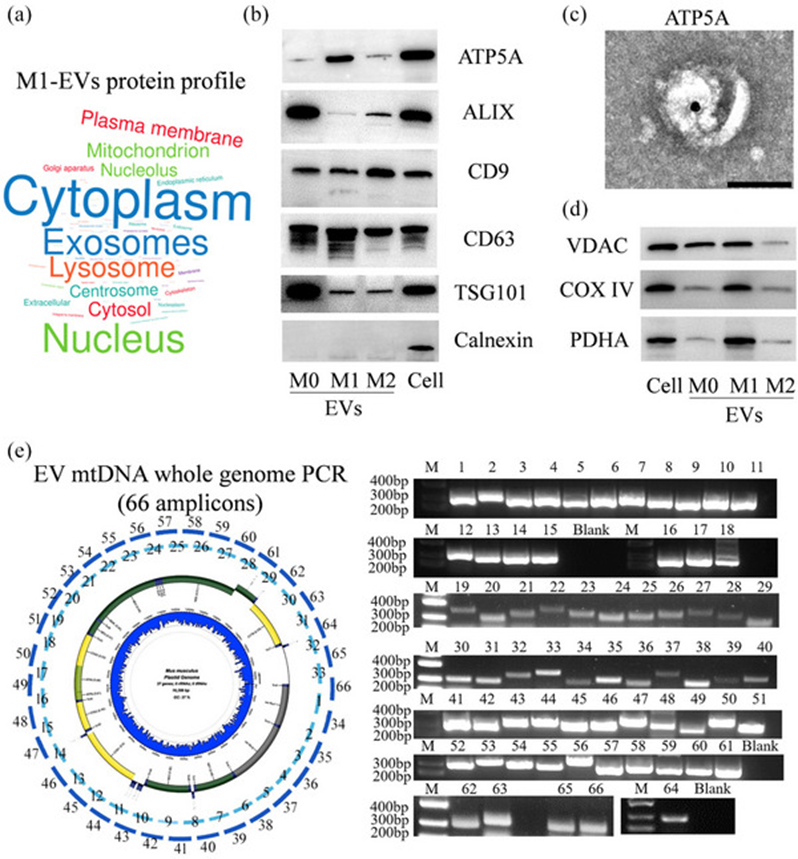
图1:源自巨噬细胞的EVs含有包装线粒体
2 源自M1巨噬细胞的炎性线粒体诱导β细胞凋亡
JC-1是一种广泛用于检测线粒体膜电位的荧光探针。在正常线粒体中,JC-1在线粒体基质中聚集形成聚合物,并发出强烈的红色荧光。当线粒体膜电位低时,JC-1不能聚集在线粒体基质中,从而产生绿色荧光。在与M1巨噬细胞共培养后,使用JC-1细胞评估TC-6细胞的线粒体膜电位。结果显示,与对照细胞相比,表现出JC-1绿色荧光的阳性染色细胞比例显著增加。然而,在经GW4869预处理的M1巨噬细胞共培养的TC-6细胞中,这一比例显著降低(图2b)。在此期间,还使用膜联蛋白V-FITC/PI细胞凋亡检测试剂盒评估βTC-6的细胞凋亡。这些发现与使用JC-1检测方法获得的结果一致。具体而言,与M1巨噬细胞共培养的TC-6细胞中膜联蛋白V阳性细胞的比例显著高于正常细胞。相反,在与用GW4869预处理的M1巨噬细胞共培养的TC-6细胞中观察到膜联蛋白V阳性细胞的显著减少(图2b)。作者的研究结果表明,给予GW4869可减少巨噬细胞通过细胞囊泡分泌释放线粒体。此外,作者观察到用GW4869处理导致巨噬细胞中GFP荧光的显著增加。这些结果表明,线粒体转移是通过EVs的释放发生的。

图2:研究线粒体在M1巨噬细胞和β TC-6细胞之间的转移以及随后对β TC-6细胞中细胞凋亡的分析
活化的巨噬细胞进行代谢重编程,从而诱导促炎表型。这种代谢转变的特征是巨噬细胞线粒体从ATP产生转变为线粒体活性氧(ROS)的产生。此外,线粒体产生的这种ROS也由巨噬细胞分泌,并被其他细胞(如心肌细胞)吸收,以诱导细胞凋亡。在作者的研究中,M0巨噬细胞的线粒体被GFP标记,其激活了炎症M1和抗炎M2表型。随后,从细胞上清液中选择M1和M2巨噬细胞分泌的线粒体,并使用透射电子显微镜和流式细胞术进行检测。为直观地检测胰腺β细胞和巨噬细胞之间的线粒体融合,源自GFP标记的M1巨噬细胞线粒体被引入到以Mito Tracker Deep Red不同浓度标记的β TC-6细胞中。随后,对荧光共定位进行分析,作者的研究结果显示,β TC-6细胞中存在绿色荧光,随着线粒体浓度的升高,绿色荧光的强度逐渐增加,在25和30 μg/mL时达到峰值。绿色荧光与红色荧光共定位,在相同的像素中观察到红色和绿色信号之间的荧光定量(图3a)。这些数据提供了β细胞的线粒体与来源于M1巨噬细胞的线粒体融合的证据。为研究M1巨噬细胞的炎性线粒体对胰腺β细胞凋亡的影响,作者从M1和M2巨噬细胞的细胞上清液中分离线粒体,并以不同剂量将其与β TC-6细胞共培养。研究结果表明,随着M1巨噬细胞中线粒体浓度的增加,凋亡细胞的比例逐渐增加。这种增加在25和30 μg/mL的浓度下达到峰值。然而,通过检测JC-1和膜联蛋白V,M2巨噬细胞的线粒体没有观察到显著变化(图3b,c)。
为研究线粒体通过EV转运在胰腺β细胞和巨噬细胞之间的转移,作者在不同浓度下孵育了来源于GFP标记的M1巨噬细胞和用Mito TrackerDeep Red标记的β TC-6细胞的EV。随后分析了荧光的共定位,发现结果支持线粒体定向转移的概念。具体而言,作者在TC-6细胞中观察到绿色荧光,随着EVs浓度的增加,绿色荧光的强度逐渐增加,在1×108和1×109粒子/mL处达到峰值。红色荧光也与绿色荧光共定位,在相同的像素中观察到红色和绿色信号之间的荧光定量(图4a)。对TC-6细胞的线粒体膜电位和凋亡进行评估,结果与定向线粒体转移的概念一致。随着M1巨噬细胞中EVs浓度的增加,观察到凋亡细胞比例逐渐增加。这种增加在1×108和1×109颗粒/mL的浓度下达到最大值。相反,如JC-1和膜联蛋白V分析所示,M2巨噬细胞的线粒体中没有观察到显著的变化(图4b,c)。因此,使用25 μg/mL M1线粒体(M1 Mito)和1×108个粒子/mL M1 EVs进行后续实验。
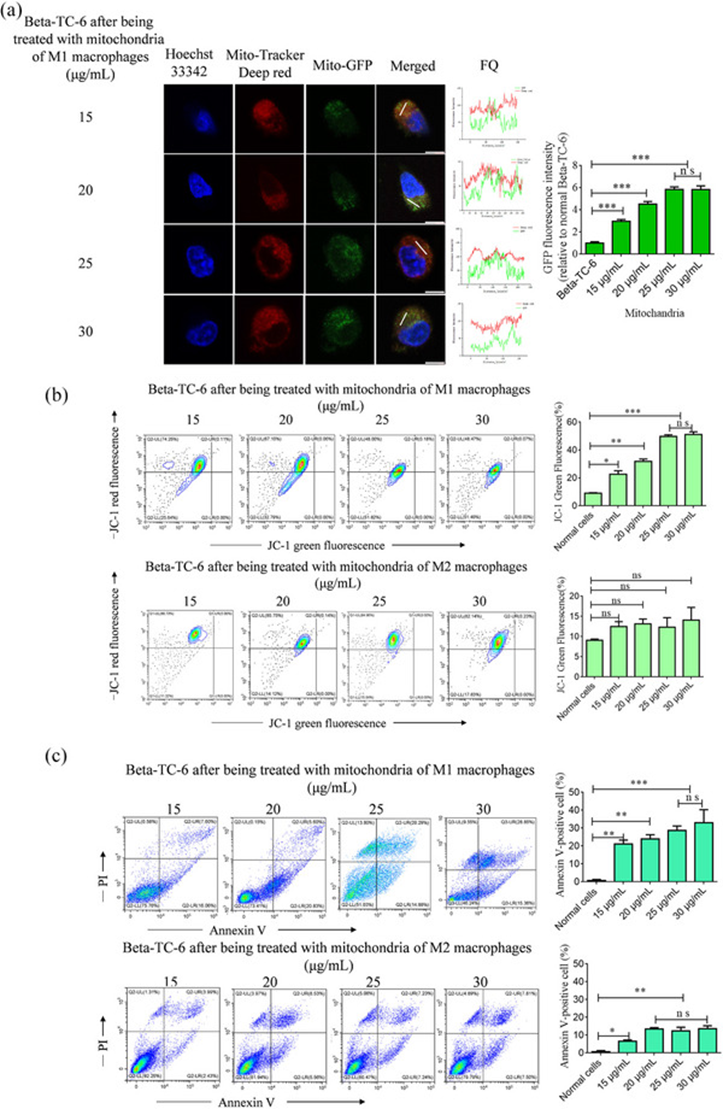
图3:巨噬细胞来源的线粒体与β TC-6 细胞孵育后的凋亡分析
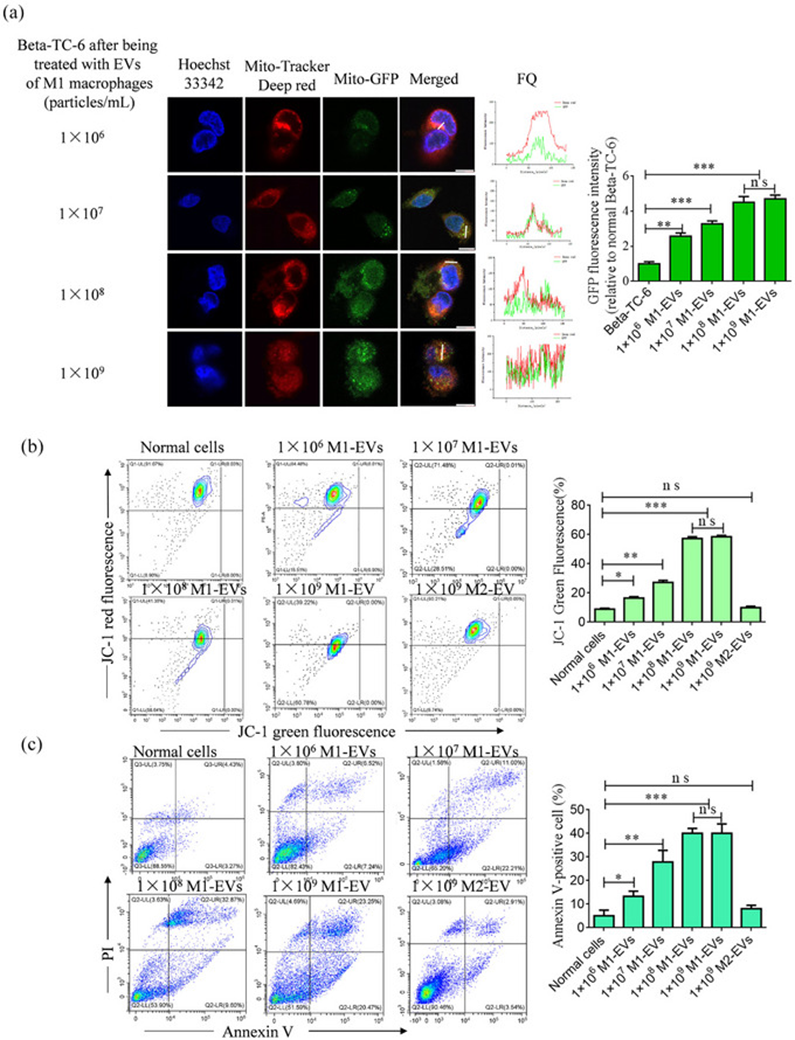
图4:线粒体通过EV的运输从巨噬细胞转移到 β TC-6 细胞
3炎性线粒体通过铁死亡诱导β细胞凋亡
铁死亡是一种铁依赖性的调节性坏死,线粒体在这一过程中发挥着重要作用。在作者的研究中,他们初步评估了EVs或线粒体处理后β TC-6细胞中的ROS、游离Fe2+水平和线粒体脂质过氧化。该评估通过用MitoSox Red、FerroOrange和MitoPePDPP对细胞进行染色来进行。研究结果显示,与正常细胞相比,EVs或线粒体处理的β细胞中MitoSox Red、FerroOrange和MitoPePDPP的荧光强度显著更高。此外,免疫荧光定位分析表明,大多数MitoSox Red、FerroOrange和MitoPeDPP定位在线粒体中。将Ferrostatin-1(Ferro-1,一种脱铁抑制剂)添加到M1 Mito或M1 EVs处理的β TC-6细胞中,以验证铁死亡的作用,并且添加Fer-1后,MitoSox Red、FerroOrange和MitoPePDPP的荧光强度显著降低(图5a-c)。线粒体形态变化是铁死亡的可靠生物标志物,铁死亡是一种以线粒体通透性增加和随后破裂为特征的细胞过程。在作者的研究中,他们使用透射电子显微镜检查了β TC-6细胞的线粒体形态。正常细胞具有明显的线粒体嵴和完整的线粒体膜。相反,用M1 EVs或M1 Mito处理的细胞表现出线粒体肿胀、线粒体嵴溶解和破裂。此外,观察到每个细胞的线粒体数量显著减少(图5d)。
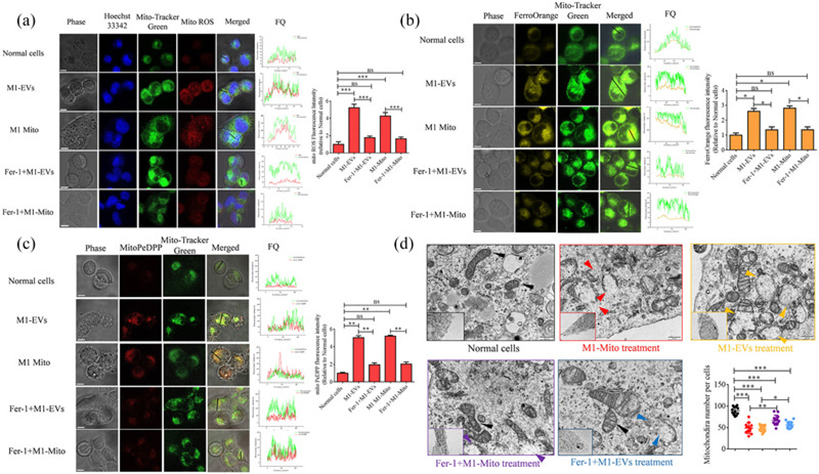
图5:不同处理方案对β TC 6细胞的mitoROS、Fe2+浓度、脂质过氧化含量和线粒体形态的影响
GSH/GSSG是指生物系统中还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的比例,是细胞氧化还原平衡的重要指标。与正常细胞相比,用M1 EVs或M1 Mito处理后,GSH/GSSG比率显著降低。然而,如图6a所示,通过添加Fer-1,缓解了当前情况下的这种干扰。随后,作者研究了Fer-1对β TC-6细胞胰岛素分泌和凋亡的影响。这些结果证实了作者之前的发现,证明在用M1 EVs或M1 Mito处理的β细胞中,Fer-1不仅阻止了细胞凋亡,而且增强了胰岛素分泌,如图6b-d所示。线粒体耗氧率(OCR)反映了线粒体在指定时间段内利用氧的速率。在作者的研究中,还评估了β细胞中的线粒体线粒体耗氧量(OCR),并观察到M1 EVs或M1 Mito治疗后线粒体ATP产生、基础呼吸、最大呼吸、备用呼吸能力和质子泄漏的减少。然而,除了最大呼吸和质子泄漏外,Fer-1的加入减轻了这些影响(图6e)。
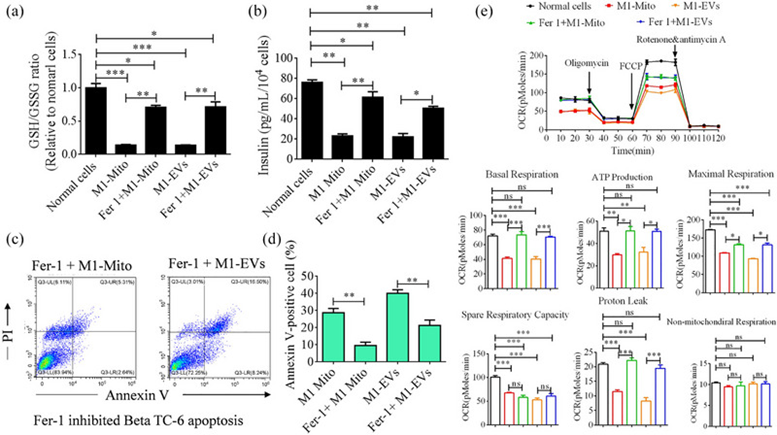
图6:Fer-1能有效恢复经各种处理后β TC 6细胞中下降的GSH/GSGG比值、细胞功能和OCR
4 胞质mtDNA诱导β细胞STING通路的激活
STING通路是先天免疫系统的重要组成部分,在识别胞质DNA和启动针对病原体的免疫反应中发挥着关键作用。此外,它与细胞死亡途径有关,如凋亡、焦亡和坏死。铁死亡导致线粒体通透性增加和断裂,然后mtDNA进入胞质溶胶形成胞质DNA。在本研究中,作者确定了STING通路是否被铁死亡引起的mtDNA释放激活。最初,作者证明了在用M1 EVs或M1 Mito处理后,TC-6细胞中线粒体释放mtDNA。免疫荧光分析显示,在M1 EVs或M1 Mito处理后,β TC-6细胞中的mtDNA与线粒体标记物(TOM20)分离。随后,使用ImageJ共定位插件工具对免疫荧光图像进行共定位分析。计算皮尔逊相关系数(Rr)以评估相关性程度。结果表明,在M1-EVs或M1-Mito处理后,β TC-6细胞的相关系数下降,但在添加Fer-1后增加(图7a),这意味着Fer-1阻止了线粒体断裂。环状GMP-AMP合酶(cGAS)最初被鉴定为双链DNA传感器,在对抗病原体的先天免疫反应中发挥着至关重要的作用。为研究cGAS与线粒体之间的相互作用,使用免疫荧光图像进行共定位分析,重点研究不同处理后TC-6细胞中TOM20与cGAS的共定位。所获得的Pearson相关系数(Rr)低于5.0,表明线粒体和cGAS之间缺乏共定位(图7b)。随后的评估涉及检查cGAS和胞质mtDNA之间的相互作用,这揭示了在各种处理后其在TC-6细胞中的存在(图7c)。为研究cGAS和胞质mtDNA之间相互作用在不同处理下激活TC-6细胞STING通路的必要性,作者使用蛋白质印迹来评估GPX4的表达以及STING和IRF3的磷酸化水平。研究结果显示,在用M1 EVs或M1 Mito处理的β TC-6细胞中,GPX4下调,STING和IRF3磷酸化增加。添加Fer-1产生了对比结果(图7d)。总之,M1巨噬细胞利用EVs将线粒体运输到胰腺β细胞。这些线粒体与β细胞中已经存在的线粒体的融合诱导细胞内Fe2+的积累,增加线粒体活性氧(ROS)和脂质过氧化。因此,线粒体破裂发生,随后线粒体DNA释放到细胞质中。随后,STING通路被激活,最终导致细胞死亡(图7e)。总之,M1巨噬细胞释放EVs促进了胰腺β细胞的死亡。因此,解决M1巨噬细胞引起的胰腺β细胞的死亡需要一种集中的方法来阻止M1巨噬细胞的极化。通过有效抑制M1巨噬细胞的极化,可以减轻AP诱导的葡萄糖代谢异常。
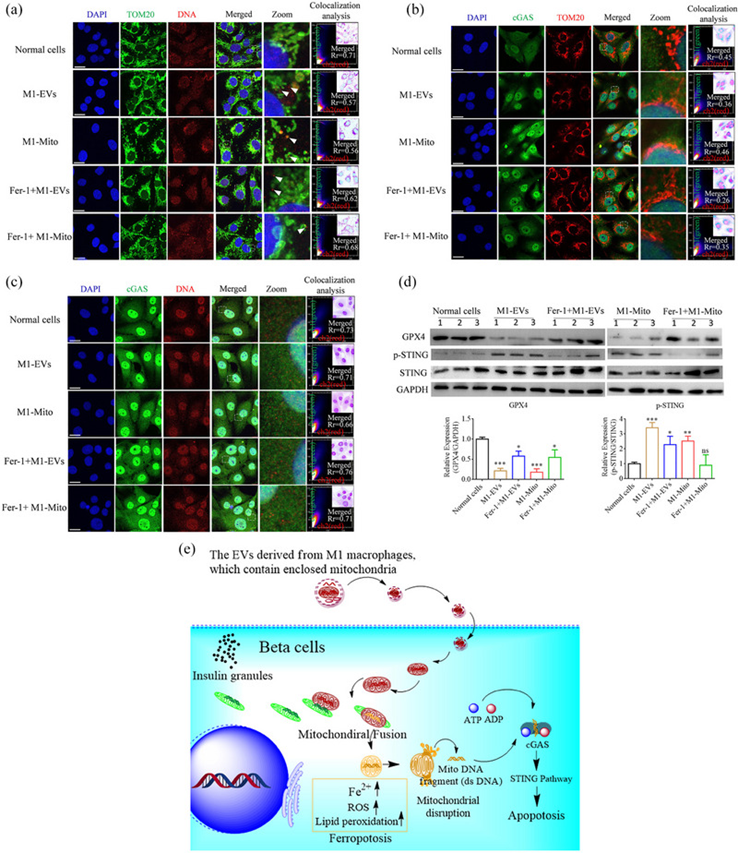
图7:各种处理后 β TC-6 细胞中的游离 mtDNA 激活 STING 通路
5 ADSC来源EVs的表面修饰
巨噬细胞表型从M1到M2的逆转是通过MSC分泌EVs实现的。因此,来源于ADSCs的EVs已被用于抵消巨噬细胞的促炎表型,从而在体外和体内防止胰腺β细胞的死亡。首先,鉴定了人ADSCs的生物学特性,包括特异性标记表达和多分化潜能。作者的结果表明,人ADSCs对CD29、CD90和CD105呈阳性,并且ADSCs成功分化为软骨细胞、脂肪细胞和成骨细胞。先前的报道已经表明,来源于MSCs的EVs携带某些miRNA和蛋白酶,这些miRNAs和蛋白酶可以逆转巨噬细胞从M1到M2的显性表型,并且用褪黑素预处理的MSCs分泌的EVs的逆转作用显著提高。在这项研究中,来自褪黑素预处理的ADSCs的EVs中,特异性miRNA(let-7b-5p和miR-24-3p)和蛋白酶(USP29)的水平显著升高,这促进了M2极化。这些EV在褪黑素处理前后的颗粒大小分布、球形和EV标记蛋白方面相似,并显著提高M1巨噬细胞中CD206阳性细胞的百分比。因此,在随后的实验中使用来源于褪黑素预处理的ADSCs的EV。为提高EVs在体内的递送效率,制备了活化巨噬细胞靶向ADSC衍生的EVs,并使用点击化学将抗F4/80抗体的大鼠单克隆抗体修饰在ADSC衍生EVs的表面上(称为F4/80 EVs,图8a)。分析了F4/80-EVs和正常EVs的生物学特性,数据显示形态、颗粒大小分布或电动汽车标记蛋白没有显著变化,正常EVs中的F4/80除外(图8b)。NF-kB是Rel家族成员的二聚体,由五种蛋白质组成。NF-kB(p65)和NF-kB1(p50)亚基的异二聚体是第一个被描述的NF-kB分子,在未刺激的细胞中被IkBα蛋白抑制。M1极化后,通过免疫荧光染色在巨噬细胞中检测p65和p50(图S12)。p50几乎进入细胞核,一些p65留在细胞质中。为检测F4/80-EVs对巨噬细胞极化的影响,作者对巨噬细胞进行体外免疫荧光染色和流式细胞术分析。这些分析旨在评估NF-kB1(p50)在细胞核中的表达,以及在相同实验条件下进行各种处理后巨噬细胞内iNOS和CD206的百分比变化。免疫荧光显示,在EV(图8c)和F4/80-EV(图8d)处理后,NF-kB1(p50)以浓度依赖的方式被有效地限制在细胞质中。使用FITC标记的NF-kB1(p50)和Cy5标记的IkBa来评估定位。最初在细胞核中观察到FITC荧光信号;然而,在与EVs孵育后,FITC信号与细胞质中的Cy5共定位。任意单细胞的荧光定量显示,在相同浓度下,F4/80-EV组的FITC信号比EV组少。使用流式细胞术分析M1巨噬细胞的标志物iNOS和M2巨噬细胞的标志器CD206的表达水平。结果显示,在相同浓度下,F4/80-EV组中CD206阳性细胞的百分比显著高于EV组(图8e)。炎症因子,白细胞介素(IL)−1β、肿瘤坏死因子(TNF)-α和IL-6,在M1巨噬细胞和细胞悬浮液的转录和分泌过程中都被鉴定。这是使用实时PCR和ELISA实现的。使用从免疫荧光和流式细胞术分析中获得的数据进一步验证了这些发现的准确性。这些数据表明,anit-F4/80抗体对EVs的表面修饰赋予了在体外将巨噬细胞表型从M1转化为M2的更好特性。
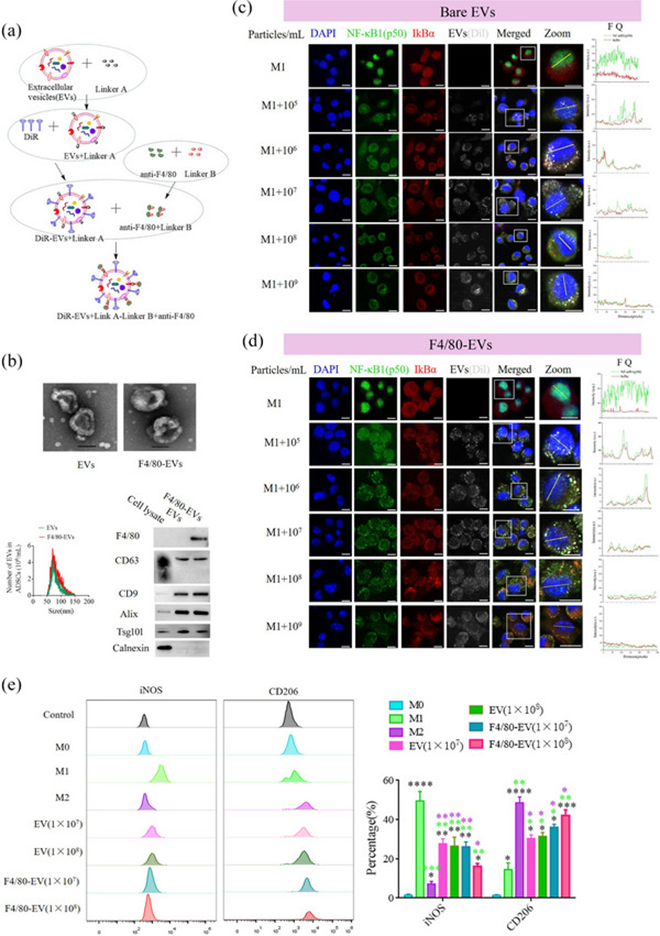
图8:ADSC来源的EV的表面修饰和体外转化巨噬细胞极化
6体内对巨噬细胞靶向传递F4/80-EVs及其对AP小鼠的治疗作用
为进一步验证胰腺中巨噬细胞对F4/80 EVs的F4/80介导的内吞作用,使用正常和AP小鼠通过每只小鼠腹膜内注射1×109个EVs或F4/80 EV颗粒来评估靶向递送。使用全身荧光成像来分析EV的位置。如图9a,b所示,EV处理后24小时,大多数荧光信号仍保留在正常小鼠的注射部位。相反,在EV处理的AP小鼠中,荧光信号扩散到腹部,胰腺显示出比用F4/80 EV处理的AP小鼠更强的荧光信号。接下来,采集这些小鼠的器官以评估EV在体内的分布。与正常小鼠相比,EVs和F4/80-EVs主要积聚在胰腺和脾脏,部分分布在AP小鼠的肠道、肾脏和肝脏(图9b)。F4/80-EVs在胰腺和脾脏中的荧光强度显着高于EVs(图9c)。接下来,作者使用激光扫描共聚焦显微镜检查了这些小鼠胰腺切片的荧光信号分布。结果与全身和器官成像结果非常一致。在EV和F4/80-EV处理后AP小鼠的胰腺中观察到荧光;然而,F4/80-EV组的荧光显著高于EV治疗组(图9d,e)。为验证F4/80 EVs在体内靶向巨噬细胞的递送,用Cy5标记的兔抗F4/80多克隆抗体用于定位胰腺切片中的巨噬细胞,用FITC标记的抗逆转录病毒抗体用于定位修饰EV表面的大鼠抗F4/80多克隆抗体。双阳性细胞表明巨噬细胞含有F4/80-EV,其随F4/80-EVs浓度的增加而增加。胰腺切片中的双阳性细胞逐渐增加,峰值为每只小鼠5×108和1×109个颗粒(图9f,g)。
为研究F4/80 EVs和EVs对巨噬细胞极化的影响及其在体内的治疗效果,基于先前的报告,作者通过5次腹膜内注射,间隔3天,向AP小鼠全身施用EVs。使用实时成像系统在治疗后24小时进行全身荧光成像(图10a)。随着F4/80-EV剂量的增加,荧光信号在胰腺和注射部位变得更加集中。糖耐受测试显示,所有EV治疗组均有显著改善。每只小鼠1×109个颗粒的F4/80-EV组在3周后首先恢复到正常水平,而每只小鼠5×108个颗粒的F4/80-EV和每只小鼠10×109个粒子的EV组在4周后恢复(图10b)。为进一步验证EV治疗的各组对炎症反应的抑制作用,使用ELISA评估血浆中炎症因子的水平,即IL-1β、TNF-α和IL-6。结果表明,炎症因子水平在EV处理后显著降低。值得注意的是,每只小鼠1×109个颗粒剂量的F4/80-EV组、每只小鼠5×108个颗粒F4/80-EV组和每只小鼠10×109个粒子的F4/8o-EV组表现出比每只小鼠50×108个粒子的EV组更好的疗效。此外,HOMA-β分析证实了上述发现。
接下来,作者使用抗iNOS和-CD206抗体分析了用EVs或F4/80EVS治疗2、3和4周后AP小鼠的巨噬细胞极化。结果表明,与其他组相比,在每只小鼠1×109个颗粒的F4/80-EV组中CD206阳性细胞百分比最高。此外,F4/80-EV组中CD206阳性细胞的百分比(每只小鼠5×108个颗粒)几乎等于EV组中每只小鼠1×109个颗粒的百分比(图10c-e)。与治疗效果一致,F4/80-EV组每只小鼠5×108个粒子,在体内将M1极化转化为M2极化,类似于EV组每每只小鼠1×109个粒子(图11)。
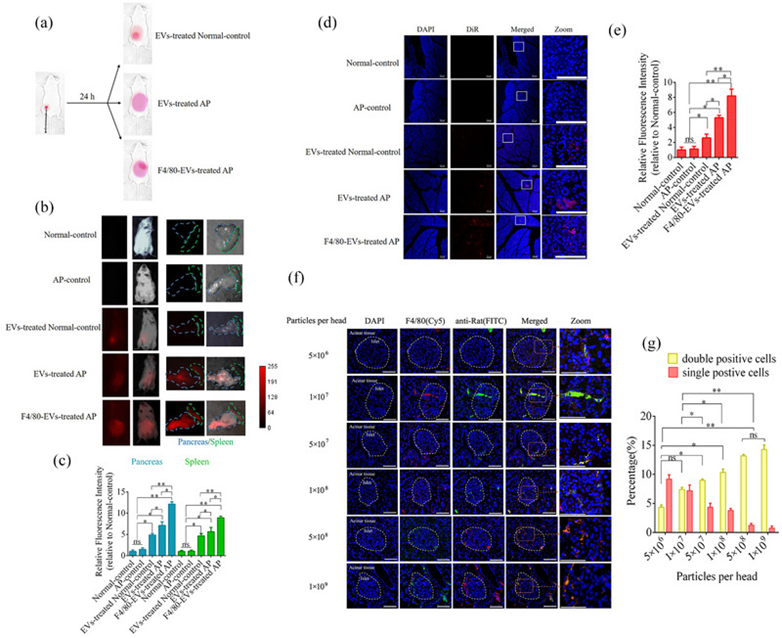
图9:体外F4/80-EV靶向递送至巨噬细胞
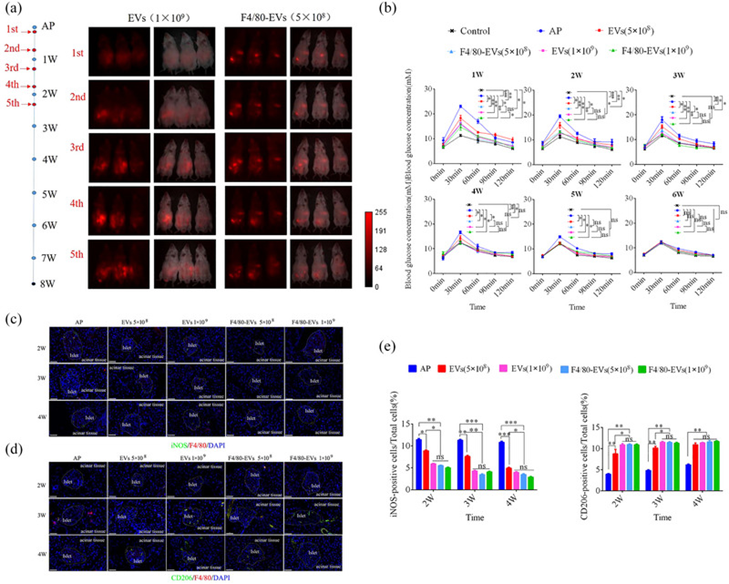
图10:AP小鼠中EVs和 F4/80‐EVs的治疗效果
结论:
总之,作者在小鼠模型中检测了PPDM的发病机制。该分析表明,来源于M1表型巨噬细胞的EVs具有将炎性线粒体转运到β细胞中并通过铁死亡和STING通路诱导β细胞死亡的能力。用抗F4/80抗体修饰ADSC分泌的EVs,用于靶向递送至体内巨噬细胞,用于AP的异常葡萄糖治疗。作者的研究结果进一步表明,M1表型巨噬细胞在β细胞衰竭和凋亡中发挥着重要作用,并且修饰的ADSC-EVs显示出相当大的潜力,可以作为PPDM靶向递送的载体。
实验方法:
细胞培养,葡萄糖耐受试验,细胞外囊泡分离,透射电镜,纳米粒子跟踪分析,免疫电镜,线粒体分离及转染,线粒体呼吸测试,免疫荧光
参考文献:
Gao Y, Mi N, Wu W, Zhao Y, Fan F, Liao W, Ming Y, Guan W, Bai C. Transfer of inflammatory mitochondria via extracellular vesicles from M1 macrophages induces ferroptosis of pancreatic beta cells in acute pancreatitis. J Extracell Vesicles. 2024 Feb;13(2):e12410. doi: 10.1002/jev2.12410. PMID: 38320981; PMCID: PMC10847061.






