药理激活GPX4可改善多柔比星诱发的心肌病
由于多柔比星(DOX)具有心脏毒性,其临床应用受到限制。过量亚铁引起的脂质过氧化被认为是 DOX 诱导的心肌病(DIC)的关键分子机制。单核RNA 测序(snRNA-seq)分析发现了易受 DOX 诱导的铁死亡影响的心肌细胞和上皮细胞。谷胱甘肽过氧化物酶 4(GPX4)激活剂硒甲硫氨酸(SeMet)能显著降低体外多不饱和脂肪酸(PUFA)和氧化脂质水平。SeMet 能明显降低 DOX 诱导的H9C2 细胞脂质过氧化反应和 C57BL/6 小鼠的死亡率。值得注意的是,SeMet 能在使用DOX的乳腺癌模型中发挥抗肿瘤作用,同时还能为同一动物提供心脏保护,且不会产生可检测到的毒性。这些发现表明,药理激活 GPX4 是预防多柔比星心脏毒性的一种有价值、有前景的策略。该研究于2024年1月发表在《Redox Biology》,IF:11.4。
技术路线:
主要研究结果:
1. DIC中心肌细胞的单细胞特征
对DOX治疗小鼠(DOX 20 mg/kg,n = 3)和未治疗小鼠(n = 3)的心脏样本进行单核RNA测序(snRNA-seq)(图1a)。通过无偏聚类分析确定并可视化了 32 个聚类,其中包括 12 种不同的细胞类型(图 1b)。通过检测心肌细胞(Ryr2、Trdn、Myh7、Myh6、Ttn)、成纤维细胞(Pdgfra、Ckap4、Col1a1)、内皮细胞(Pec1a1、Pec2a1、Pec3a1、Pec4a1、Pec5a1、Pec6a1、Pec7a1、Pec6a1、Ttn)中已知品系标志物的表达,确定了五个非免疫性心脏细胞群、 内皮细胞(Pecam1、Vwf、Cdh5、Cd93、Ldb2、Tie1)、脂肪细胞(Plin1、Pparg、Adam12)、平滑肌细胞(Acta2、Tagln、Myh11)、上皮细胞(Wt1、Tbx18、Krt18、Msln)和周细胞(Pdprb)(图 1c)。与 DOX 相关的心脏毒性研究大多基于心肌细胞。通过无监督降维和聚类确定了四个表现出不同基因表达谱的心肌细胞亚群(图 1c)。
比较两组心肌细胞的转录谱和通路富集情况,发现在 DOX 治疗后,肥厚型心肌病、扩张型心肌病、心肌细胞中的肾上腺素能信号转导、心肌收缩、致心律失常性右室心肌病和铁蛋白沉积通路显著富集(图 2a)。进一步检测之前报道过的与铁死亡相关基因的表达水平,证实经 DOX 处理后,与铁死亡相关的基因如 Gclm(谷氨酸-半胱氨酸连接酶修饰亚基)、Fth1(铁蛋白重链 1)、Hmox1(血红素加氧酶-1)、Slc39a14(溶质运载家族 39 成员 14)、Ftl1(铁蛋白轻多肽 1)、Nqo1(NAD(P)H醌氧化还原酶 1)、Cp(脑磷脂蛋白)、Slc39a8(溶质运载家族39成员8)、Map1lc3b(微管相关蛋白1轻链3 beta)和Ncoa4(核受体辅激活剂4)在心肌细胞和上皮细胞中显著上调(图 2b-g)。综上所述,snRNA-seq 分析确定心肌细胞和上皮细胞是导致 DOX 诱导的铁死亡的主要特异性细胞类型。
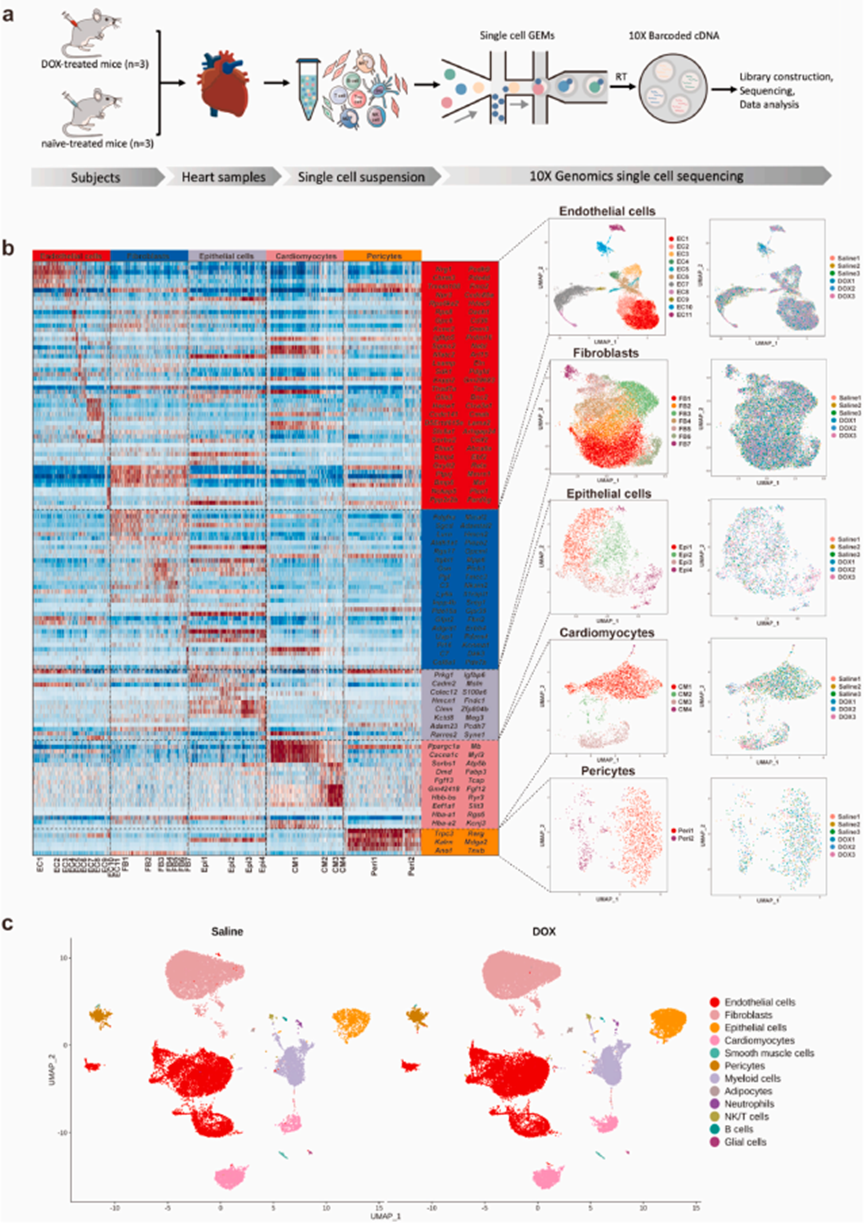
图1. 多柔比星治疗期间心肌细胞的单核表达
2. SeMet通过抑制脂质过氧化改善DIC
谷胱甘肽过氧化物酶 4(GPX4)是一种硒蛋白,它通过抑制不饱和脂肪的过氧化作用而在铁跃迁过程中发挥关键作用,补硒可提高 GPX4 的活性。假设药物激活 GPX4 可预防 DOX 引起的心脏损伤。测试5 种硒化合物,发现在急性 DOX 模型中,硒蛋氨酸(SeMet)对 DIC 的保护作用最强(图 2h)。与单用 DOX 14 天无存活率相比,补充 SeMet 可使存活率提高 60%(图 2h)。用较低剂量的 DOX(15 毫克/千克)进行存活实验。值得注意的是,各组之间存在显著差异,这表明 DIC 涉及铁死亡,而 SeMet 比铁前列素-1 和 DXZ 具有更好的心脏保护作用(图 2i)。此外,SeMet 能显著抑制 DOX 诱导的血液中心脏生物标志物的增加(图 2j)。进一步评估补充 SeMet 是否能减轻 DOX 诱导的 H9C2 细胞铁死亡反应。在H9C2细胞模型中,铁死亡抑制剂ferrostatin-1可挽救 DOX 诱导的细胞死亡。同样,SeMet可以减少 DOX 诱导的 H9C2 细胞死亡和脂质过氧化(图 2k-m)。
为进一步探索 SeMet 抑制脂质过氧化的机制,评估作为过氧化底物的 PUFAs 的水平。与药物对照组相比,补充 SeMet 能明显降低 H9C2 心肌细胞中七种 PUFAs(C18:3N6、C20:3N6、C20:4、C22:4、C22:5N3)的水平(图 2n-q)。DIC 导致扩张型心肌病和心力衰竭。DIC 可导致扩张型心肌病和心力衰竭。停止使用 DOX 后,心室功能趋于正常,左室射血分数(EF)和缩短分数(FS)是评估 DOX 心脏毒性的最佳参数。根据 DOX 治疗四周后测量的心脏收缩功能,在另一个模型中持续观察到了心脏保护作用(图 3a-d)。值得注意的是,SeMet治疗还能显著阻止小鼠心脏组织在DOX给药后的纤维化(图3e和f)。在本报告中发现 SeMet 处理对线粒体功能和呼吸链复合物细胞通路有广泛影响(图 3g)。此外,与载体处理相比,DOX 处理会导致更多的 JC-1 单体,而补充 SeMet 则会显著降低这种 DOX 诱导的效应(图 3h)。总之,这些结果表明,SeMet 有可能抑制 DOX 诱导的铁死亡并改善 DOX 诱导的心肌病。

图2. 铁死亡与DOX诱导的心脏毒性相关
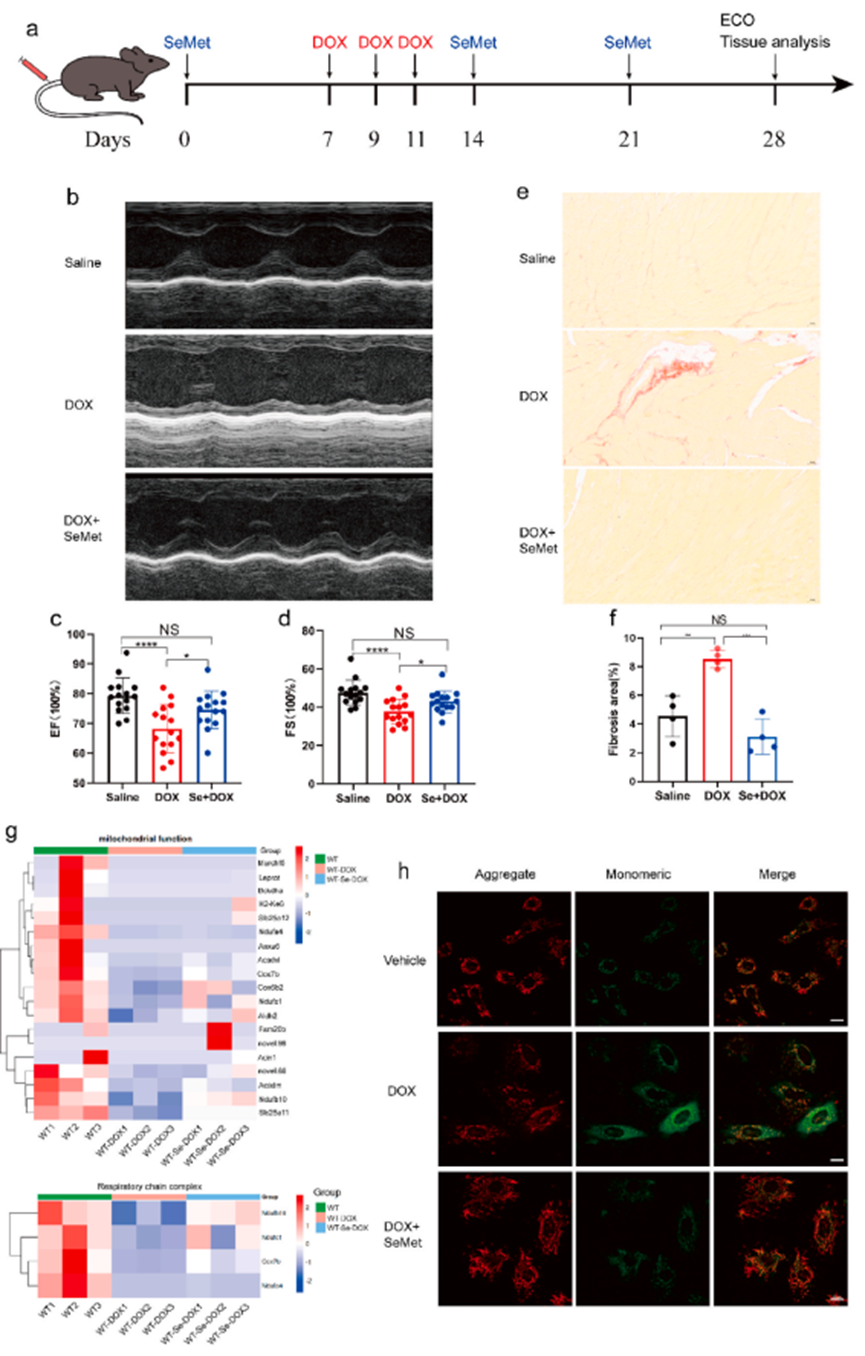
图3. GPX4的药理激活保护小鼠免受DOX诱导的心脏毒性
3. SeMet的保护作用依赖于GPX4
为研究 SeMet 对心脏的保护作用是否依赖于 GPX4,产生杂合子 GPX4 基因敲除(GPX4hetko)小鼠,以评估 GPX4 对小鼠心脏形态学、心脏功能和电生理学的影响。与 GPX4wt 小鼠相比,杂合消融 GPX4 对心脏形态和功能(包括 EF 和 FS)的影响微乎其微(图 4a-d)。
为进一步验证 SeMet 是否以 GPX4 依赖性方式降低 DOX 诱导的心脏毒性,给雄性野生型小鼠和 GPX4hetko 小鼠注射单次高剂量 DOX。存活率分析表明,与对照组相比,GPX4 激活剂 SeMet 的预处理显著降低DOX 诱导的死亡率,而这种效应依赖于 GPX4 的表达(图 4e)。为证实 GPX4 在维持小鼠心脏组织脂质代谢平衡中的作用,进行非靶向脂质体分析以确定 GPX4wt 和 GPX4hetko 小鼠心脏组织中不同的代谢物。代谢组学分析清楚地将 GPX4hetko 样品与 WT 样品区分开来,表明 GPX4 缺乏导致心脏脂质代谢发生了全面变化(图 4f)。脂质组学分析显示,GPX4缺乏显著增加了52种PUFA的水平,包括PC (17:0_20:4), PC (17:0_22:6), PC (18:2_20:4), PC (19:1_18:2), PC (19:1_22:6), PC (40:7e), PE (14:1e_18:2), PE (18:1_20:2), PI (17:0_20:4), PI (18:0_18:2), PI (18:0_20:4), PG(20:3-20:4),神经酰胺和甘油三酯(图4 g- n)。综上所述,SeMet是GPX4的激活剂,介导心脏内PUFA水平,并在GPX4存在的情况下具有抑制DIC的能力。
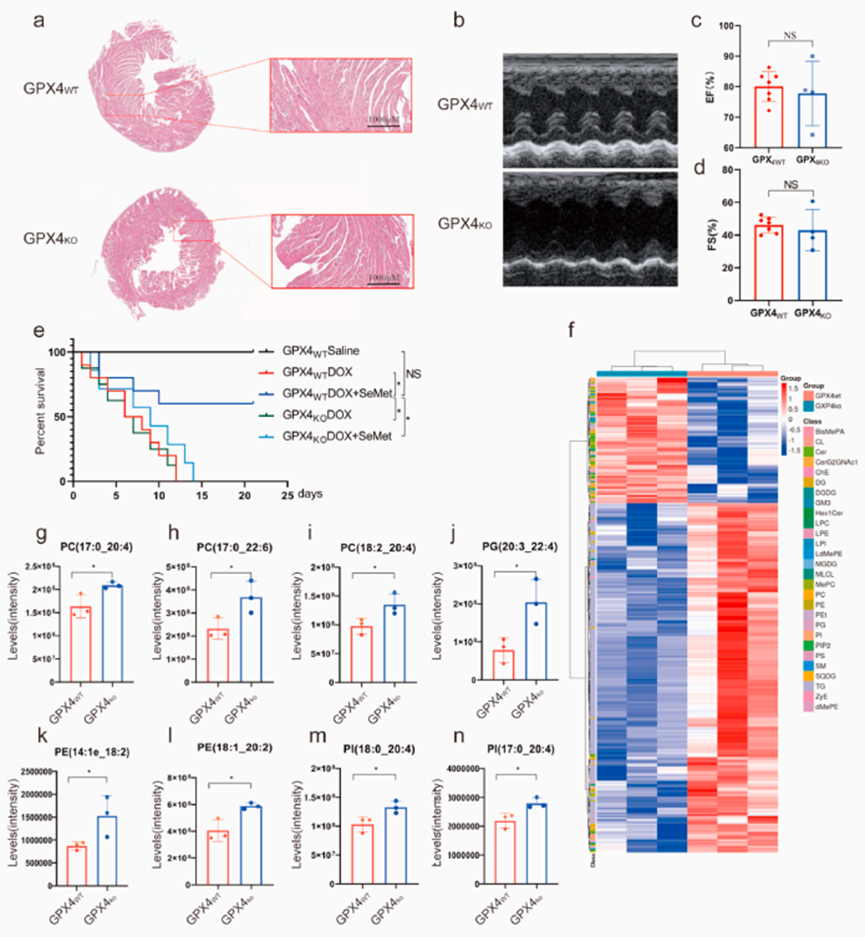
图4. SeMet的心脏保护作用依赖于GPX4
4. SeMet不影响DOX的化疗效果
从理论上讲,预防 DIC 的理想药物不应影响 DOX 的抗肿瘤疗效。在 4T1 乳腺癌细胞模型中,SeMet 和 DOX 的联合用药在体内表现出良好的抗肿瘤效果(图 5a)。SeMet 不会降低 DOX 和顺铂的抗肿瘤效率,与单独使用 SeMet 或 DOX 相比,SeMet 和 DOX 的联合疗法取得了更好的抗肿瘤效果(图 5b)。总之,这些数据表明,SeMet 可以预防心肌病,而不会影响 DOX 的抗肿瘤疗效和其他不良反应。
5. SeMet减少乳腺癌患者的心肌酶
使用一种富含硒(Se)的牡蛎蘑菇作为补充 Se 的资源。经电感耦合等离子体质谱法(ICP-MS)证实,这种蘑菇中硒的主要形式是SeMet。使用根据 SeMet 计算出的不同浓度的富含硒的杏鲍菇,以达到有效剂量范围,从而防止 DIC。与之前的结果(图 2h)一致,蘑菇中 1.5 mg/kg SeMet 的保护效果最高(图 5c)。使用富含 Se 的杏鲍菇片和作为安慰剂的杏鲍菇片进行了一项探索性试验(ChiCTR2200056796)。在临床试验中,根据人鼠转换率,Se 的剂量为 300 微克/天。6 名乳腺癌 II 期术后患者参加了研究,并随机接受安慰剂(杏鲍菇片,n = 3)或富含 Se 的杏鲍菇片(每天 300 μg SeMet)(n = 3)(图 6a)。所有入选患者在手术前均未接受化疗或放疗,而是接受了四个周期的 AC 方案(剂量为 60 毫克/平方米的多柔比星和剂量为 600 毫克/平方米的环磷酰胺)作为辅助治疗。在开始化疗前 3 天,患者开始服用为期 7 天的富含硒的杏鲍菇片/安慰剂。化疗后第二和第三天检测心肌酶水平。靶向代谢分析表明,富含 Se 的杏鲍菇在第二次 AC 治疗后降低 12-HEPE、14-HDHA 和 13-HODE 的水平,但安慰剂组和 Se 补充剂组之间没有显著差异(图 6b)。值得注意的是,服用富含 Se 的杏鲍菇能有效降低心脏损伤的血清标志物,包括 CK-MB 和 MYO(图 6c)。有趣的是,与之前的研究一致,补充 Se 有减少化疗后血小板和血红蛋白下降的趋势(图 6d)。
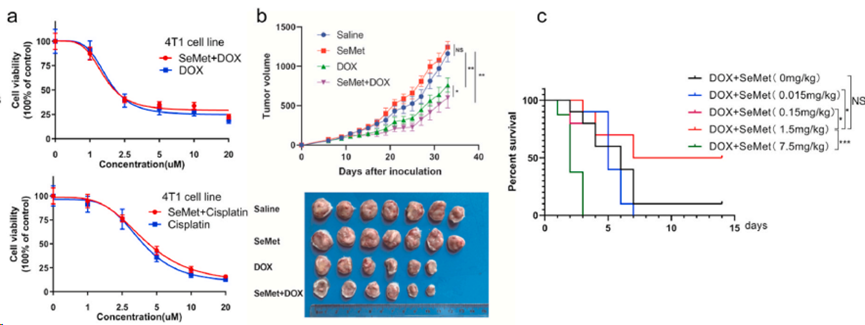
图5. SeMet增强DOX的抗肿瘤活性
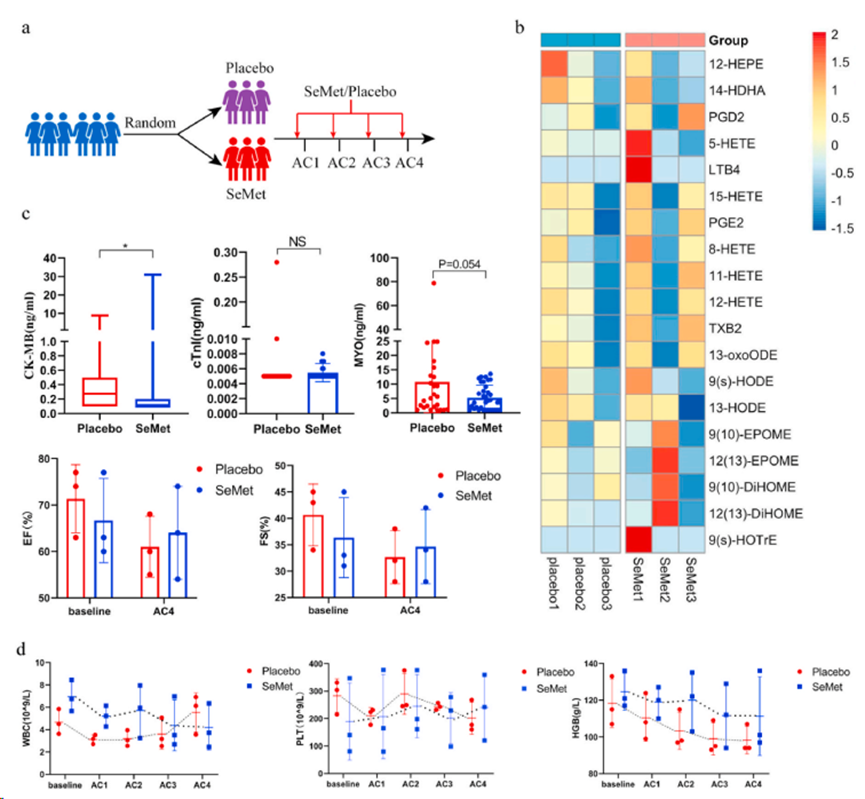
图6. SeMet减少乳腺癌患者的心肌酶
结论
综上所述,本研究发现SeMet能以GPX4依赖性方式抑制DOX诱导的铁死亡,而且不会影响化疗的疗效。这种制剂可能是一种很有前景的预防 DIC 的治疗方法。
实验方法:
体内多柔比星治疗,小鼠心功能超声心动图,小鼠心电图,小鼠电生理学,4T1乳腺癌异种移植小鼠模型,细胞培养,细胞活力测定,共聚焦成像,线粒体膜电位分析(ΔΨm),转录组分析,单细胞去核和单核(snRNA)-seq文库制备,单核RNA测序数据处理,血清cTnT、CK-MB和MYO活性测定,组织学和免疫组化,免疫荧光,脂质体分析
参考文献
Huang C, Guo Y, Li T, Sun G, Yang J, Wang Y, Xiang Y, Wang L, Jin M, Li J, Zhou Y, Han B, Huang R, Qiu J, Tan Y, Hu J, Wei Y, Wu B, Mao Y, Lei L, Song X, Li S, Wang Y, Zhang T. Pharmacological activation of GPX4 ameliorates doxorubicin-induced cardiomyopathy. Redox Biol. 2024 Apr;70:103024. doi: 10.1016/j.redox.2023.103024. Epub 2024 Jan 10. PMID: 38232458; PMCID: PMC10827549.






