单细胞RNA测序解析子宫肌腺病的病理机制
本研究旨在利用scRNA-seq评估子宫腺肌症的细胞和分子状况。结果发现子宫腺肌症组织中的成纤维细胞具有高度异质性。在子宫腺肌症成纤维细胞中,WNT 信号涉及作为 WNTs 诱饵受体的分泌型相关蛋白的不同表达,这可能在该疾病的病理生理学中起着关键作用。本文于2023年5月发表在《Fertility and Sterility》IF:6.7杂志上。
技术路线:

主要实验结果:
1、子宫内膜:一个包含成纤维细胞和免疫细胞群的丰富复杂细胞景观
从患有子宫肌腺病需行子宫切除术的子宫中收集子宫肌腺症病理组织(AD)和临近的正常子宫内膜组织(EE),以及正常的子宫肌层组织(NM)(图1A)。scRNA测序在EE共鉴定到21个细胞簇注释为12种细胞类型:纤毛上皮细胞和纤毛上皮细胞、内皮细胞、成纤维细胞样细胞、活化成纤维细胞、周细胞、血管平滑肌细胞、NK细胞、T细胞、B细胞、巨噬细胞、单核细胞和潜在祖细胞(图1B)。每种细胞类型的前几个标记物的表达见图1C。无纤毛上皮细胞分为三组(E2、E17、E19),占子宫内膜的11%。上皮细胞的典型标记包括EPCAM、PAEP、MMP7和KRT18。还发现了一个纤毛上皮细胞集群,它表达纤毛相关基因(C14),如RSPH1、AGR3 和PIFO;最近一项对正常子宫内膜进行 scRNA-seq 的研究描述了这种细胞类型(图 1B-D)。免疫细胞占子宫内膜的 24%。主要的免疫细胞是表达NKG7和GNLY 的NK细胞(7%)和表达CD3D和CD69 的 T 细胞(12%)(图 1B-D)。成纤维样细胞占子宫内膜的绝大部分(36%),它们表达胶原和基质相关基因(图 1B-D)。在比较 3 位患者的子宫内膜组织时,发现所有 3 种组织都含有大多数细胞群,但含量各不相同(图 1E)。成纤维细胞群 E0 和 E1 具有相似的基因表达谱,都表达SFRP4、COL1A1、LUM、MMP11、SFRP1、ECM1 和IGF1(图 1F)。特征图还显示,这两个群还表达子宫内膜基质成纤维细胞表达的MME、ESR1 和PGR(图 1G)。
一个与成纤维细胞密切相关的独特细胞群(E7)显示了周细胞标志物COX4I2、MCAM、NOTCH3 和PDGFRB 的独特表达。与E7相连的是表达MYL9、TINAGL、BCAM、MYH11、MYLK和ACTA2等标记的血管平滑肌细胞群(E6)(图1F)。由于在周细胞中持续检测到干/祖细胞类型,所以作者从E7群开始进行了拟时序分析(图1F)。耐人寻味的是,从周细胞开始的分化轨迹经过E0和E1的成纤维细胞样细胞,然后经过活跃分化的成纤维细胞样细胞(E13),最后到达纤毛上皮(E14;图1H)。因此,结果表明,成纤维细胞样细胞可能起源于具有间充质干细胞特征的周细胞。
数据还表明纤毛上皮细胞可能通过间质-上皮转化(MET)从周细胞衍生而来。对这一MET轨迹的PROGENy分析表明,在分化的成纤维细胞样细胞(E13)和纤毛上皮细胞群(E14)中,PI3K和P53这两种不同的信号通路分别上调(图1I)。
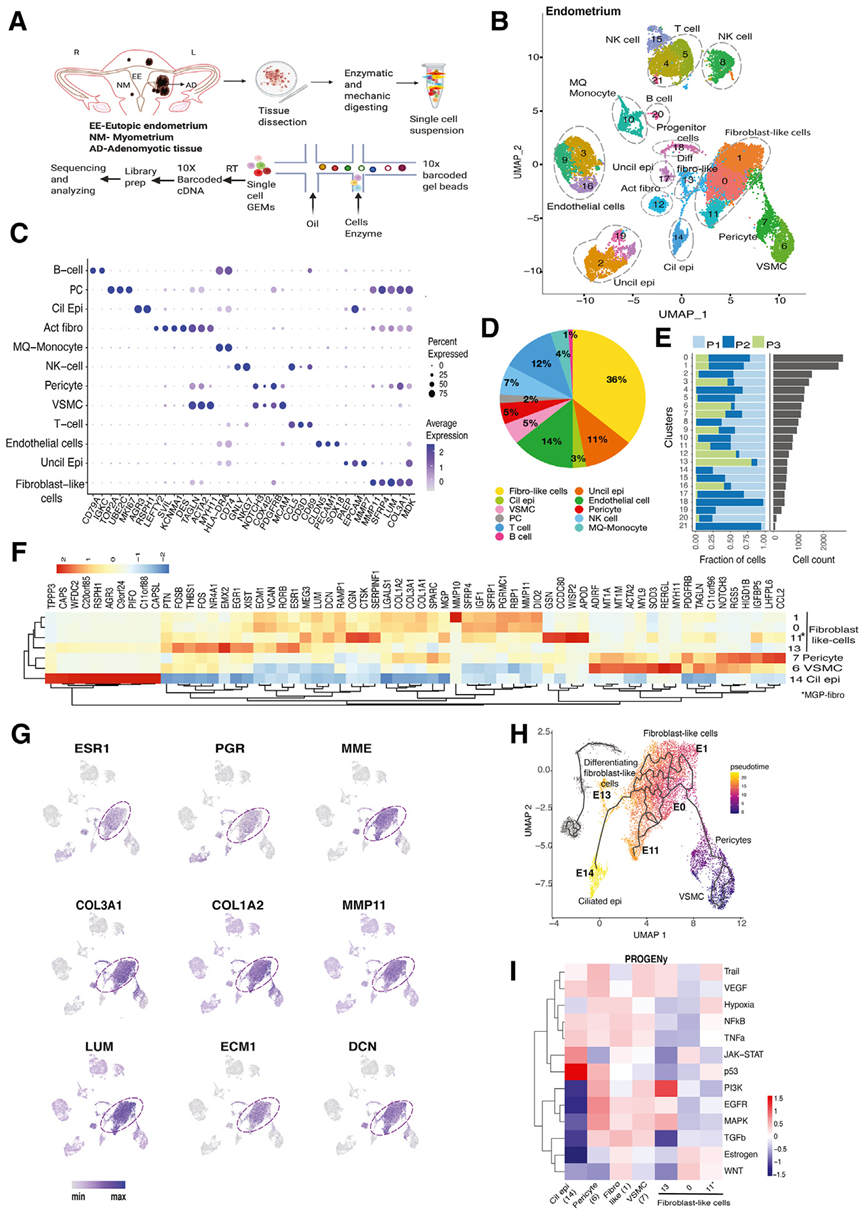
图1 子宫内膜单细胞转录组学分析
2、子宫肌腺症以纤维化和高度异质性的成纤维细胞群为主
scRNA测序在AD共鉴定到24个细胞簇注释为13种细胞类型(图2A)。与EE比较,AD组织具有更高的成纤维细胞组分(50%)和更低的上皮细胞组分(图2B)。图 2C和2D显示了每位患者每个细胞亚群的相对比例以及每种细胞类型的基因标记物。成纤维细胞样群 A0、A6、A5、A1 和 A12 显示出转录组的相似性,并代表了一个不同于 A2 和 A4 的群体,前者独特地富集了平滑肌细胞标记物,而后者则具有细胞外基质相关基因的强烈特征(图 2E)。在 A0 中,PROGENy 显示 MAPK 和表皮生长因子受体通路的激活,这两种通路都与细胞增殖有关(图 2H)。相邻的 A6 簇高表达PDGFRA、COL6A3、MME、ESR1、RORB和HAND2,它们是间充质祖细胞和子宫内膜基质细胞的经典标记(图 2E)。A6 中表达了PDGFRA和ESR1基因,表明间质细胞在雌激素的驱动下增殖和分化活跃。有趣的是,A6 的ESR1表达量最高,表明其对雌激素具有高度敏感性,而 A12 和 A5 的PGR表达量最高(图 2F)。这种ESR1/PGR表达的进展模式与拟时序分析显示的分化方向一致,即 A0→A6→A12→A5(图 2F、2G)。
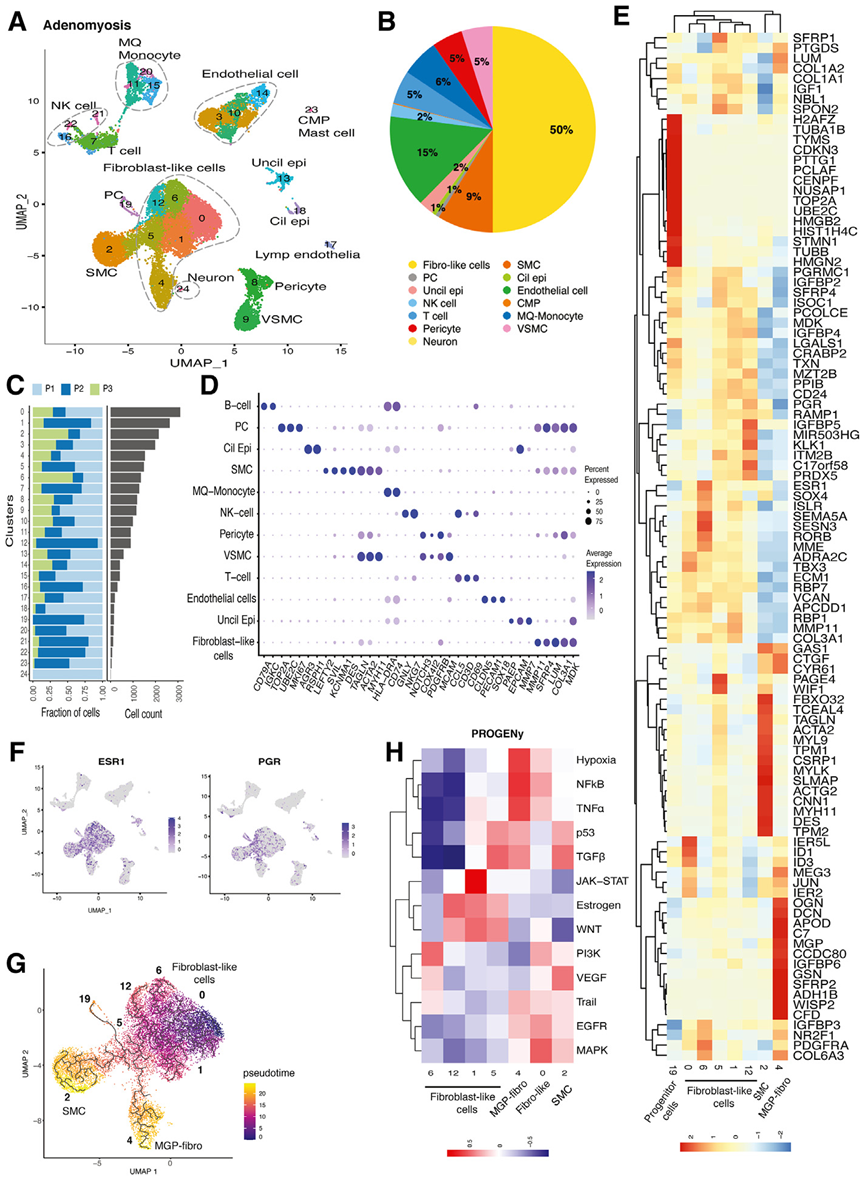
图2 子宫腺肌病组织的单细胞转录组学分析
3、子宫肌层:成纤维细胞集群形成了一个有别于平滑肌细胞集群的群体
在子宫肌层中鉴定到20个亚群包含10种细胞类型。与EE和AD一样,子宫肌层中的主要细胞类型是成纤维细胞样细胞团(40%),其次是 SMC(18%)。
4、子宫腺肌症、子宫内膜和子宫肌层中成纤维细胞群的比较分析
接下来,作者评估了区分子宫腺肌病与子宫内膜和子宫肌层的成纤维细胞群的不同基因表达模式(图 3A、3B)。在子宫腺肌病和子宫内膜的成纤维细胞样群中,最引人注目的观察结果是 A0 与 E0 和 E1 子宫内膜成纤维细胞非常相似(图 3A)。这表明 A0 成纤维细胞代表了一个从子宫内膜迁移到子宫肌层组织并导致子宫腺肌症的群体(图 1,图 2A)。拟时序分析表明,A0、E0 和 E1 都具有类似祖细胞的特征,分化程度较高的成纤维细胞就来源于这些祖细胞(图 1,图 2G)。
当对AD和子宫肌层成纤维细胞群进行比较时(图 3B),A4 与 M0 和 M11 显示出惊人的相似性,它们都表达了最高水平的 MGP,似乎代表了每个组织中成纤维细胞样群的终末分化群体(图 2G)。MGP 是细胞外基质的结构成分,这种发现与所观察到的腺肌瘤组织中细胞外基质的增加相吻合。
耐人寻味的是,作为 WNT 通路调节剂的 SFRP 基因家族在成纤维细胞样集群中表达突出,显示出子宫内膜、子宫腺肌病和子宫肌层之间的跨组织相似性(图 3A、3B)。因此,作者首先测定了该基因家族成员在这三种组织中的差异表达(图 3C)。腺肌病中SFRP1和SFRP4的水平均高于子宫内膜或子宫肌层(图3C)。基因SFRP2仅在子宫腺肌病和子宫肌层中表达(A4,M11;图 3A-C)。据报道,SFRP2 是一种 WNT 拮抗剂,能下调雌激素依赖的 β-catenin 活性,抑制细胞生长并促进肌生成。子宫内膜中缺乏SFRP2的表达可能会导致上皮细胞的生长和侵袭。因此,SFRP2可能是预测子宫腺肌病上皮细胞生长潜力的关键标志物。有趣的是,SFRP1和SFRP4在子宫腺肌病的所有成纤维细胞样团中都有表达,而SFRP2仅在 A4 中表达(图 3D)。
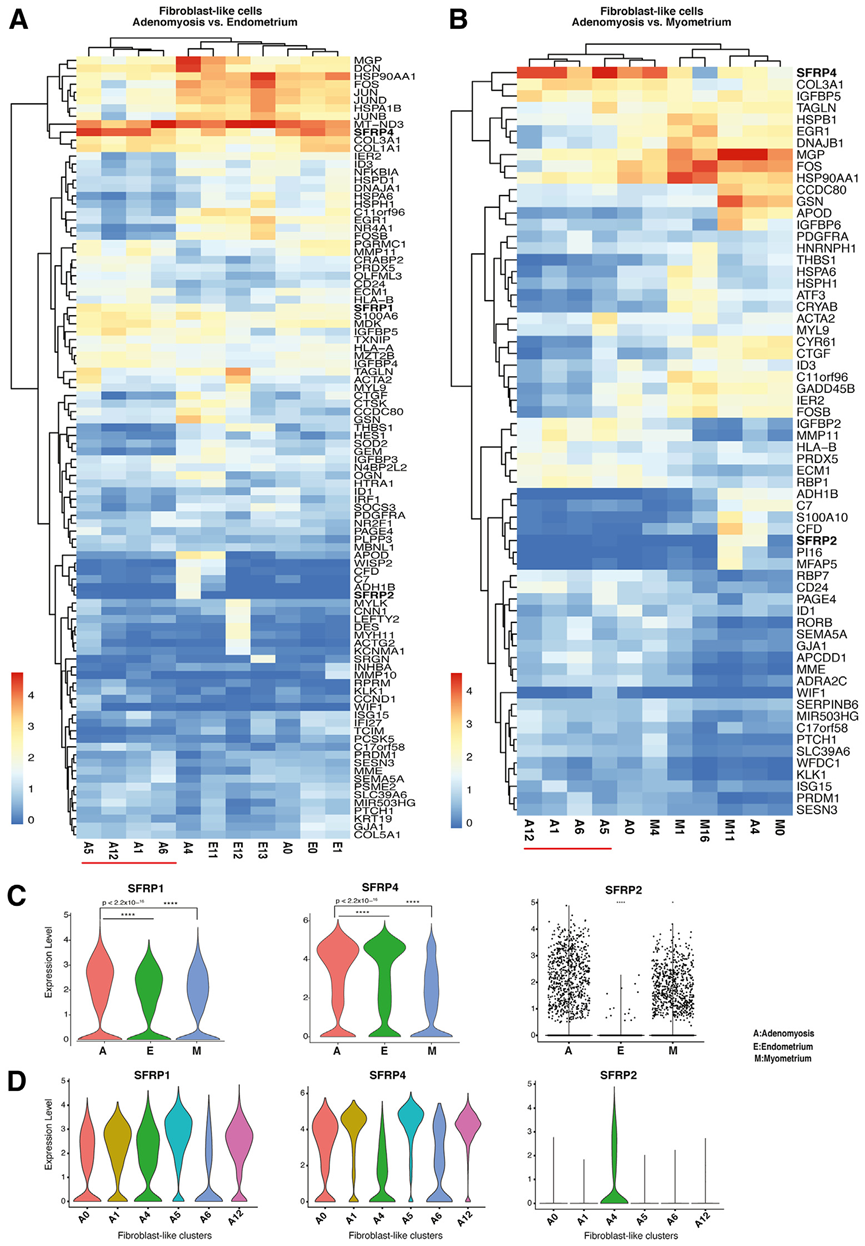
图3 3种组织类型成纤维细胞群体差异基因表达的比较分析
5、子宫内膜和子宫腺肌病中的纤毛和无纤毛上皮细胞群分析
上皮是子宫腺肌症的主要细胞类型,而子宫腺肌症被认为起源于子宫内膜。因此,作者进一步分析了匹配的AD组织和EE上皮细胞中的差异表达基因。首先,使用散点图分析来确定组织中的纤毛上皮细胞和无纤毛上皮细胞(图 4A)。不出所料,PAEP和MMP7 等经典标志物在无纤毛上皮细胞中的表达量明显较高,而更多的基因在纤毛上皮细胞中显著表达(图 4A)。然后,分别鉴定了子宫腺肌病和子宫内膜中无纤毛上皮细胞和纤毛上皮细胞的差异表达基因(图 4B、4C)。一般来说,腺肌症组织和子宫内膜中的无纤毛上皮和纤毛上皮表现出相似的转录组特征。然而,在子宫内膜的无纤毛上皮中,一些基因的表达明显高于子宫内膜,包括分化标记物,如PAEP、PLCG2、HSPA1A 和HSP90AA1(图 4B)。PAEP 标志物又称糖度蛋白,是一种分泌性糖蛋白,受孕酮调控,与分化和健康植入有关。这一发现可能表明,子宫腺肌症无纤毛上皮细胞中存在孕酮抗性。在无纤毛和纤毛上皮细胞中,腺肌病患者热休克蛋白(HSPA1A、HSP90AA1)的表达明显低于子宫内膜(图 4B、4C)。由于某些热休克蛋白对雌激素的作用很重要,而雌激素在子宫腺肌病中似乎也有作用,因此这一发现需要进一步研究。
与子宫内膜相比,子宫腺肌病无纤毛上皮细胞中与免疫功能相关的基因和通路上调(图 4B、4D)。与免疫反应和巨噬细胞活化相关的基因,如HLA-DRA、HLA-DRB1、CD74、NFKBIA 和S100A6,在子宫腺肌症上皮细胞中的表达明显升高(图 4B)。这些基因也与细胞增殖、炎症和细胞运动有关。在腺肌病的上调途径中,免疫反应相关过程在腺肌病的纤毛上皮和无纤毛上皮中明显上调(图 4D)。此外,参与典型 WNT 信号通路和上皮细胞迁移调控通路的基因仅在腺肌病无纤毛上皮中上调。
在本研究中,WNT 信号转导成为基质、上皮和 SMC 中受到不同调控的一个重要生物过程;因此,进一步分析腺肌症组织中所有细胞类型之间的旁分泌和内分泌 WNT 相关相互作用(图4E)。WNT信号网络分析发现了多种信号,分别来自成纤维细胞群 A0、A1、A5 和 A12,以及上皮细胞和内皮细胞群 A10、A13、A14 和 A18(图 4E)。配体(WNT)及其受体(FZD和LRP)在各细胞簇中的表达分布支持了基质细胞向内皮细胞和上皮细胞发出信号的方向性(图 4F)。特别是,WNT2和WNT4在腺肌病特异性成纤维细胞样簇中表达突出,如 A0、A1、A5 和 A12(图 4F;图3)。在内皮细胞或上皮细胞中表达的最主要的WNT受体是FZD6和LRP6。总之,scRNA-seq 分析发现了子宫内膜和子宫腺肌症中各种成纤维细胞群的重要作用,它们似乎通过向内皮细胞和上皮细胞传递 WNT 信号,在子宫腺肌症的病理生理学中发挥着核心作用。
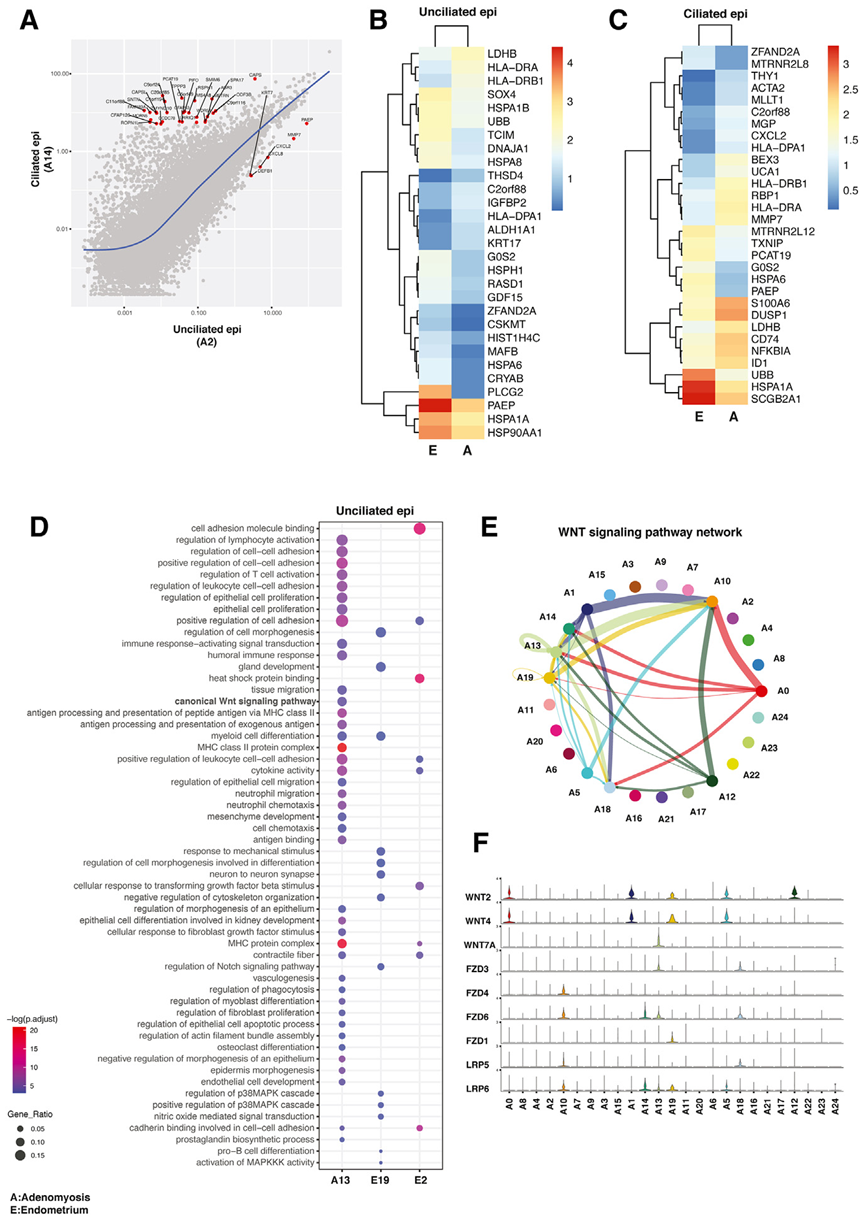
图4 子宫腺肌病和子宫内膜上皮细胞谱分析
实验方法:
患者信息和临床样本采集,scRNA测序及生物信息学分析
参考文献:
Yildiz S, Kinali M, Wei JJ, Milad M, Yin P, Adli M, Bulun SE. Adenomyosis: single-cell transcriptomic analysis reveals a paracrine mesenchymal-epithelial interaction involving the WNT/SFRP pathway. Fertil Steril. 2023 May;119(5):869-882. doi: 10.1016/j.fertnstert.2023.01.041. Epub 2023 Feb 1. PMID: 36736810.






