熊果苷通过FTO/SLC7A11通路抑制铁死亡减轻脂肪肝
非酒精性脂肪肝(NAFLD)是一种潜在的严重疾病,影响着全球30%的人口,对人类健康构成重大威胁。然而,迄今为止还没有安全、有效和适当的治疗方法。近年来,铁死亡已成为一种重要的细胞死亡模式,并被发现在非酒精性脂肪肝的发展过程中起着关键的调节作用。在这项研究中,作者发现一种从熊果树中提取的天然抗氧化剂——熊果苷(ARB),能在体内和体外抑制铁突变的发生并改善高脂饮食诱导的非酒精性脂肪肝。通过反向对接,作者发现去甲基化酶脂肪量和肥胖相关蛋白(FTO)是ARB的潜在靶点。随后的机理研究发现,ARB通过抑制FTO来控制SLC7A11基因甲基化。此外,作者还证明了SLC7A11可以缓解非酒精性脂肪肝在体内和体外的发展,FTO/SLC7A11轴是治疗非酒精性脂肪肝的潜在治疗靶点。具体而言,作者发现ARB可通过作用于FTO/SLC7A11通路抑制铁死亡,从而缓解非酒精性脂肪肝。该研究为非酒精性脂肪肝的治疗提供了一种新的方法和理论基础。本文于2023年12月发表在《Redox Biology》,IF:11.4。
技术路线:
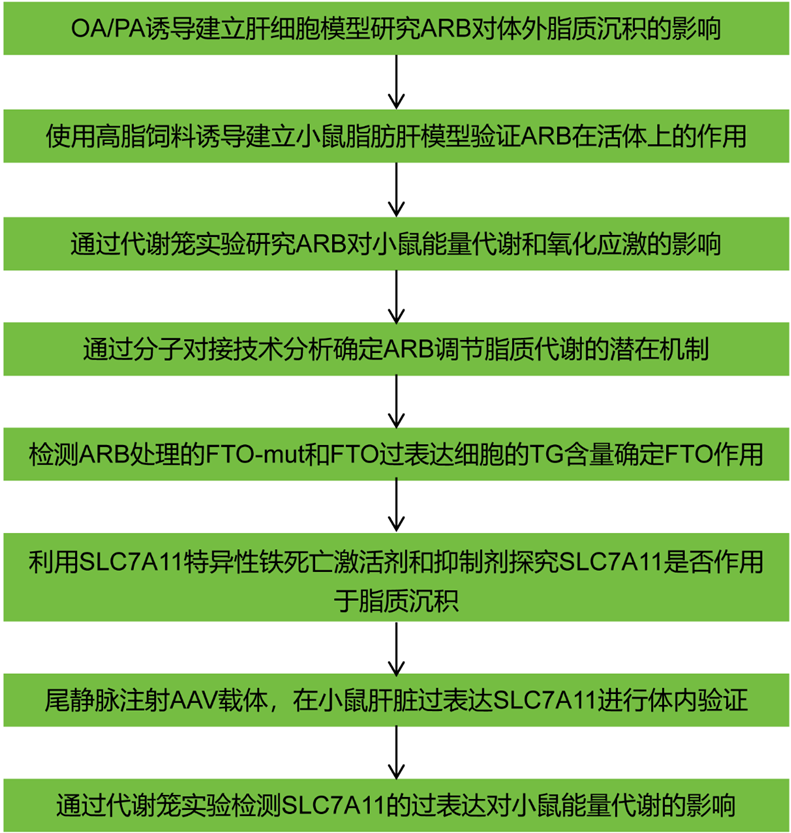
主要实验结果:
1.ARB调节细胞内脂质沉积
ARB提取自熊果的叶子,其分子式如图1A所示。在本研究中,作者通过油酸和棕榈酸(OA/PA)处理HepG2细胞建立了脂质沉积的细胞模型。首先,作者使用CCK-8和划痕实验检测ARB对细胞活力的影响。我们发现ARB在浓度高达100μM时对HepG2细胞活力没有影响(图1B),且ARB可以降低HepG2细胞内TG水平,在75μM时效果更明显(图1C)。类似地,ARB对3T3-L1细胞的细胞活力无影响,并降低了细胞内TG水平(图1)基于这些结果,作者在后续实验中使用了浓度为75μM的ARB。ARB可增加细胞外TG水平,并显著降低细胞内和细胞外TC水平(图1D-F)。油红O染色显示,与OA/PA处理的细胞相比,ARB处理OA/PA处理的HepG2细胞可显著减少细胞内脂滴聚集(图1G、H)。
接着,作者量化了HepG2细胞中与脂质代谢相关的基因的表达水平,发现ARB处理抑制了CD36和FANS等脂质合成基因的表达,但促进了CPT1和MTTP等参与脂质分解和脂质转运基因的表达(图1I)。这些发现共同表明,ARB可减少细胞内脂质积累而不影响细胞活力。
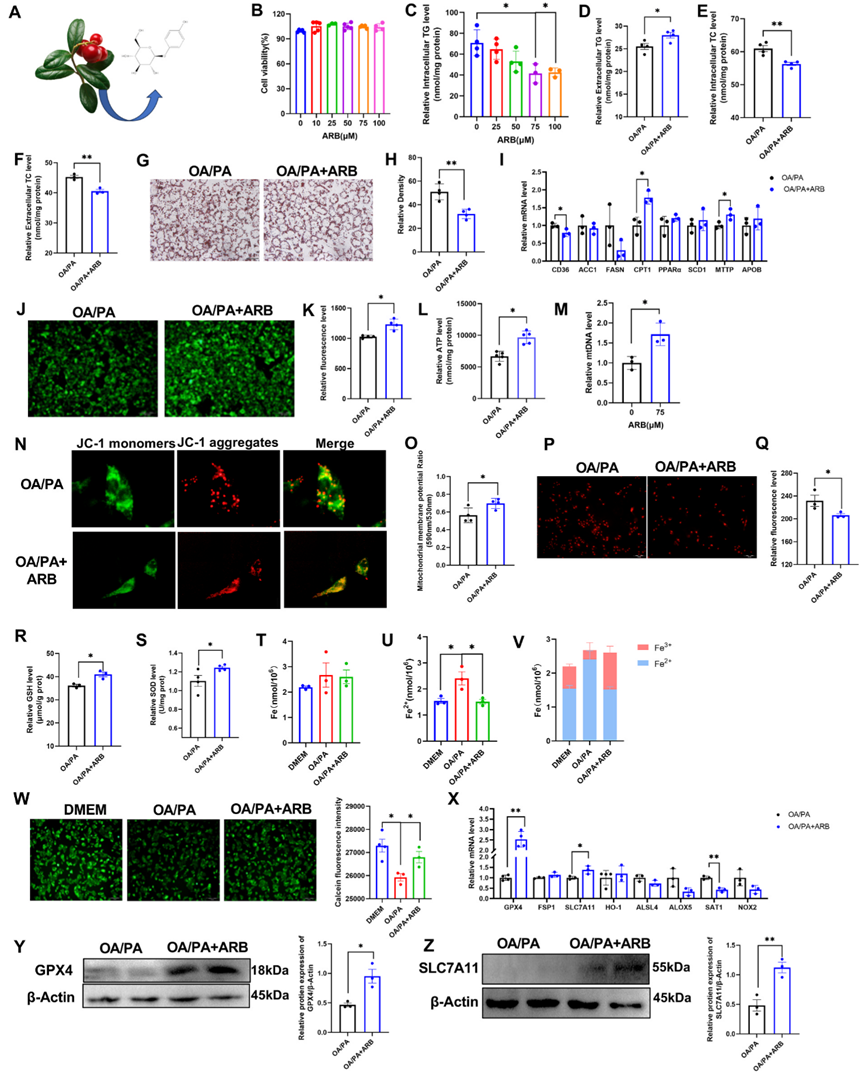
图1:ARB调节细胞内脂质沉积和铁死亡
2.ARB通过调节细胞能量代谢和氧化应激抑制铁死亡
由于非酒精性脂肪肝的发生与代谢失调和氧化应激密切相关,作者接下来试图确定ARB是否会影响能量代谢和氧化应激,发现ARB能明显增加线粒体的数量,并提高OA/PA处理细胞中ATP的水平(图1J-M)。此外,线粒体膜电位(MMP)检测显示,ARB处理OA/PA处理细胞后,MMP水平明显增加(图1N-O)。同时,ARB处理导致细胞内GSH、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)水平升高,Tatol ROS、线粒体ROS和丙二醛(MDA)生成减少。
作者进一步研究了ARB对OA/PA处理的细胞内总铁(Fe)和亚铁离子(Fe2+)含量的影响,发现ARB处理可显著降低细胞内Fe2+含量(图1T-V)。此外,钙黄绿素染色显示,ARB处理OA/PA处理的HepG2细胞逆转了单用OA/PA处理后观察到的细胞内不稳定铁池的增加(图1W)。
作者发现,ARB处理可显著上调GPX4和SLC7A11等铁死亡抑制基因的表达,同时显著下调铁死亡促进基因SAT1的表达(图1X)。此外,ARB还能显著降低血红素mRNA的表达水平。Western blot分析表明,ARB处理OA/PA处理细胞可明显提高GPX4和SLC7A11蛋白表达水平(图1Y-Z)。综上所述,作者的研究结果表明,在非酒精性脂肪肝的OA/PA细胞模型中,ARB可抑制细胞铁死亡。
3.ARB减少小鼠脂质沉积
为了确定ARB对小鼠脂质沉积的影响,高脂饲料(HFD)喂养的小鼠以1g/kg的剂量给予ARB。饲喂正常饮食的小鼠被认为是CON组。实验过程的大纲如图2A所示。
作者发现,HFD导致体重(图2B、C)和脂肪比率(图2E)显著增加,瘦肉比率(图2D)降低,而ARB治疗HFD喂养的小鼠显著减轻了这些影响。通过显微CT测量,HFD+ARB组小鼠的脂肪沉积明显少于HFD组小鼠(图2F)。与HFD组相比,HFD+ARB组小鼠附睾和皮下脂肪以及肝组织的相对重量明显减少(图2G-K)。H&E和油红O染色显示,与HFD组相比,ARB减轻了肝脏的损伤,减少了肝脏中脂质的积累,并缩小了附睾脂肪的体积和面积(图2L-M)。
与HFD小鼠相比,ARB治疗HFD小鼠可降低肝脏TG和TC水平以及粪便TG含量(图2N-O)。此外,ARB能显著降低HFD引起的血清TG、TC、LDL-H和AST、ALT水平的升高以及HDL-H水平的降低(图2P-Q)。这些结果表明,ARB可减轻HFD引起的脂质沉积和肝损伤。
为了进一步评估ARB治疗对HFD小鼠糖代谢的影响,作者在ARB治疗的第9周和第10周进行了GTT和ITT试验。GTT结果显示,与HFD小鼠相比,ARB能显著降低葡萄糖注射后血糖水平的升高,并促进血糖水平恢复到正常水平(图2R和S)。作者的ITT结果与GTT数据一致(图2T-U)。研究结果表明,膳食中补充ARB可以改善HFD诱导的胰岛素抵抗。

图2:ARB可减少小鼠的脂质沉积
4.ARB调节小鼠的能量代谢和氧化应激以改善铁死亡
ARB治疗10周后,作者进行了代谢笼试验,以测量小鼠的能量消耗和体力活动。作者发现,与HFD组相比,HFD+ARB组的二氧化碳产生量和氧气消耗量明显更高(图3A-D)。同样,HFD+ARB组小鼠的呼吸熵率(RER)和能量消耗也明显高于HFD组(图3E-H)。这些影响在黑暗环境中更为明显(图3A-H)。HFD+ARB组小鼠的体力活动水平明显高于HFD组小鼠,而且这种效应与饲料摄入量无关。这些结果表明ARB可改善HFD引起的小鼠能量代谢紊乱。
作者进一步研究了ARB对小鼠氧化应激的影响,发现与HFD组相比,ARB可减少ROS和MDA的积累,增加GSH的含量(图3I-K),这表明ARB可改善HFD诱导的氧化应激。作者还检测了肝脏中铁和Fe2+的含量,发现HFD导致肝脏中Fe2+含量显著积累,而铁含量没有明显变化。然而,在膳食中添加ARB可抑制HFD引起的Fe2+含量增加(图3L-N),而血清中的铁含量也呈现类似的趋势(图3O)。
最后,qRT-PCR显示,与HFD小鼠相比,在HFD小鼠的膳食中添加ARB会导致抑制铁死亡的基因(GPX4、SLC7A11)的表达显著增加,而促进铁死亡的基因(ACSL4、STA1)的表达减少(图3P)。Western blot分析显示ARB促进了GPX4和SLC7A11的表达(图3Q-R)。这些研究结果表明,ARB可改善小鼠的氧化应激并减轻铁死亡。
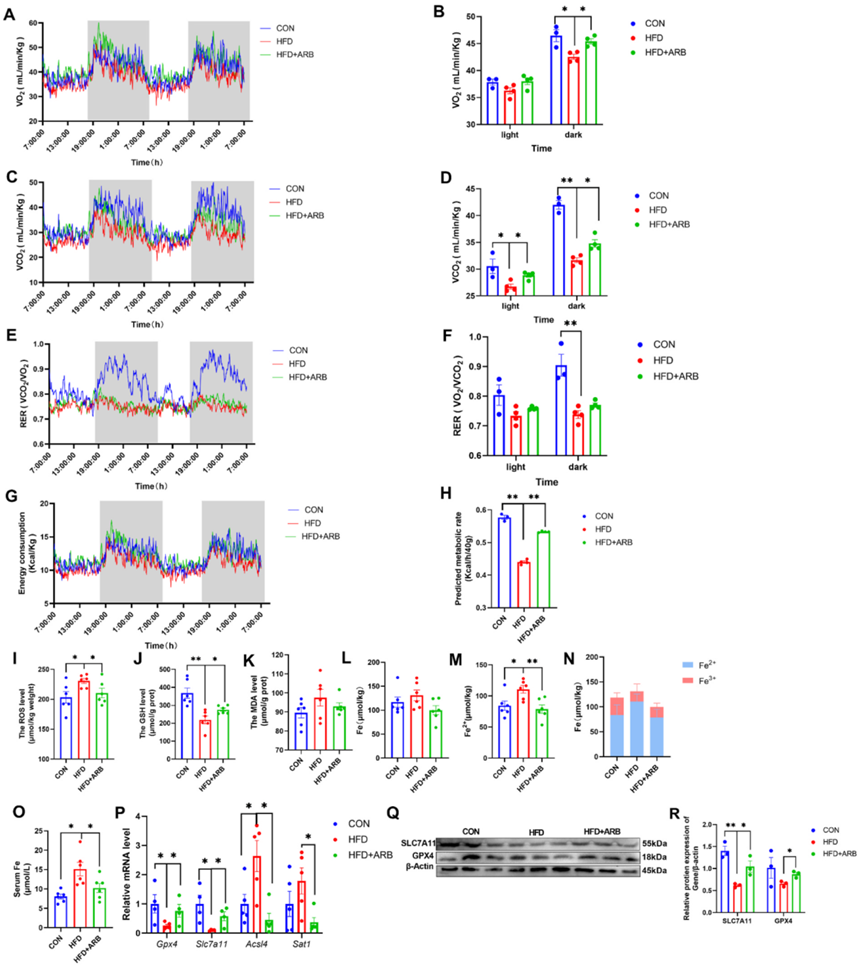
图3:ARB通过调节小鼠能量代谢和氧化应激,改善铁死亡
5.FTO是ARB的靶标
接下来,作者利用Discovery Studio进行反向对接分析,试图确定ARB调节脂质代谢的潜在机制。在排除Fit值低于0.6的模型并对预测数据进行去重和生物校正后确定了410个潜在靶点。为了优化靶点的选择,作者将从GeneCards和Swiss TargetPredicion数据库中获得的与非酒精性脂肪肝相关的靶点与410个已确定的靶点重叠,确定了16个可能与ARB对非酒精性脂肪肝的影响潜在相关的靶点(图4A)。在确定的靶点中,前10位靶蛋白包括脂肪量和肥胖相关蛋白(FTO)、细胞周期蛋白依赖性激酶2(CDK2)和糖原合酶激酶-3β(GSK-3β)。作者对去甲基化酶FTO特别感兴趣,因为之前已经证明FTO能有效调节肝脏脂质代谢。因此,作者假设FTO可能是ARB调节脂质代谢的潜在靶点。为了验证这一点,作者对ARB和FTO进行了分子对接,发现ARB与FTO在Glu234、Tyr106和Arg96处形成了直接的氢键相互作用,并与Asp233、His231和His232形成了疏水相互作用(图4B-E)。这些结果表明,FTO是ARB的靶标,可能介导ARB对脂质代谢的影响。
Western blot分析表明ARB对FTO蛋白表达水平没有影响,而qRT-PCR分析表明ARB抑制了FTO表达细胞中FTO mRNA的表达。接下来,作者使用细胞热转移试验(CETSA)和可分化结构搜索(DARTS)证实ARB与FTO结合(图4F、G)。
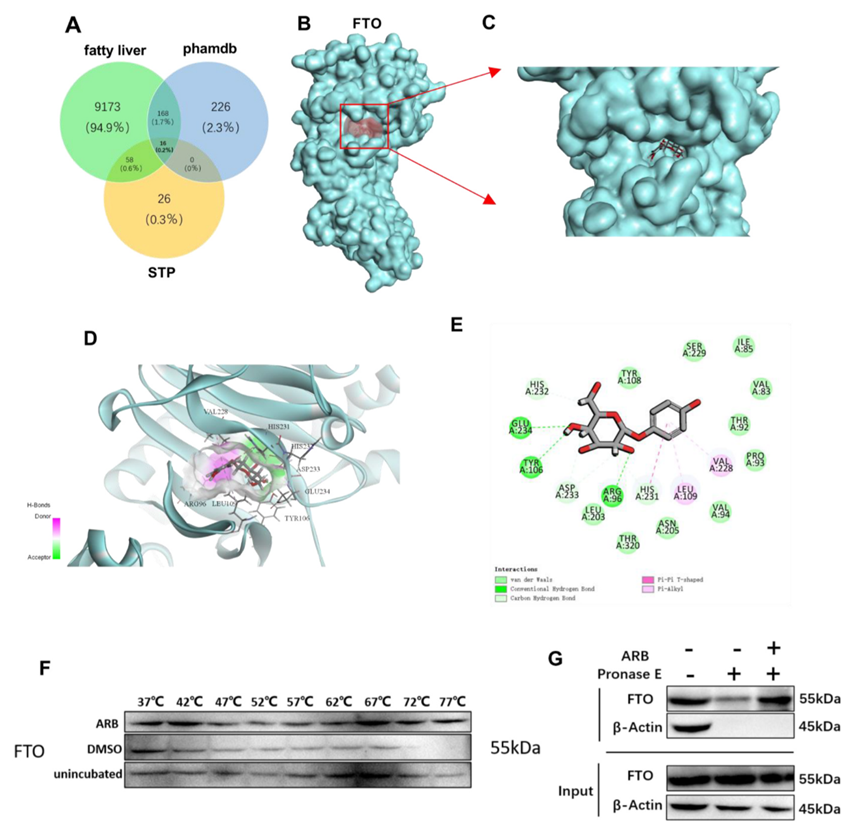
图4:FTO是ARB的靶点
6.ARB通过FTO调节细胞内脂质代谢和铁死亡
FTO会破坏细胞的脂质代谢和能量代谢,并影响氧化应激。作者发现ARB处理可降低FTO诱导的TG含量增加,但对过表达FTO-mut(去甲基化功能丧失)细胞中的TG水平没有影响(图5A)。与这些发现一致的是,油红O染色显示ARB处理减少了FTO过表达诱导的细胞内脂滴的异常积累,尤其是面积大于40μm2的脂滴(图5B、C)。同样,ARB处理可减少FTO诱导的TC水平的增加(图5D)。这些结果表明,ARB可能通过调节FTO去甲基化酶的活性来影响脂质代谢物。
FTO过表达增加了ROS的积累,而ARB逆转了这些效应(图5E-FE)。此外,ARB处理过表达FTO的细胞可增加GSH、SOD和MDA水平,降低线粒体荧光(图5G-H)。接下来作者评估了FTO过表达对细胞Fe和Fe2+含量的影响,发现ARB处理逆转了FTO诱导的Fe2+含量增加(图5I-K)。作者的钙黄绿素染色数据与这些发现一致(图5L-M)。总之,这些结果进一步证明了ARB对脂质代谢和铁死亡的调节作用是通过FTO介导的。
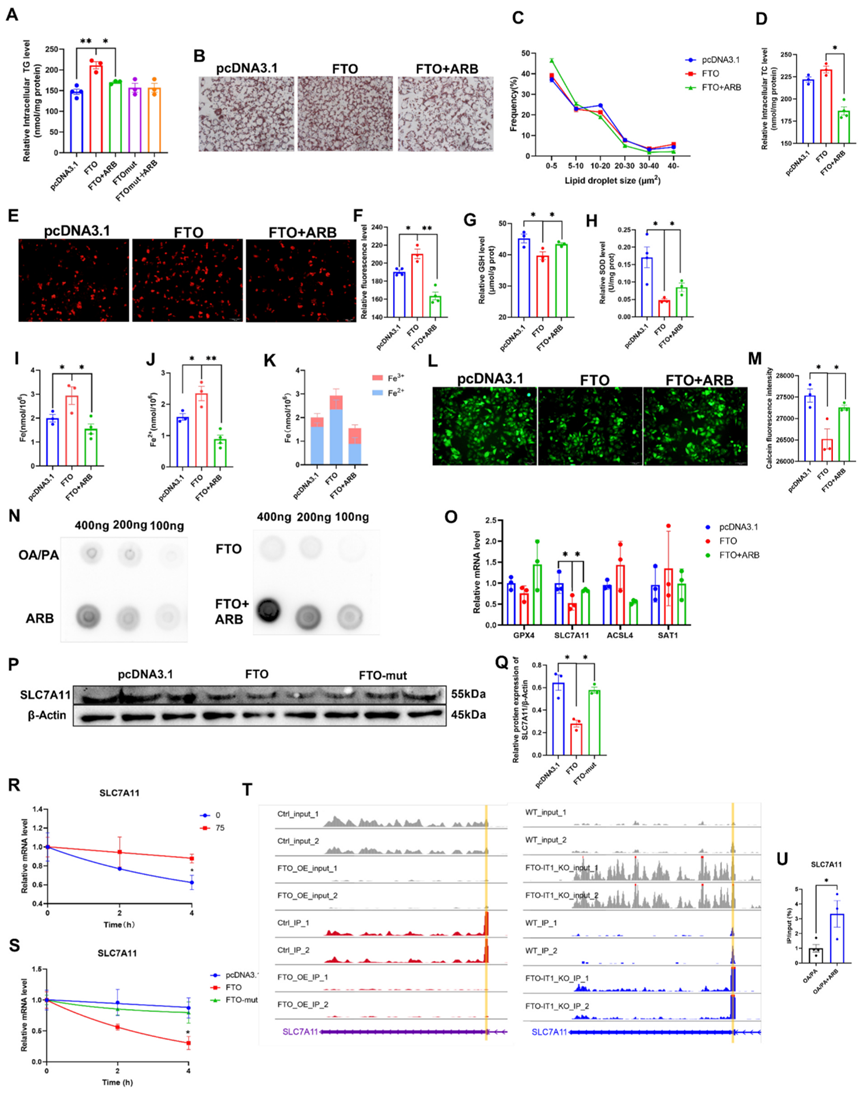
图5:ARB可调节细胞内脂质代谢和铁死亡,并通过抑制FTO促进SLC7A11的甲基化修饰。
7.ARB通过抑制FTO促进SLC7A11的m6A甲基化
接下来,作者使用斑点印迹试验来确定ARB是否会影响FTO介导的m6A甲基化修饰。在ARB组中观察到较高水平的m6A(图5N)。qRT-PCR分析表明,ARB增加了FTO诱导的铁死亡抑制基因(如GPX4和SLC7A11)的减少。相反,ARB会降低促进铁死亡基因的表达,包括ACSL4和SAT1(图5O)。由于SLC7A11表达的减少最为显著,作者在随后的实验中重点研究了SLC7A11。过表达FTO导致SLC7A11蛋白表达水平下降,而过表达FTO突变体对SLC7A11的表达没有影响(图5P-Q)。接下来,作者检测了SLC7A11的半衰期,发现ARB处理增加了SLC7A11的半衰期,从而促进了其稳定性(图5R)。FTO的过表达缩短了SLC7A11的半衰期,而FTO突变则没有影响。
为了评估FTO对SLC7A11 m6A甲基化的影响,作者使用MeRIP-seq分析和鉴定了SLC7A11的甲基化位点,发现敲除FTO会导致SLC7A11的3′-非翻译区(3′-UTR)的甲基化增加,而过表达FTO会导致SLC7A11的3′-UTR区的m6A甲基化减少(图5T)。此外,MeRIP-qPCR证实ARB处理促进了SLC7A113′-UTR区域的m6A甲基化(图5U)。这些发现表明,ARB介导的FTO抑制促进了SLC7A113′-UTR区的m6A甲基化,从而促进了SLC7A11的表达。
8.ARB通过影响SLC7A11的表达来抑制铁死亡
接下来,作者利用与SLC7A11相互作用的铁死亡特异性激活剂Erastin来研究SLC7A11在脂质代谢和铁死亡中的作用。研究发现,Erastin通过与Gln191形成直接的氢键相互作用来抑制SLC7A11的表达。用CCK-8试验测定,发现ARB可减轻0.1-100μM Erastin处理细胞24小时诱导的细胞死亡(图6A)。此外,ARB还降低了10μM Erastin处理细胞24小时后诱导的TG(图6B)和Fe2+(图6C-E)水平的升高。作者的钙黄绿素染色数据与这些结果一致(图6F、G)。为了进一步验证研究结果,接下来作者研究了铁死亡抑制剂Ferrostatin-1(Fer-1)对细胞活力和脂质代谢的影响。作者发现,1-100nM Fer-1处理细胞24小时可提高细胞活力,而ARB处理则无明显影响(图6H)。同样,虽然与OA/PA处理的细胞相比,10nM Fer-1和Fer-1+ARB处理导致细胞外TG水平下降,但Fer-1和Fer-1+ARB处理之间没有观察到显著差异(图6I)。作者的钙黄绿素染色数据也显示了类似的趋势(图6J和K)。
作者用SLC7A11 siRNA(siSLC7A11)转染HepG2细胞以敲除SLC7A11的表达,发现ARB逆转了siSLC7A11诱导的细胞内TG水平的增加(图6L)。此外,敲除SLC7A11导致ROS积累和GSH含量降低,而ARB处理可逆转这两种情况(图6M-O)。ARB处理抑制了siSLC7A11诱导的Fe2+水平的增加(图6P-R),而作者的钙黄绿素染色数据也显示了类似的效果。相反,过表达SLC7A11会导致细胞内TG水平下降(图6U)、ROS积累和Fe2+水平下降以及GSH水平上升(图6V-Z)。siSLC7A11和siSLC7A11+ARB处理组之间没有观察到明显差异,表明ARB是通过SLC7A11发挥作用的。
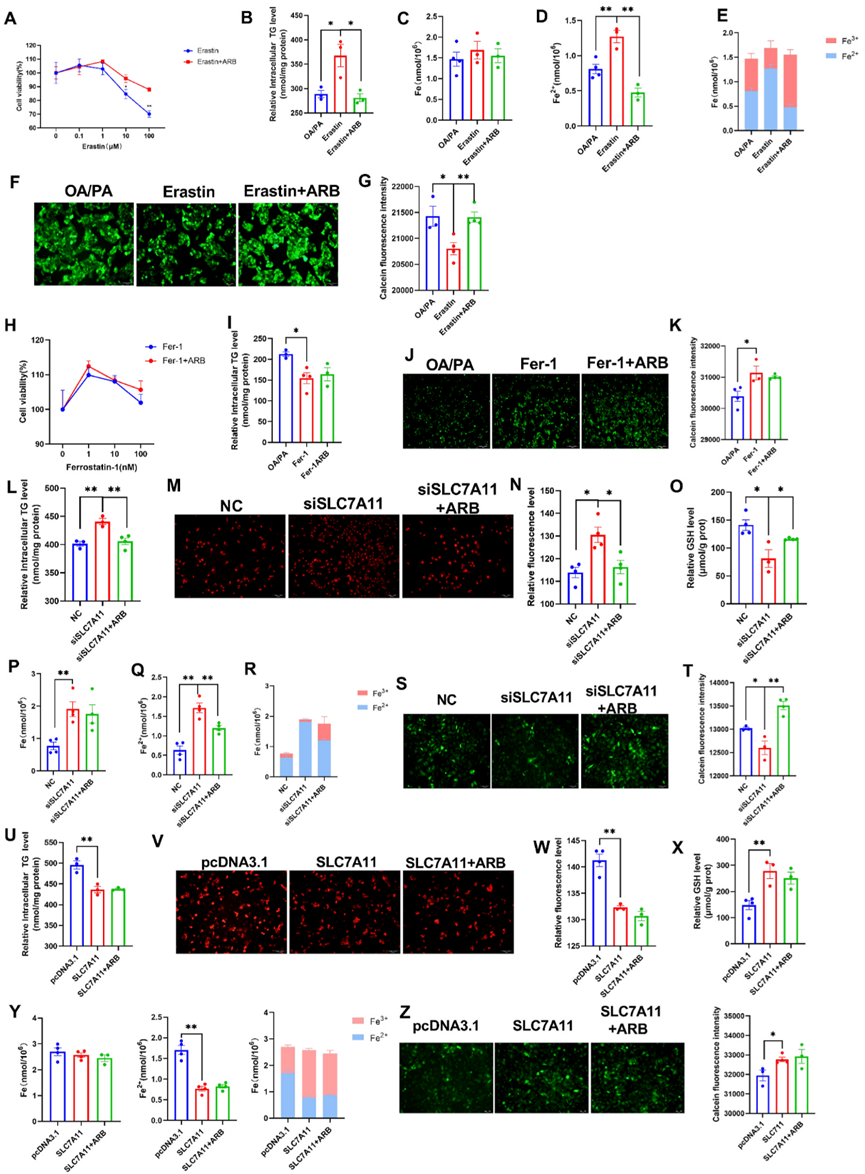
图6.ARB影响SLC7A11以抑制铁死亡。
9.AAV介导的SLC7A11肝过表达可减轻小鼠的脂肪肝
为了进一步确定SLC7A11对非酒精性脂肪肝的影响,作者通过尾静脉注射将编码SLC7A11的AAV载体注入小鼠肝脏。然后给小鼠喂食CON或HFD。注射对照AAV的小鼠也被分为CON组和HFD组。实验过程如图7A所示。10周后,小鼠被人道处死,并测量肝脏、心脏、脾脏、肾脏和附睾脂肪组织样本中的SLC7A11蛋白表达水平。作者的数据表明,SLC7A11已经在肝脏中成功表达。Western blot分析进一步显示,与高脂饮食小鼠相比,高脂饮食-SLC7A11小鼠附睾脂肪和肾脏中的SLC7A11蛋白表达水平显著增加。
作者发现,与HFD组相比,HFD-SLC7A11组小鼠的体重和脂肪体积显著降低,而瘦肉率显著升高(图7B-E)。CT扫描也显示,与HFD小鼠相比,HFD-SLC7A11组的脂肪含量明显减少(图7F)。此外,HFD-SLC7A11组小鼠附睾脂肪、皮下脂肪和肝脏的重量也明显降低(图7G-K)。此外,与HFD小鼠相比,在HFD小鼠中过表达SLC7A11可减少附睾脂肪组织的脂肪含量和面积,并减轻肝脏的组织损伤和脂质沉积(图7L-M)。
与高脂血症组相比,HFD-SLC7A11小鼠肝脏和血清中的TG和TC水平明显下降(图7N-Q)。血清指标分析表明,HFD-SLC7A11组与HFD组相比,LDL-C、AST和ALT水平显著降低,而HDL-C水平显著升高。这些发现表明,过表达SLC7A11可减轻小鼠的非酒精性脂肪肝。
通过在治疗的第6周和第7周进行GTT和ITT测试,研究了SLC7A11对小鼠糖代谢的影响。作者的GTT数据表明,过表达SLC7A11可改善高氟酸小鼠的葡萄糖耐量(图7R、S)。同样,作者的ITT数据显示,过表达SLC7A11改善了高氟酸小鼠的胰岛素抵抗(图7T-U)。这些发现表明,SLC7A11在调节高纤维食物喂养小鼠的糖代谢和改善胰岛素敏感性方面发挥着有益的作用。
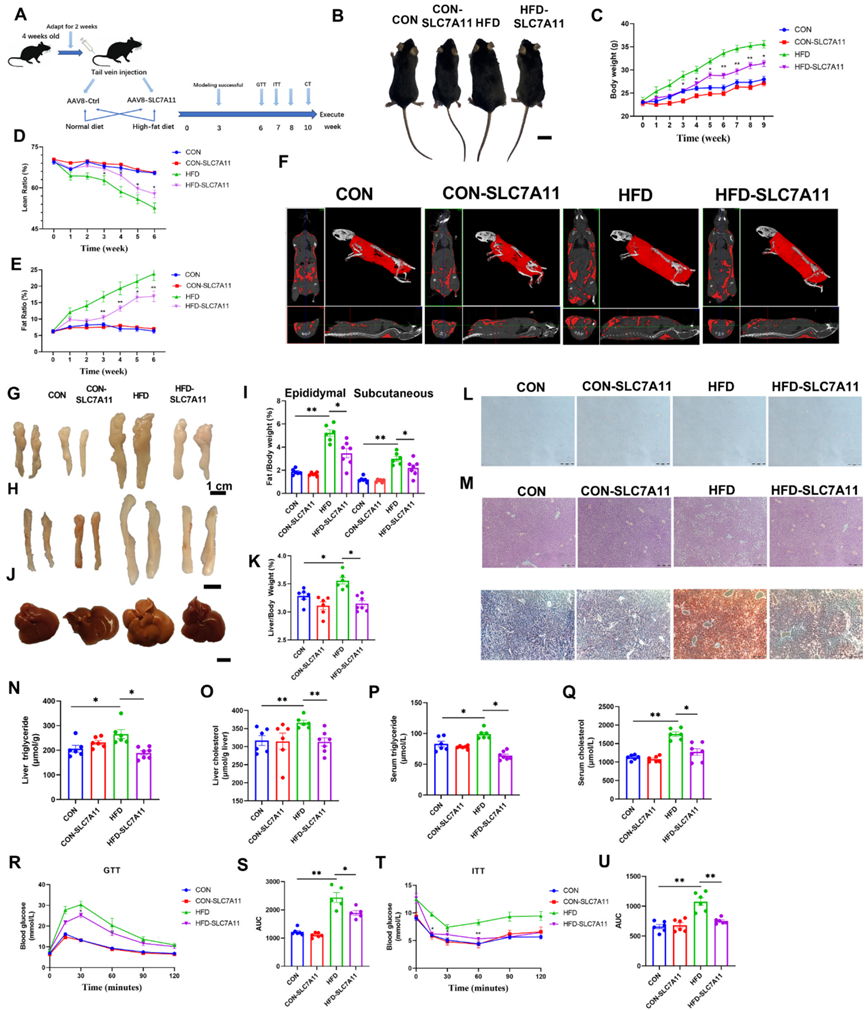
图7:AAV介导的SLC7A11肝脏过表达可减轻小鼠脂肪肝。
10.AAV介导的SLC7A11肝过表达可改善能量代谢并减少氧化应激
在治疗的第8周,使用代谢笼实验检测了SLC7A11的过表达对小鼠能量代谢的影响。过表达SLC7A11对CON小鼠的能量代谢没有显著影响,但对HFD小鼠的氧气消耗和二氧化碳产生率有显著改善(图8A-D)。我们的RER和能量消耗数据与这些发现一致(图8E-H)。此外,能量代谢的这些变化在黑暗条件下更为明显(图8A-H),并且与饲料摄入量和运动无关(图S8E-F)。
在CON小鼠肝脏中未观察到ROS和GSH水平的明显变化。然而,与HFD小鼠相比,HFD-SLC7A11小鼠肝脏中的ROS水平显著降低(图8I),GSH水平显著升高(图8J)。与HFD小鼠相比,HFD-SLC7A11小鼠肝脏MDA水平也明显下降(图8K)。这些发现表明,过表达SLC7A11可改善高纤维食物喂养小鼠的能量代谢和氧化应激。HFD小鼠肝脏中的Fe2+含量明显高于CON小鼠。然而,与HFD小鼠相比,过表达SLC7A11会导致HFD-SLC7A11小鼠体内的Fe2+含量显著降低(图8L-N)。血清中的铁含量也出现了类似的趋势(图8O)。这些结果表明,在肝脏中过表达SLC7A11可改善铁变态反应。

图8:AAV介导的SLC7A11肝过表达可改善能量代谢并减少氧化应激
实验方法:
Dot blot、MeRIP-qPCR、RIP-qPCR、Western blot、RNA m6A的定量检测、分子对接技术、代谢笼实验、质粒转染
参考文献:
Jiang T, Xiao Y, Zhou J, Luo Z, Yu L, Liao Q, Liu S, Qi X, Zhang H, Hou M, Miao W, Batsaikhan B, Damba T, Liang Y, Li Y, Zhou L. Arbutin alleviates fatty liver by inhibiting ferroptosis via FTO/SLC7A11 pathway. Redox Biol. 2023 Dec;68:102963. doi: 10.1016/j.redox.2023.102963. Epub 2023 Nov 16. Erratum in: Redox Biol. 2023 Dec 1;:102974. PMID: 37984229; PMCID: PMC10694775.






