多种癌细胞释放的LIF和Gal3劫持神经信号
神经信号对肿瘤预后有显著影响。然而,癌细胞如何主动调节神经系统以使其自身存活尚不完全清楚。在这项研究中,作者报告了一种重叠的大脑反应模式,包括下丘脑室旁核,在多种外周癌症小鼠模型中。随后,多组学筛选确定白血病抑制因子(LIF)和半乳糖凝集素-3 (Gal3)是这些癌细胞类型释放的触发大脑激活的关键细胞因子。重要的是,这两种细胞因子的血浆水平在不同癌症患者中均有升高。作者进一步证明,药物或基因阻断癌细胞来源的LIF或Gal3信号可以消除大脑反应并强烈抑制肿瘤生长。此外,周围交感神经活动的消融同样可以恢复抗肿瘤免疫。这些结果阐明了多种癌细胞劫持神经系统以促进肿瘤进展的一种新的共享机制。该文章于2024年3月发表在《Cell research》,IF:44.1。
技术路线:

技术路线图
1. 大脑对多种外周肿瘤反应的重叠模式
作者试图探索外周肿瘤与中枢神经系统通讯的机制。作为研究的切入点,作者使用了几种小鼠同种异体移植模型,即LLC肺癌、RM1前列腺癌、MC38结肠癌和4T1乳腺癌。值得注意的是,这些同种异体移植模型通常被用于癌症免疫学研究抗肿瘤免疫和MDSCs在免疫能力野生型小鼠中的作用。小鼠皮下植入每一种癌细胞系,然后对荷瘤小鼠的脑组织进行磷酸化核糖体蛋白S6 (p-S6)的免疫染色,p-S6是神经元激活的特异性标志物作者全面评估了从嗅球到脑干的脑区。令人惊讶的是,作者在所有的肿瘤条件下发现了一个共同的大脑反应模式,包括下丘脑室旁核(PVN),一个启动传出交感信号的大脑中枢区域(图1a, b)。此外,视交叉上核(SCN)、左右前庭核(Ve-L/-R)、三叉神经左右中脑核(Me5-L/-R)、红核(RN)、舌下核(12N)、以及三叉神经左右运动核(5N-L/-R)在这些同种异体移植物模型中被触发(图1a, b)。另一方面,在与内脏或代谢信号相关的大脑区域,如孤立束核(NTS)、左右臂旁核(PBN-L/-R)和弓形核(ARC),没有检测到神经活动(图1c, d),这说明了癌症诱导的大脑激活的特异性。
除了同种异体移植癌症模型,作者还评估了MMTV-PyMT小鼠的大脑激活情况,这是一种标准的原位乳腺癌遗传模型重要的是,该遗传模型显示出与上述同种异体移植模型相同的一组反应性和非反应性脑区(图1a-d)。这些结果表明,尽管它们的起源和突变谱不同,但多种类型的外周癌症可能诱导重叠的脑反应模式。
为了确定肿瘤的生理负担是否可能是大脑对不同癌症反应的共性的基础,作者向野生型小鼠植入了一个由医用级硅胶制成的假肿瘤。尽管这些假肿瘤有效地模仿了“真实”肿瘤的体积和重量,但它们未能在包括PVN、SCN、Ve-L/-R和Me5-L/-R在内的特征脑区引起任何神经活化。这一观察结果在很大程度上排除了外周肿瘤的物理性质参与诱导脑激活的可能性。
2. 白血病抑制因子(LIF)和半乳糖凝集素-3 (Gal3)是引发大脑反应的癌细胞来源因子
作者考虑了多种癌症类型可能释放相同的因子来触发大脑激活的重叠模式的可能性。为了验证这一假设,作者通过RNA测序(RNA-seq)分析了LLC、RM1、MC38和4T1异体移植模型和MMTV-PyMT遗传模型的肿瘤转录组(图1e),并鉴定出约2000个候选基因在不同癌症类型中表现出共同的表达模式。同时,通过蛋白质组学分析检测LLC、RM1、MC38或4T1细胞培养基中的蛋白质(图1e)。作者发现,114种蛋白质在这些癌细胞的分泌组中普遍存在,其中89种被列入RNA-seq分析鉴定的候选基因列表。其中,61个候选蛋白被过滤为真正的分泌因子,即具有信号肽,其中11个具有特定受体。作者进一步分析了这些受体在已发表的小鼠三叉神经节神经元(GSE213105)的单细胞RNA-seq (scRNA-seq)数据集中的表达,其轴突控制Me5-L/-R和5N-L/-R,这是多种癌症类型激活的特征区域。通过多组学筛选,获得了三个候选蛋白(LIF、色素上皮衍生因子和血栓反应蛋白-1),进行了深入的功能检查(图1f)。

图1 多种外周肿瘤小鼠模型中脑反应的重叠模式
作者用三种候选蛋白中的每一种重组蛋白处理非荷瘤野生型小鼠,测试是否可以重现对外周肿瘤的相同脑反应模式(图2a)。值得注意的是,单次腹腔注射1 μg小鼠LIF可以有效地激活特征脑区,即PVN, SCN, Ve-L/-R, Me5-L/-R, RN, 12N和5N-L/-R,持续长达24小时(图2b,c)。同时,让人联想到在荷瘤小鼠中观察到的情况,这种LIF治疗没有引起NTS或PBN-L/-R中可检测到的神经活动(图2d,e)。此外,在LLC、RM1、MC38或4T1细胞的所有同种异体移植模型中,以及荷瘤MMTV-PyMT小鼠中,血浆LIF蛋白水平显著上调(图2f)。此外,在前列腺癌、膀胱癌、输尿管癌、非小细胞肺癌、结直肠癌和肾癌等多种癌症患者中均检测到血浆LIF水平升高(图2g)。这些结果支持LIF是一种癌细胞衍生因子,可触发大脑反应。
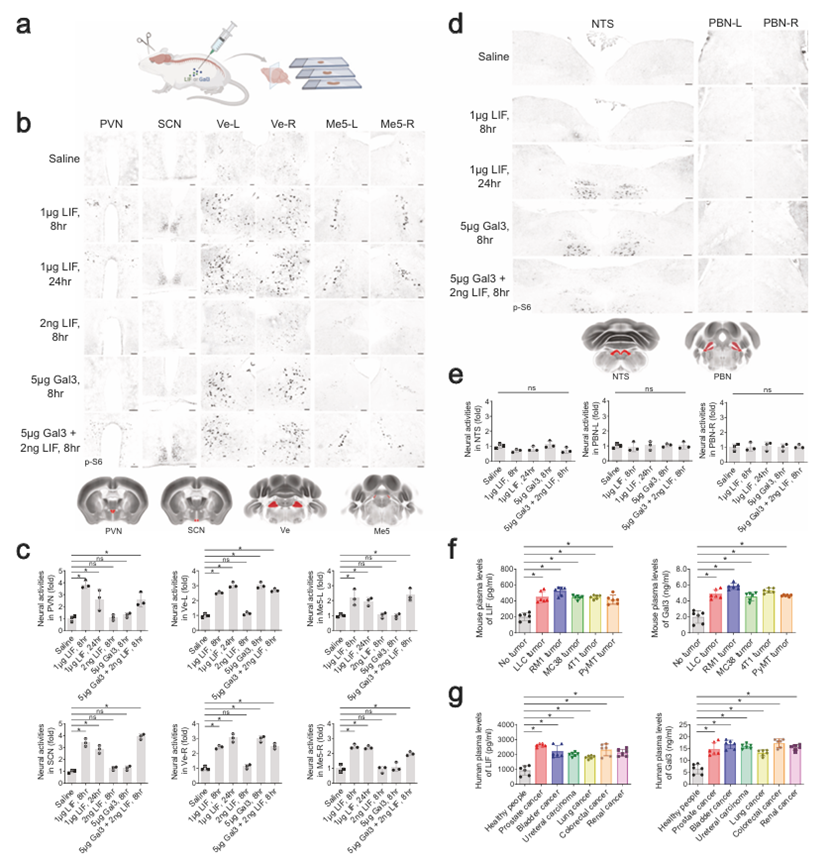
图2 LIF和Gal3是癌细胞衍生的因子,它们协同激活特定的大脑区域
然而,作者注意到腹腔注射1μg重组LIF蛋白导致血浆水平达到~50 ng/mL,比荷瘤小鼠高100倍。另一方面,尽管单次注射2ng LIF可使其血浆水平与荷瘤条件下的水平相当,但这种低剂量不足以引起大脑激活(图2b,c)。这一现象提出了一个具有挑战性的问题,即可能存在其他癌细胞衍生因子在神经激活中与LIF协同作用。为此,作者继续对剩余的60个候选分泌因子的市售重组蛋白进行了筛选,希望找到一个在低剂量LIF治疗条件下可以诱导神经活动的重组蛋白。作者设法发现,虽然单独腹腔注射5 μg半乳糖凝集素-3(Gal3)仅诱导非荷瘤小鼠Ve-L/-R区的神经活动,但它与2ng LIF协同作用,触发所有特征脑区的反应(图2b,c)。顺便说一句,重组LIF和Gal3蛋白在血液中的清除速度都相对较快(LIF的t1/2 = 2.9 min,Gal3的t1/2 = 3.2 min)。值得注意的是,在LLC、RM1、MC38或4T1细胞的同种异体移植模型和MMTV-PyMT遗传模型中,血浆Gal3水平显著上调(图2f)。此外,不同癌症患者血浆中Gal3水平显著升高(图2g)。这些结果共同确定了LIF和Gal3是多种癌症类型释放的与大脑沟通的关键因子。
3. 阻断大脑的LIF和Gal3信号可抑制肿瘤进展
接下来,作者探索了癌细胞来源的LIF和Gal3信号与大脑的疾病相关性。通过CRISPR/Cas9生成LIF或Gal3基因缺失的LLC、RM1、MC38或4T1细胞,然后在小鼠同种异体移植模型中进行测试(图3a)。值得注意的是,这些细胞中的LIF敲除(KO)阻断了特征脑区域(如PVN和Me5-L/-R)的癌症诱导活性(图3b,c)。有趣的是,LIF缺失的LLC、RM1、MC38或4T1细胞并没有完全消除Ve-L/-R的神经活动(图3b,c),这与上述观察一致,即Gal3单独可以刺激脑核(图2b,c)。癌细胞中的Gal3 KO强烈地破坏了肿瘤小鼠所有特征脑区的神经活动(图3b,c)。这些结果验证了癌细胞来源的LIF和Gal3在介导多种类型外周肿瘤的脑反应中的协同作用。
在LLC、RM1、MC38或4T1细胞的小鼠同种异体移植模型中,LIF KO或Gal3 KO阻断脑激活可延缓肿瘤生长(图4a)。为了进一步支持LIF和Gal3信号的关键作用,作者每天用EC330(一种LIF的小分子抑制剂)治疗携带“野生型”肿瘤的小鼠。这种药理学方法抑制了大脑特征区域(如PVN、SCN和Me5-L/-R)的大脑反应。与此同时,与LIF - KO的结果一致,在使用EC330处理的荷瘤小鼠中,Ve-L/-R的神经活动持续存在。重要的是,在“野生型”LLC、RM1、MC38或4T1细胞的小鼠同种异体移植模型中,EC330治疗延迟了肿瘤生长。同样,当使用Gal3小分子抑制剂GB1107治疗时,携带“野生型”肿瘤的小鼠在所有特征区域都没有表现出大脑反应。此外,这种对Gal3信号的药理学抑制导致了肿瘤生长的强烈抑制。这些结果阐明了癌细胞来源的LIF和Gal3信号在调节肿瘤进展中的作用。
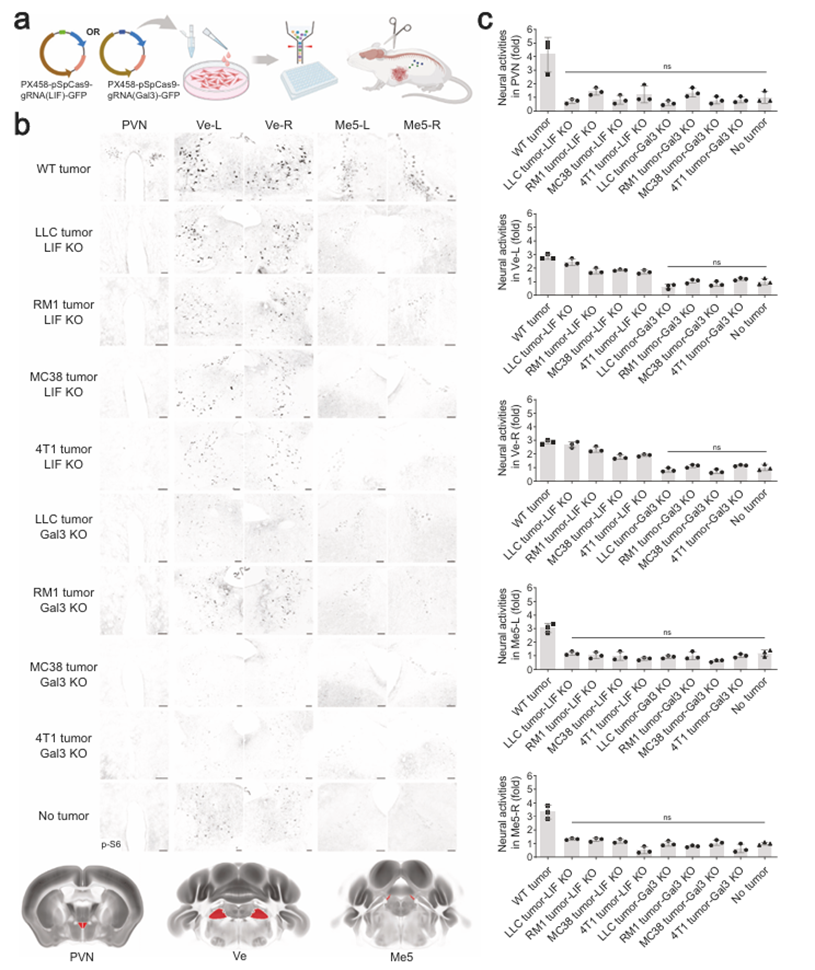
图3 癌细胞来源的LIF和Gal3对大脑反应至关重要
4. 交感信号促进MDSC的产生,促进肿瘤进展
研究表明,MDSCs可进一步分类为多形核MDSCs (PMN-MDSCs)或单核MDSCs (M-MDSCs),它们具有抑制CD8+ T细胞介导的抗肿瘤免疫的作用。作者发现,在LIF KO或Gal3 KO细胞的小鼠同种异体移植模型的血液和肿瘤中,PMN-MDSCs和M-MDSCs的存在减少(图4b)。因此,与亲代“野生型”细胞相比,LIF KO或Gal3 KO细胞的同种异体移植肿瘤中CD8+ T细胞的募集增加(图4c)。这些结果表明,阻断癌细胞来源的LIF和Gal3信号传导到大脑可以增强抗肿瘤免疫。

图4 阻断LIF或Gal3信号可抑制肿瘤进展
因此,作者试图确定这种癌症诱导的大脑反应所提供的神经免疫机制。骨髓间充质干细胞主要通过骨髓和脾脏等淋巴器官的骨髓生成。由于癌细胞来源的LIF和Gal3协同激活了PVN, PVN是控制输出交感作用的中枢脑区,作者探索了特定淋巴器官的局部交感输入是否可能调节MDSC的产生。作者利用Th-Cre;TrkAfl/fl小鼠模型,其中NGF高亲和受体TrkA在交感神经元中缺失。作者之前使用先进成像技术的研究显示Th-Cre; TrkAfl/fl小鼠骨髓和脾脏交感输入完全消融。在小鼠同种异体移植模型中检测Th-Cre、TrkAfl/fl(即交感神经消融)和对照Th-Cre、TrkA+/+窝鼠。作者比较了这些荷瘤小鼠的脑活动,揭示了交感神经消融与对照条件下特征区域的神经活动水平相似。此外,交感神经消融荷瘤小鼠的血浆LIF或Gal3水平没有显著变化。这些发现证实了癌症引起的大脑反应会在交感神经信号的上游发生。然而,Th-Cre;TrkAfl/fl小鼠的肿瘤生长明显受到抑制(图5a),这与这些小鼠血液和肿瘤中MDSCs减少而CD8+ T细胞增加有关(图5b-d)。作者进一步在Th-Cre、TrkAfl/fl和对照幼崽中检测了LIF KO或Gal3 KO癌细胞。重要的是,在交感神经切除和对照条件下,LIF或Gal3 KO肿瘤的生长速率是相当的(图5e,f),表明在这种情况下,LIF或Gal3基因缺失没有加性效应。这些结果支持了LIF和Gal3可以通过交感信号促进MDSC生成以促进肿瘤进展的观点。
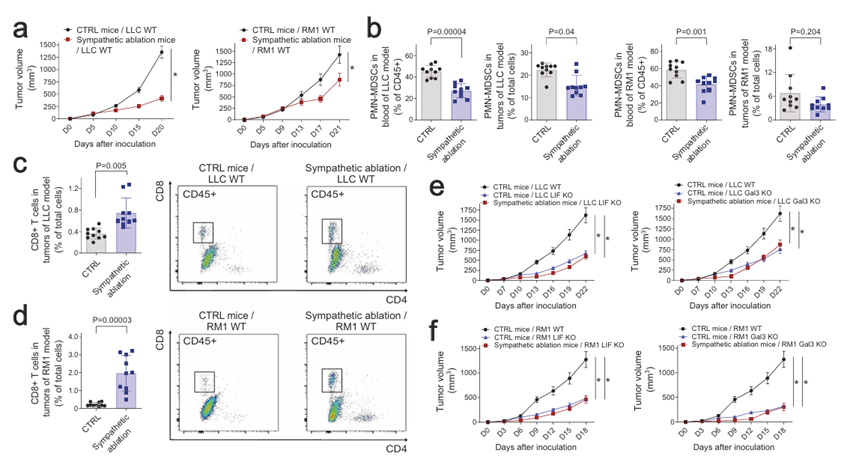
图5 癌细胞来源的LIF和Gal3通过交感信号促进MDSC的产生
接下来,作者利用交感神经切除术的手术方法特异性地去除小鼠脾脏中的交感神经输入(图6a),然后将其用于异体移植物癌症模型。与交感神经消融术观察到的情况类似,脾交感神经切除术对血浆LIF或Gal3水平没有显著影响。另一方面,局部去除交感输入足以减少肿瘤小鼠脾脏(图6b)和血液循环(图6c)中的PMN-MDSCs和M-MDSCs,这表明脾脏中的交感信号促进了MDSCs的产生。
最后,作者从小鼠同种异体移植模型的脾脏中筛选PMN-MDSCs和M-MDSCs进行体外培养。有趣的是,交感神经递质去甲肾上腺素(NE)提高了MDSCs中免疫抑制基因(如iNOS2、Arg1和Il-10)的表达。这种神经免疫作用可被β2-肾上腺素受体拮抗剂完全消除(图6d)。同时,作者发现荷瘤小鼠的血浆LIF或Gal3水平不受外源性NE处理的影响,证实癌细胞释放LIF或Gal3不依赖交感信号。这些结果表明,交感信号可以直接促进MDSCs的免疫抑制功能。
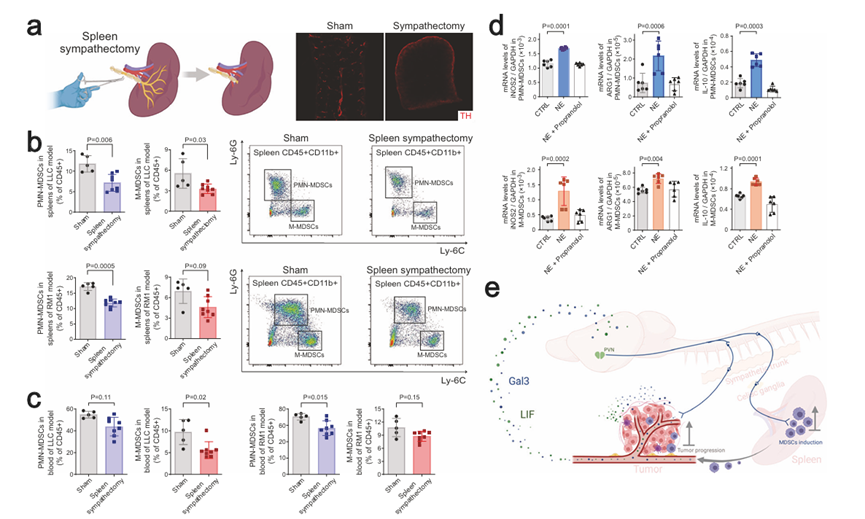
图6 交感信号直接促进MDSCs的免疫抑制功能
结论:
总之,该研究阐明了多种癌症劫持神经信号促进肿瘤进展的一种新的共享机制(图6e),这对更好地理解癌症神经科学的复杂性具有广泛的意义。
实验方法:蛋白质组学分析,ELISA,小鼠脑组织免疫染色,RNA-seq
参考文献:
Xu, Q., Cao, Y., Kong, F. et al. Multiple cancer cell types release LIF and Gal3 to hijack neural signals. Cell Res (2024). https://doi.org/10.1038/s41422-024-00946-z






