lncRNA RGMB-AS1通过抑制HMOX1泛素化和NAA10激活来诱导非小细胞肺癌中的铁死亡
铁死亡是一种由过量脂质过氧化积累引起的铁依赖性调节细胞死亡方式,已逐渐成为包括非小细胞肺癌(NSCLC)在内的多种癌症的有希望的治疗靶点。在这项研究中,我们确定了lncRNA RGMB-AS1作为NSCLC中铁死亡的关键调节因子。机制上,RGMB-AS1与HMOX1相互作用,防止其被E3连接酶TRC8泛素化,导致HMOX1稳定性增加和铁死亡增强。此外,RGMB-AS1结合到NAA10的82-87氨基酸区域,刺激其乙酰转移酶活性,促进乙酰-CoA向HMG-CoA的转化,进一步贡献于铁死亡。RGMBAS1-HMOX1和RGMB-AS1-NAA10轴协同抑制了NSCLC在体内和体外的生长。临床上,NSCLC患者中低RGMB-AS1表达与肿瘤分期晚和总体生存率差有关。此外,腺相关病毒介导的RGMB-AS1过表达显著抑制了小鼠异种移植模型中的肿瘤生长。我们的发现揭示了铁死亡的一种新的lncRNA介导的调控机制,并强调了RGMB-AS1作为NSCLC预后生物标志物和治疗靶点的潜力。本文于2024年4月发表于“Cancer Letters”(IF=9.7)上。
技术路线
结果:
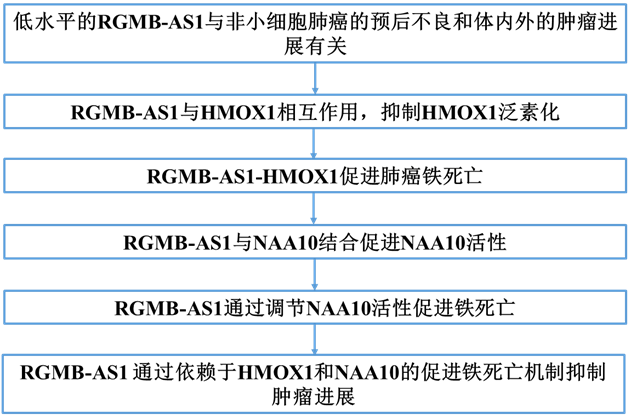
1)低水平的RGMB-AS1与非小细胞肺癌的预后不良和体内外的肿瘤进展有关
为了探讨RGMB-AS1与非小细胞肺癌临床结果的相关性,我们收集了58名患者的非小细胞肺癌组织样本和匹配的正常肺组织样本。我们发现,与正常肺组织相比,肿瘤中RGMB-AS1的表达显著降低(图1A)。死于非小细胞肺癌的患者RGMB-AS1的水平显著低于存活的患者(图1B),且RGMB-AS1的低水平与晚期TNM分期(III-IV期)显著相关(图1C)。Kaplan-Meier生存曲线显示,低水平的RGMB-AS1预示着非小细胞肺癌患者总生存期(OS)不良(图1D)。H1299细胞中的荧光原位杂交(FISH)结果显示,RGMB-AS1主要定位于细胞质(图1E)。RGMB-AS1的过表达导致克隆形成能力降低和细胞活力减少(图1F-G)。为了进一步评估RGMB-AS1与非小细胞肺癌细胞增殖之间的关联性,我们在裸鼠皮下注射RGMB-AS1过表达的H1299稳定细胞来评估肿瘤生长。RGMB-AS1的过表达显著抑制了肿瘤生长(图1H-J)。两组肿瘤的免疫组化染色进一步证实,过表达RGMB-AS1的肿瘤显示Ki-67的水平降低(图1K)。
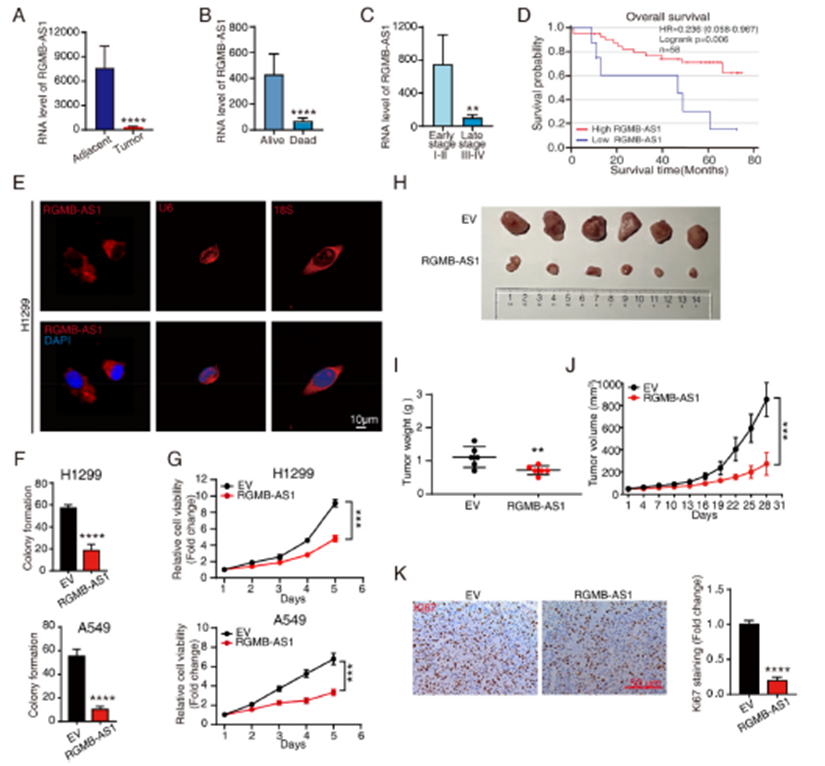
2)RGMB-AS1与HMOX1相互作用,抑制HMOX1泛素化
为了探讨RGMB-AS1抑制非小细胞肺癌增殖的潜在机制,我们进行了基于DIA(数据独立采集)的蛋白质组学分析,以比较RGMB-AS1过表达细胞与对照细胞之间的蛋白质变化。在RGMB-AS1过表达引起的321个差异表达蛋白(DEPs)中,HMOX1受到的影响最为显著。RGMB-AS1的过表达导致HMOX1蛋白水平增加(图2C)。一致地,RGMB-AS1过表达组小鼠肿瘤中HMOX1的蛋白水平增加(图2D)。使用shRNA在RGMB-AS1过表达稳定细胞中敲低HMOX1,导致细胞活力和克隆形成能力增加(图2E和F)。与细胞结果一致,裸鼠体内实验也显示,使用shRNA敲低HMOX1削弱了RGMB-AS1过表达对肿瘤进展的影响(图2G-I)。然后我们调查RGMB-AS1如何调节HMOX1蛋白水平。CHX追踪实验的证据显示,RGMB-AS1显著增加了HMOX1的蛋白稳定性(图2J和K)。我们进一步评估了HMOX1的泛素化,并发现RGMB-AS1过表达导致HMOX1泛素化水平降低(图2L)。TRC8,一种E3泛素连接酶,被发现促进HMOX1的泛素化并抑制癌细胞生长。RGMB-AS1拉下实验能共同拉下HMOX1(图2M),HMOX1 RNA免疫沉淀(RIP)也富集了RGMB-AS1(图2N),进一步证实了这种相互作用。值得注意的是,RGMB-AS1过表达破坏了HMOX1与TRC8的相互作用,表明RGMB-AS1通过减轻TRC8介导的泛素化来促进HMOX1的稳定性(图2O)。综上所述,RGMB-AS1与HMOX1相互作用,并竞争性抑制TRC8与HMOX1的结合,从而抑制其泛素化。
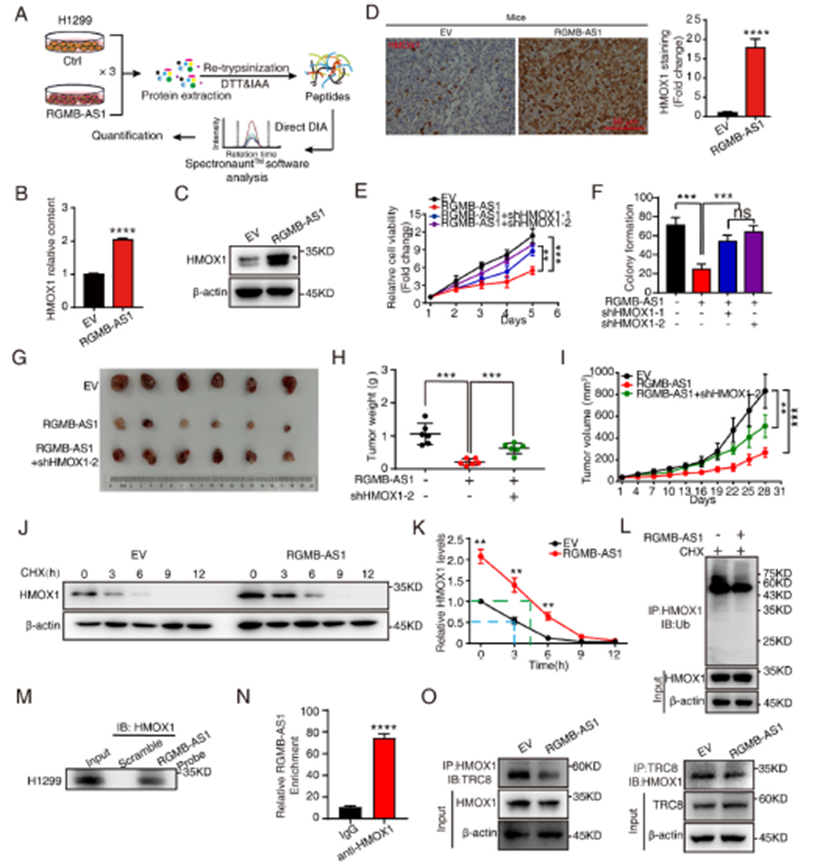
3)RGMB-AS1-HMOX1促进肺癌铁死亡
为了探讨RGMB-AS1-HMOX1参与的关联途径,我们进行了KEGG分析,结果显示,差异表达基因在脂肪酸生物合成、铁死亡和GSH代谢等途径中富集(图3A),在铁死亡途径中,与RGMB-AS1相互作用的HMOX1是五个富集基因中差异表达最显著的(图3B)。为了确定RGMB-AS1-HMOX1相互作用是否参与铁死亡,我们首先使用Mito-Tracker Red观察了线粒体完整性。与对照细胞相比,RGMB-AS1过表达显示出异常的线粒体分布(图3C)。透射电子显微镜(TEM)观察发现,RGMB-AS1过表达导致线粒体膜密度增加和线粒体脊减少(图3D)。GPX4水平在RGMB-AS1过表达时降低,而进一步敲低HMOX1的shRNA则逆转了这些效应(图3E)。RGMB-AS1过表达导致脂质ROS水平增加(图3F)。我们检测了MDA的水平,它是脂质过氧化物的最终产物,以及总GSH的水平,它是抵抗铁死亡的关键抗氧化剂。结果显示,RGMB-AS1过表达导致MDA水平增加和总GSH水平降低,进一步敲低HMOX1则逆转了这些效应(图3G和H)。同时,我们还检测了小鼠异种移植组织中的Fe2+水平。Fe2+水平在RGMB-AS1过表达组增加,但在HMOX1敲除后可以逆转(图3I)。一致地,RGMB-AS1敲除细胞中的脂质ROS水平显著降低,在此基础上过表达HMOX1可以恢复脂质ROS水平(图3J)。综上所述,这些结果表明RGMB-AS1通过与HMOX1共同作用来促进铁死亡。
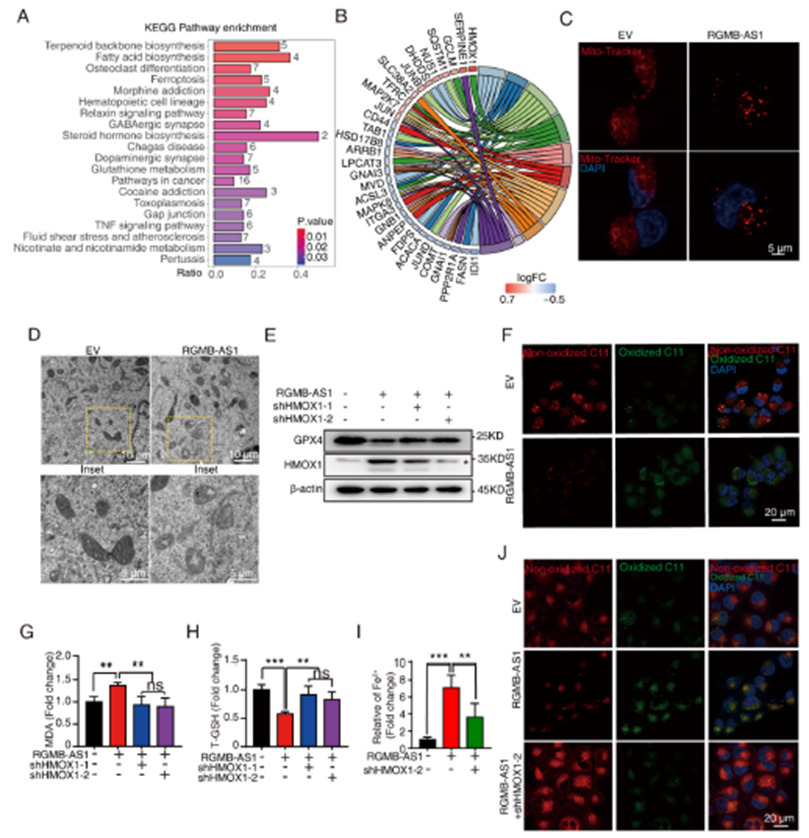
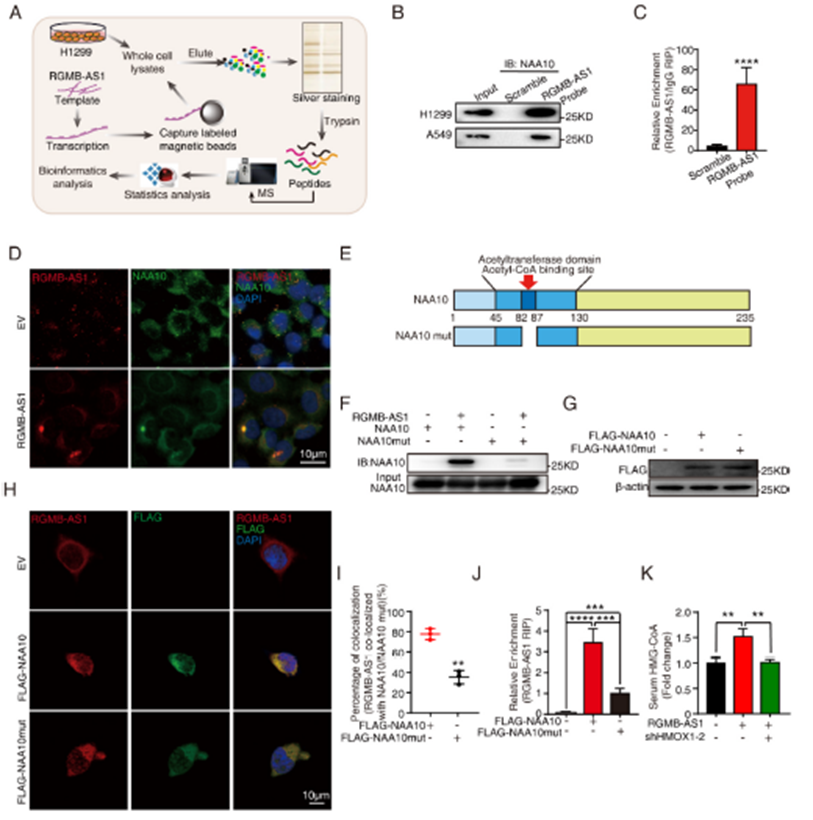
4)RGMB-AS1与NAA10结合促进NAA10活性
为了进一步探讨RGMB-AS1在促进肺癌细胞铁死亡中的作用,我们在非交联条件下进行了RGMB-AS1拉下实验,随后进行质谱分析以直接鉴定蛋白质(图4A)。在H1299和A549细胞中,通过体外转录的RGMB-AS1 RPD-MS结果,NAA10是肽段数量和序列覆盖率(11%)最高的前五个蛋白质之一。RGMB-AS1拉下实验能够共同拉下NAA10(图4B),NAA10 RNA免疫沉淀(RIP)也富集了RGMB-AS1(图4C),进一步证实了这种相互作用。通过RGMB-AS1的荧光原位杂交(FISH)和针对NAA10蛋白的免疫荧光(IF)染色,显示它们可能有一些机会相互作用(图4D)。为了进一步研究RGMB-AS1-NAA10相互作用,我们检查了NAA10与RGMB-AS1结合时的相互作用区域。通过删除NAA10的乙酰辅酶A结合位点(RRLGLA),这是其乙酰转移酶酶活性至关重要的一步(图4E),我们进行了RGMB-AS1的体外转录和NAA10(NAA10突变体)的原核蛋白纯化实验。我们发现,在RGMB-AS1拉下实验中,NAA10乙酰辅酶A结合位的删除(NAA10突变体)削弱了RGMB-AS1与NAA10的结合(图4F)。一致地,针对FLAG标签的RGMB-AS1 FISH和IF染色显示,RGMB-AS1与NAA10的共定位减少(图4G-I)。针对FLAG标签的NAA10 RIP和NAA10突变体过表达实验显示,乙酰辅酶A结合位的删除削弱了NAA10与RGMB-AS1的结合(图4J)。在RGMB-AS1过表达的肿瘤携带小鼠中观察到HMG-CoA水平增加,基于此敲低HMOX1可以恢复HMG-CoA水平(图4K)。综合这些结果表明,RGMB-AS1可以通过关键的乙酰辅酶A结合位点(RRLGLA)与NAA10结合,并通过促进乙酰辅酶A到HMG-CoA的转换来增加NAA10的活性。
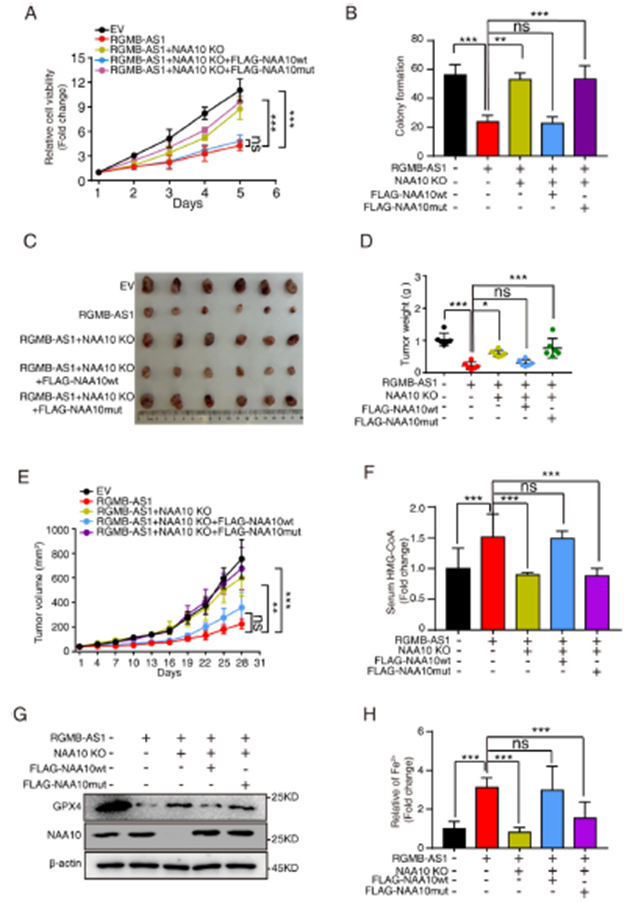
5)RGMB-AS1通过调节NAA10活性促进铁死亡
我们探讨了RGMB-AS1-NAA10轴在肿瘤进展中的作用。使用CRISPR/Cas9技术在H1299 RGMB-AS1过表达细胞中生成NAA10。NAA10敲除促进了RGMB-AS1过表达细胞中的细胞活力和集落形成,而额外的FLAG标签野生型NAA10过表达,而不是其突变体,恢复了这种效果(图5A和B)。同样,裸鼠皮下注射实验显示,RGMB-AS1过表达时的NAA10敲除促进了肿瘤生长,增加了肿瘤重量和Ki-67水平,而野生型NAA10过表达,但不是其突变体,恢复了这些效果(图5C-E)。在RGMB-AS1过表达细胞中敲除NAA10逆转了RGMB-AS1过表达引起的HMG-CoA水平增加。另一方面,野生型NAA10过表达,但不是其突变体,再次增加了总血清NAA10和HMG-CoA水平(图5F)。我们探讨了RGMB-AS1-NAA10轴是否调节铁死亡。在RGMB-AS1过表达细胞中敲除NAA10后,GPX4水平增加,Fe2+水平降低,表明RGMB-AS1-NAA10也参与调节铁死亡(图5G和H)。综合来看,RGMB-AS1与NAA10的相互作用对于体外和体内肿瘤进展至关重要,RGMB-AS1-NAA10可能通过与HMG-CoA相关的铁死亡发挥作用。
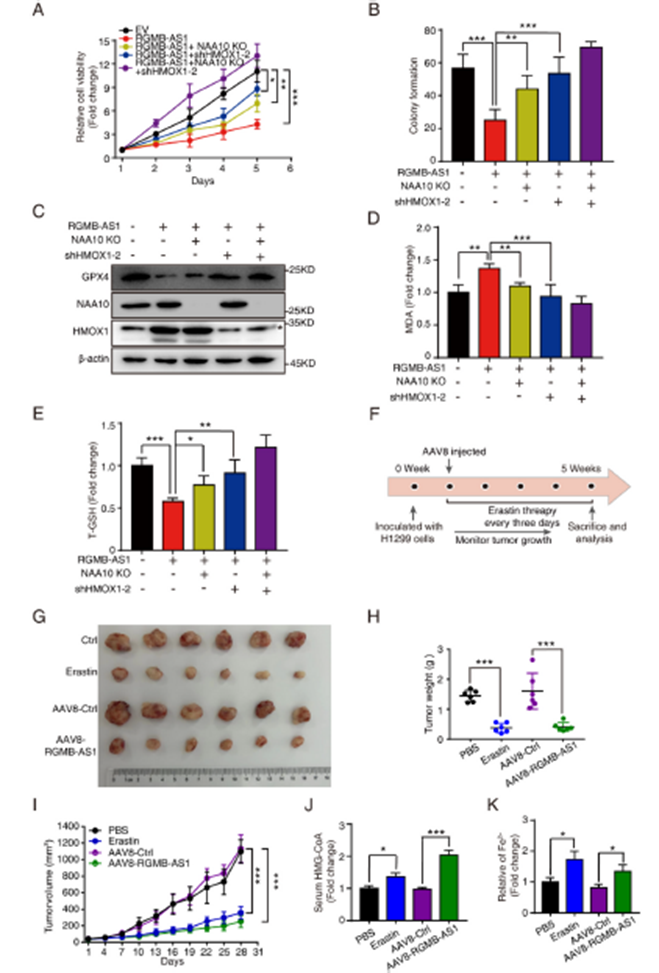
6)RGMB-AS1 通过依赖于HMOX1和NAA10的促进铁死亡机制抑制肿瘤进展
为了进一步深入了解RGMB-AS1调控HMOX1和NAA10以增强肺癌铁死亡分子机制,我们分别通过敲除NAA10、shRNA敲低HMOX1以及将两者结合的方式,在RGMB-AS1过表达细胞中评估了细胞活力和集落形成。结果显示,NAA10敲除和HMOX1敲低均部分逆转了RGMB-AS1过表达的效果,而它们的组合具有最显著的逆转效果(图6A和B)。在RGMB-AS1调节铁死亡的过程中,我们也观察到NAA10敲除和HMOX1敲低均部分削弱了铁死亡,它们的组合具有最显著的效果,恢复了GPX4、MDA和总GSH水平(图6C-E)。为了评估RGMB-AS1介导的铁死亡在体内的效果,我们向4周龄的裸鼠体内注射了表达RGMB-AS1的AAV8(AAV8-RGMB-AS1)或相应的对照(AAV8-Ctrl)。在感染5周后进行检查,AAV8-RGMB-AS1导致肿瘤生长受到抑制。使用铁死亡诱导剂Erastin进一步评估RGMB-AS1在铁死亡中的功能。用Erastin(30 mg/kg)每隔三天治疗肿瘤携带小鼠5周,也导致肿瘤生长显著抑制,与AAV8-RGMB-AS1治疗结果相当(图6F-I)。AAV-RGMB-AS1和Erastin处理后HMG-CoA显著增加(图6J)。同时,通过铁测定评估肿瘤异种移植物中Fe2+水平,结果显示AAV-RGMB-AS1和Erastin处理均显著增加了Fe2+水平(图6K)。这些结果表明RGMB-AS1是抑制肺癌肿瘤进展的关键因素,通过HMOX1和NAA10分别介导的两种途径诱导铁死亡。
结论:
我们揭示了RGMB-AS1介导的RGMB-AS1-HMOX1和RGMB-AS1-NAA10轴在非小细胞肺癌进展中诱导铁死亡的作用。更好地理解RGMB-AS1在生物学过程中的关键角色可能会导致新的癌症治疗策略。
实验方法:
CCK8、克隆形成实验、质谱、WB、pull down、qRT-PCR、Co-IP、FISH、RIP、脂质过氧化测定、肿瘤异种移植实验、ELISA、免疫组化、TEM。
参考文献:
Gao GB, Chen L, Pan JF, Lei T, Cai X, Hao Z, Wang Q, Shan G, Li J. LncRNA RGMB-AS1 inhibits HMOX1 ubiquitination and NAA10 activation to induce ferroptosis in non-small cell lung cancer. Cancer Lett. 2024 Apr 2;590:216826. doi: 10.1016/j.canlet.2024.216826.






