从脂肪干细胞到乳腺癌细胞的线粒体转移驱动多重耐药
乳腺癌(BC)是一种复杂的疾病,在遗传背景、分子亚型和治疗方法上都表现出异质性。以往的治疗策略一直针对癌细胞,但这些不是肿瘤体积的独特组成部分,其中肿瘤微环境(TME)起着关键作用,对其更好的理解对于获得更好的结果至关重要。作者通过MitoTracker实验、Mitoception、共聚焦和免疫荧光分析,评估了脂肪干细胞与不同乳腺癌细胞(BCCs)共培养的线粒体转移(MT)。MT抑制剂用于隧道纳米管(TNTs)的MT确认。采用多柔比星法和ABC转运蛋白法评价MT对耐多药(MDR)的影响。此外,通过耗氧率(OCR)和免疫印迹分析来测量ATP的产生。作者发现MT通过隧道纳米管(TNTs)发生,可以被肌动蛋白聚合抑制剂阻断。此外,在ASCs和患者来源的类器官之间的杂交共培养中,作者发现了大量MT。具有ASCs来源的线粒体(ADM)的乳腺癌细胞(BCCs)在缺氧条件下显示HIF-1α表达降低,ATP产生增加驱动ABC转运体介导的多药耐药(MDR),与氧化磷酸化代谢重新连接有关。作者提供了从脂肪干细胞(ASCs)到BC模型的线粒体转移(MT)发生的概念证明。阻断从ASCs到BCCs的MT可能是BC治疗的一种新的有效治疗策略。该文章于2024年6月发表在《Journal of experimental & clinical cancer research》,IF:11.4。

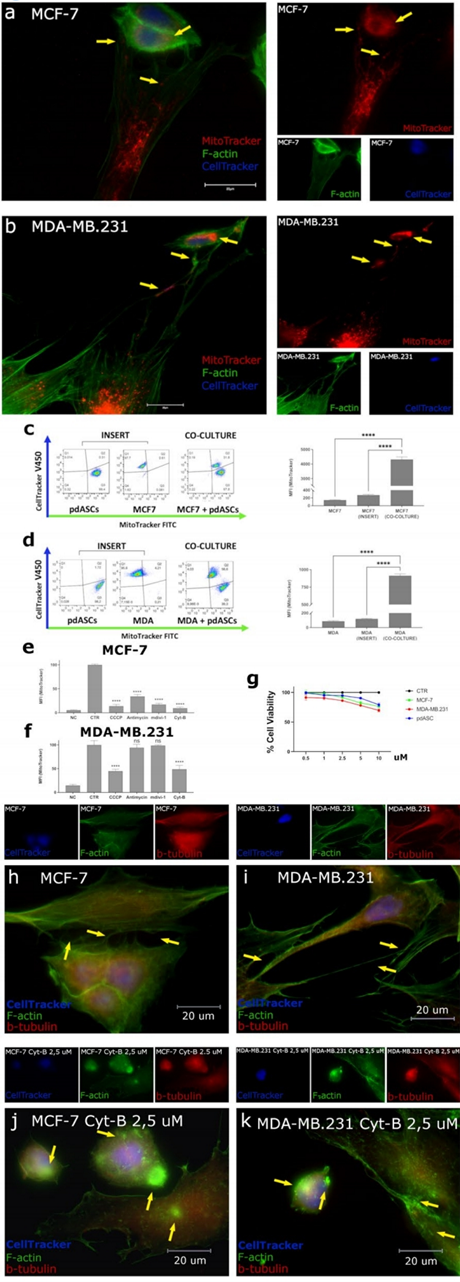
将pdASCs与luminal MCF7和三阴性MDA-MB.231共培养,评估MT。pdASCs从人脂肪组织中分离出来,作者发现pdASCs线粒体通过一个复杂的tnt通讯网络转移到BCCs。这些是pdASCs支架的细胞膜突起,f-肌动蛋白和β-微管蛋白阳性,整个长度上线粒体非常丰富。通过这些结构,pdASCs将其预标记的(MitoTracker-FITC/PE)线粒体运输到预标记的(CellTracker-DAPI) BCCs。在MCF-7(图1a)和MDA-MB.231中观察到外源性预标记线粒体(图1b),共培养24 h后(图1a-b黄色箭头),并通过FACS分析进行量化(图1c-d)。当细胞被多孔细胞培养插入物物理分离时,MT不会发生(图1c-d)。
随后,为了探索抑制MT的方法,作者用(i)羰基氰化物间氯苯基肼(CCCP 5µM)或(ii)Anti-Ycin- A(0.1µM),两种不同的线粒体呼吸抑制剂,(iii)线粒体分裂抑制剂-1(MdiVi-1 10µM),抑制Drp1,以及(iv)细胞松弛素B(Cyt-B 2.5µM),一种肌动蛋白聚合抑制剂来处理两种共培养模型。作者发现MdiVi-1和anti - ycin- a显著降低MCF-7中的MT。此外,CCCP抑制MT,但MCF-7(%MFI = 13.6%)的作用比MDA-MB.231更为明显(%MFI = 44.7%)(图1-f)。此外,肌动蛋白聚合抑制剂Cyt-B在亚致死剂量下阻断MT(图1g),尽管MCF-7更敏感(%MFI分别= 9.5%和48.7%)。
Cyt-B非常有效地抑制了TNTs支架(图1h-k),对细胞形态产生了巨大影响。确实,检测到细胞结构塌陷,外观更小,形状更圆,许多膜内陷,细胞质中积累了F-actin聚集体(图1j-k)。因此,细胞不能支撑基于肌动蛋白的TNTs不能相互接触,这阻碍了MT。
作者证实了MT也发生在pdASCs和患者源性乳腺癌模型BCAHC-1和BCC-66之间。有趣的是,作者观察到pdASCs和原代BCAHC-1细胞之间形成了TNTs,线粒体通过TNTs被输送到BCAHC-1细胞(图2a,黄色箭头);FACS分析也证实了这一机制(图2b)。此外,在亚致死剂量下,CCCP 5 µM显著降低了MT率,而Cyt-B(%MFI = 27.2%)的MT率更低(图2c-d)。值得注意的是,如前所述,Cyt-B阻断了由F-actin和β-Tubulin组成的tnt支架(图2e-f,黄色箭头)。这些深刻的形态学变化影响了细胞间的接触,显著降低了MT。

此外,作者研究了从一个腔内乳腺癌患者分离的BCC-66 PDOs的MT。作者初步发现BCC-66与原始患者组织具有相同的基因组图谱。根据作者之前的研究结果,作者在BME中分离的BCC-66和pdASCs之间建立了混合的2D/3D共培养。BCC-66能够接触到pdASCs,并从中大量获取线粒体(图2,黄色箭头),尽管作者没有捕获到tnt的形成。三维正交z叠图像重建证实,黏附的pdASCs直接接触悬液中的BCC-66(图2g,白色箭头)。流式细胞仪证实MT,但仅在细胞之间物理接触的情况下。相反,Cyt-B 2µM没有显著抑制MT(图2h),表明在这种2d /3D杂交共培养中,依赖于物理接触的其他机制可能介导MT。
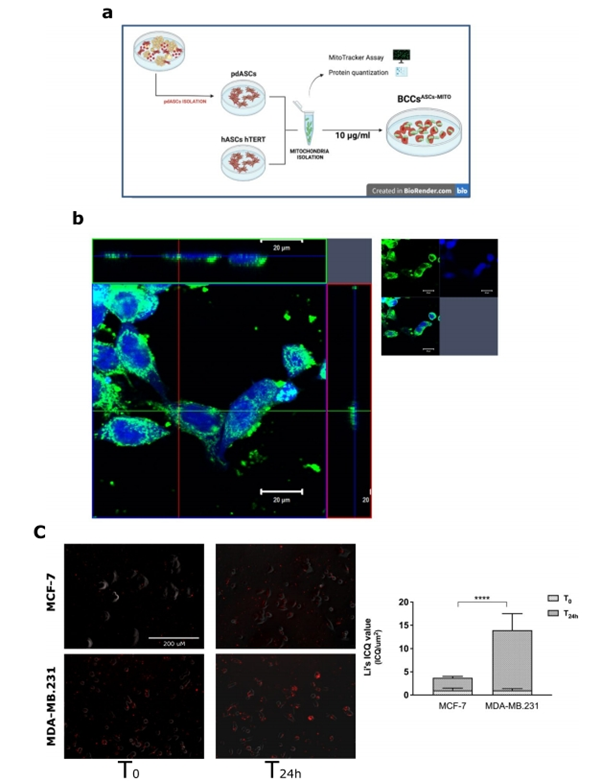
为了更好地区分转移到BCCs的外源线粒体的选择性作用,作者采用了MitoCeption(MCP),这是一种用于迫使线粒体内化的程序,来自供体细胞进入受体细胞,功能上吞噬并保留它们在其细胞质中。根据Caicedo等人的研究,作者从pdASCs和hTERT永生化hASCs中分离并鉴定了线粒体;然后作者将它们转移到MCF-7或MDA-MB。231个细胞(图3a)。24h后,通过共聚焦图像的z叠正交视图重建验证MCP。在这里,作者鉴定了pdASC预标记的线粒体(MitoTracker-red)在BCCs的细胞质中有空间分布(CellTracker-DAPI)(图3b)。通过统计分析转移的pdASCs线粒体与受体细胞之间的共定位,评估MCP效率,验证线粒体内化(图3c)。在24h(T24h)后,线粒体与细胞共定位,如非随机空间相关性分析所示。此外,MDA-MB.231明显比MCF-7更能摄取外源线粒体(图3c)。综上所述,作者的研究结果表明,MCP可以提高线粒体摄取的效率,MDA-MB.231比MCF-7获得更多的线粒体。
为了从功能上表征MT效应,作者研究了不同化疗药物对携带外源性线粒体的BCCs的抗肿瘤活性。考虑到MCP显著下调受体BCCs中HIF-1α蛋白的表达(图4a),作者决定在实验中采用这一条件。功能上,ASCs来源的线粒体(ADM)在24小时后显著降低了CIS(10µM)和DTX(50 nM)在两个BCC细胞系中的细胞毒性(图4b-c)。具体而言,ADM对MCF-7具有细胞保护作用,对CIS(> 15%)和DTX(> 11%)和缺氧(CIS > 33%)(图4b)。类似地,ADM保护MDA-MB。231例来自CIS(> 15%),缺氧时效果较轻(图4c)。dtx诱导的细胞毒性也有同样显著的结果,缺氧时的细胞毒性更强(60%)。有趣的是,携带adm的MCF-7获得DTX抗性是由于它们调节凋亡机制的能力,而作者没有观察到CIS处理后对该机制的调节有显著差异(图4d)。相反,在缺氧条件下,ADM对两种药物的细胞保护作用都非常强。作者在携带adm的MDA-MB.231中也发现了同样的效果(图4 e)。在这里,DTX强烈促进细胞凋亡,即使在缺氧情况下,adm介导的这一现象的显著逆转。综上所述,作者的研究结果表明,在缺氧和常氧条件下,ADM增加了BCCs的MDR,阻止了细胞凋亡的诱导。
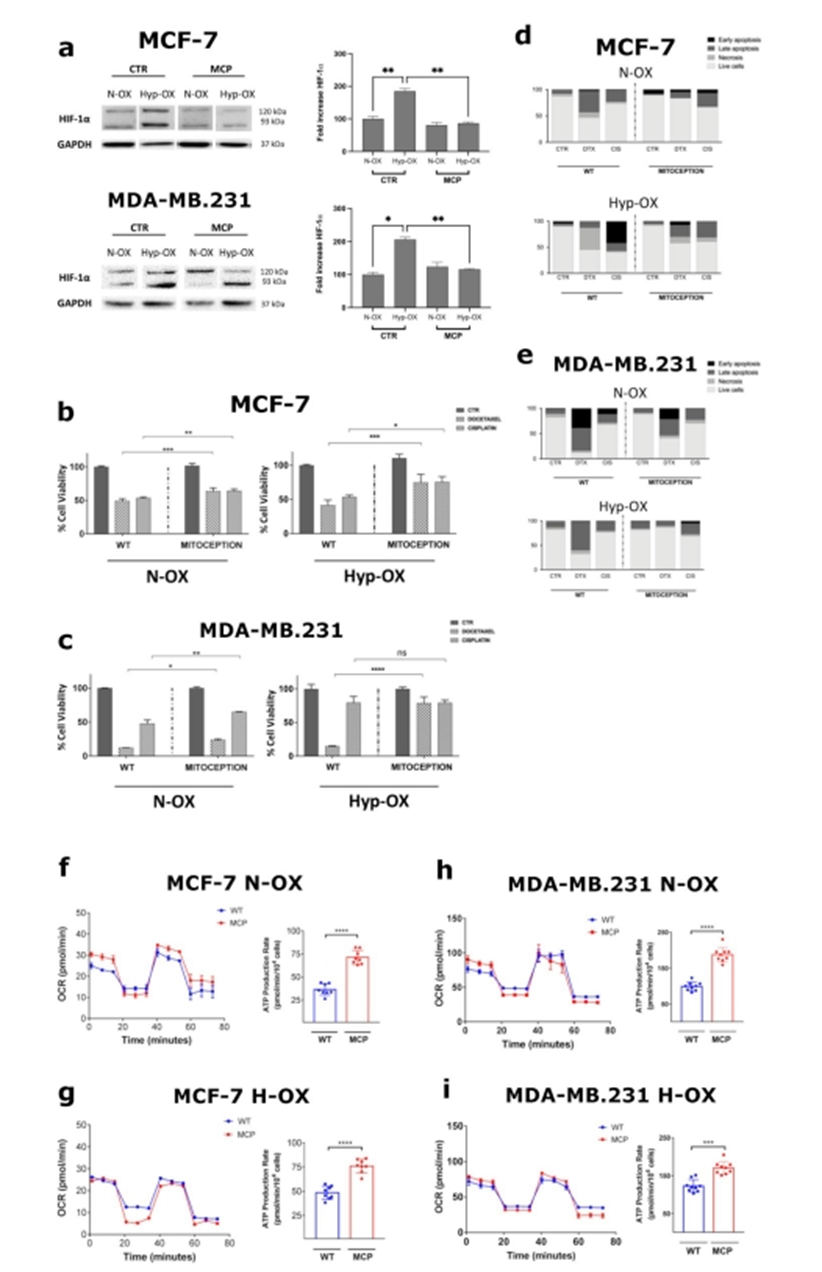
由于线粒体在能量稳态中起着关键作用,作者通过胞外通量分析评估了ADM对BCCs代谢的影响。在这里,ADM强烈上调ATP速率产生,与线粒体呼吸有关(ΔATP)。事实上,在携带ADM的MCF-7中,作者发现基础呼吸(OCR > 18%)和最大呼吸(OCR > 10%)显著增加,ATP生成速率相对增加(ΔATP > 35 pmol/min)(图4f)。此外,作者发现备用呼吸显著减少(OCR < 18%),主要是由于ADM介导的基础耗氧速率增加。相反,在缺氧情况下,ADM对基础呼吸和最大呼吸没有显著影响,但总耗氧能力提高,导致ATP产量相应增加(ΔATP > 27 pmol/min)(图4)。在MDA-MB.231 ADM对线粒体代谢的影响非常相似。在这些细胞中,MCP后基础呼吸显著增加(OCR为12%),而最大呼吸无显著差异(图4h)。即使在这种情况下,由于基础耗氧量增加,ADM显著降低了备用呼吸(OCR < 18%),导致ATP生成速率加倍(ΔATP > 90 pmol/min)。在缺氧MDA-MB.231 MCP后呼吸量和基础呼吸无明显变化(图4i)。然而,这两个参数都增加了(OCR > 12%),显著提高了ATP生成速率(ΔATP > 47 pmol/min)。综上所述,作者的结果表明,ADM导致ATP的产生增加。
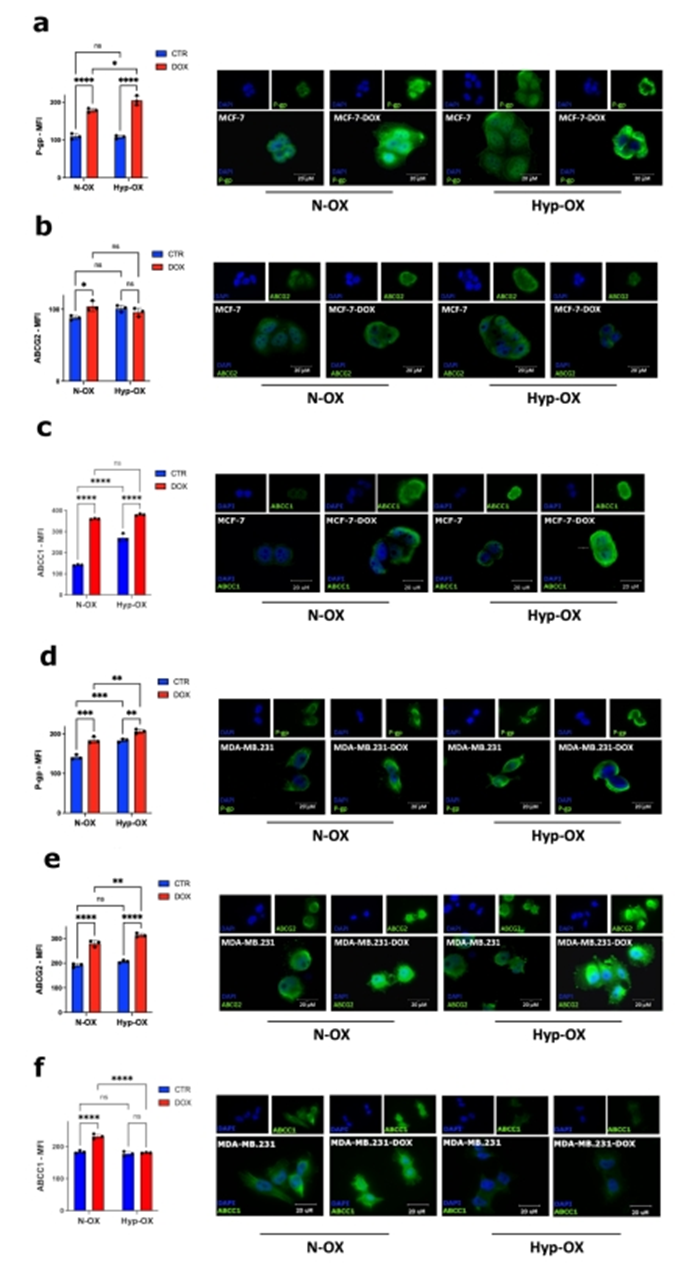
由于ATP结合盒(ABC)转运体参与BC MDR,作者评估了它们在MCP模型中的作用,在诱导缺氧8小时后,通过荧光显微镜和FACS,重点关注P-gp、ABCG2和ABCC1,随后用DOX治疗。作者选择DOX,一方面是利用其自身荧光的优势,另一方面是因为它是BC脑卒中化疗的支柱。在MCF-7中,作者观察到在两种氧条件下,DOX处理后P-gp和ABCC1表达增加,而ABCG2仅在常氧条件下DOX处理后升高(图5a-c)。在MDA-MB.231在DOX(两种氧条件下)和缺氧条件下P-gp表达增加。两种氧条件下,ABCG2均不受缺氧影响,仅在DOX处理下升高,而ABCC1仅在DOX处理后的常氧条件下升高(图5d-f)。
随后,作者将注意力集中在ADM对ABC转运蛋白活性的可能影响上。作者初步评估了MCP后DOX对BCCs的细胞毒性。事实上,它诱导了Holomonitor监测的细胞活力参数的增加,在缺氧情况下也是如此。在MDA-MB。作者在常氧条件下获得了相同的结果和缺氧(图6a-d)。之后,作者通过测量DOXMFI来评估DOX细胞质保留。正如预期的那样,ABC转运蛋白抑制剂VER增加了DOX细胞质积累。然而,ATP代谢在调节这些转运体的活性方面是至关重要的。事实上,在两种氧气条件下,ATP合成抑制剂鱼藤酮都能显著降低ABC转运体的外排能力,而这种作用被D-Glu显著逆转(图6e-h)。这些结果强调,ABC转运蛋白活性严格依赖于ATP的可用性,独立于细胞呼吸。
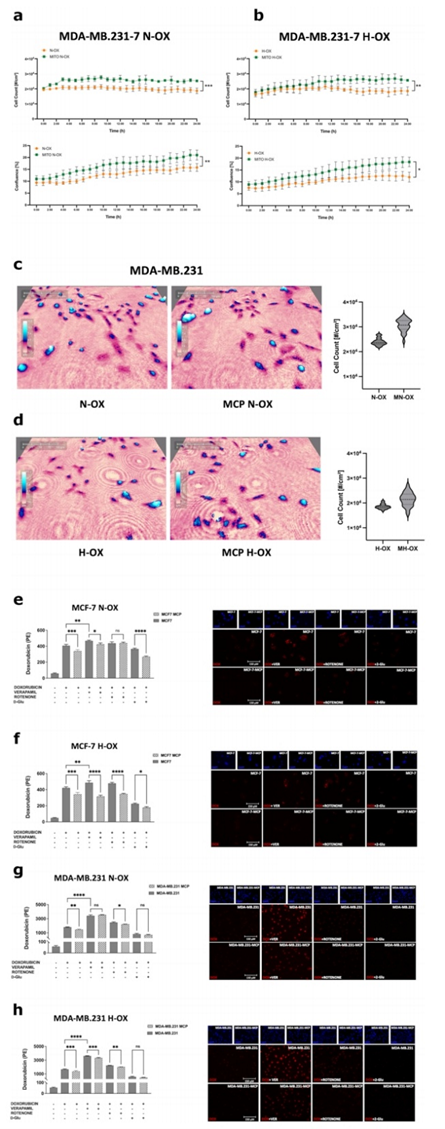
在携带ADM的MCF-7中,作者发现DOX积累减少(DOXMFI < 16%),即使在VER治疗后(DOXMFI < 9%),鱼藤酮治疗后无明显差异(图6e)。然而,D-Glu再次增强了ADM介导的效应(DOXMFI < 27%)。在缺氧时,MCP更有效。在这种情况下,作者证明ADM增加了药物外排率(DOXMFI < 18%),即使使用VER抑制ABC转运蛋白(DOXMFI < 35%)。有趣的是,虽然鱼藤酮介导的ATP合成阻断会影响细胞的解毒能力,但ADM显著地恢复了这种情况(DOXMFI < 27%);D-Glu治疗后效果相同(DOXMFI < 26%;图6f)。
在MDA-MB。作者发现ADM驱动DOX耐药。具体来说,ADM显著降低了DOX积累(DOXMFI < 18%),而VER组无显著影响。同样,鱼藤酮介导的DOX积累被MCP有效抵消。在MDA-MB.231 MCP在缺氧时的作用更为明显。在这种情况下,DOX细胞质水平显著降低(DOXMFI < 18%),给药后DOXMFI < 8%)。此外,鱼藤酮处理后,MCP对ABC转运蛋白活性的调节是明显的,但与D-Glu无关(图6g-h)。考虑到所有这些结果,作者发现ADM激活了ABC转运蛋白进入MCF7和MDA-MB.231,导致细胞质内药物积累的显著减少和逃避化疗诱导的细胞毒性。
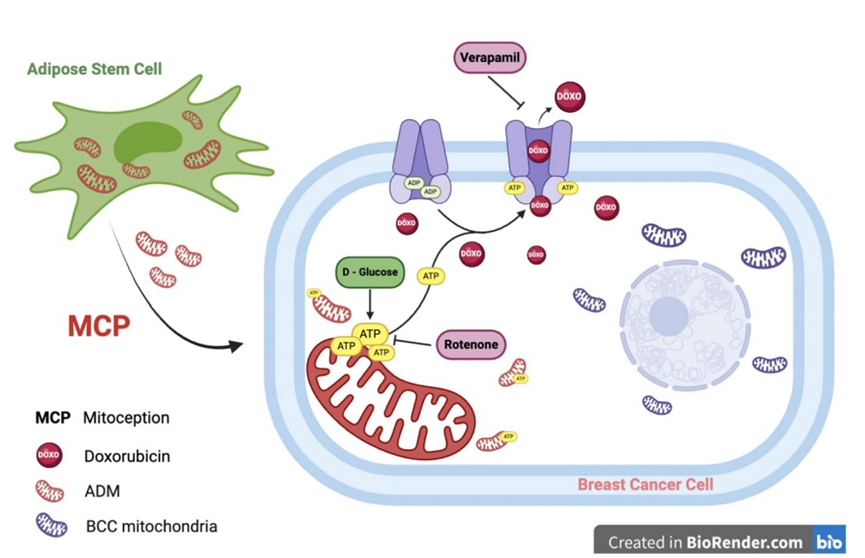
具体来说,作者证明了MCP代谢促进BC受体细胞,导致细胞内ATP增加,ATP是ABC转运体的直接分子激活剂。这些外排泵在BCCs MDR中发挥着关键作用,正如作者的模型所证明的那样,作者发现在两种氧气条件下,通过选择性地用VER阻断ABC受体,细胞内DOX显著增加。作者的研究结果表明,摄取ADM后产生的ATP增加是BCCs中ABC受体外排的关键调节剂。事实上,当作者用鱼藤酮阻断ATP合成时,作者看到DOX细胞质保留增加,表明ABC转运蛋白功能下调。另一方面,给药D-Glu逆转了这种抑制,重新激活ABC外排活性(图7)。
总之,作者首次证明MT促进广泛的BCCs变化,导致更耐药的表型。作者发现pdASCs与BCCs相互作用,提供它们自己的线粒体。这种MT与细胞结构重塑密切相关,这使得物理细胞-细胞接触成为可能。这一机制驱动了受体癌细胞的许多功能效应,这些效应受益于这一过程。事实上,作者发现这些细胞改善了它们对细胞外环境的适应性反应,增加了线粒体呼吸和相对的OXPHOS,上调了ABC转运蛋白活性,从而获得了一种更好地逃避抗癌治疗的表型。有趣的是,作者还在更准确和可翻译的体外模型中证明了MT,这些模型再现了起源组织的一些关键方面。此外,作者首次发现抑制MT可以有效地恢复对化疗的敏感性,使其成为开发创新治疗策略的新潜在靶点。需要进一步的研究来更好地阐明癌细胞吸引外源线粒体的其他途径的发生,但这项研究为乳腺癌的新治疗开辟了道路,无论是通过阻断从ASCs到BCCs的MT机制,还是通过抑制间充质干细胞与肿瘤细胞之间的相互作用。
下一代测序(NGS),荧光和共聚焦显微镜,免疫印迹,细胞和细胞培养,脂肪干细胞分离,线粒体转移共培养模型,阿霉素测定,细胞活力测定,流式细胞术,细胞外通量分析,患者来源类器官的生成
Del Vecchio, V., Rehman, A., Panda, S. K., Torsiello, M., Marigliano, M., Nicoletti, M. M., Ferraro, G. A., De Falco, V., Lappano, R., Lieto, E., Pagliuca, F., Caputo, C., La Noce, M., Papaccio, G., Tirino, V., Robinson, N., Desiderio, V., & Papaccio, F. (2024). Mitochondrial transfer from Adipose stem cells to breast cancer cells drives multi-drug resistance. Journal of experimental & clinical cancer research: CR, 43(1), 166. https://doi.org/10.1186/s13046-024-03087-8






