Deciphering the nucleotide metabolomics in patients with post-COVID-19 condition and type 2 diabetes mellitus
肝细胞癌(HCC)起源于慢性炎症,肝星状细胞(HSC)的激活通过形成促肿瘤微环境起作用。这个过程的关键是p62,它的失活导致肝癌的发生。在这里,作者发现p62通过促进HSC中STING泛素化(TRIM32)激活干扰素(IFN)级联。p62是BRCA1基因1(NBR1)和STING的结合邻居,通过取代NBR1触发IFN级联,而NBR1通常会阻止TRIM32与STING的相互作用及其随后的激活。此外,NBR1还通过促进STING转运到内溶酶体室进行独立于自噬的降解来拮抗STING。与功能相关的是,NBR1缺失通过挽救被抑制的STING-IFN通路,完全恢复p62缺陷HSC的促瘤功能,从而增强CD8+ T细胞介导的抗肿瘤反应。因此,通过促进STING/IFN通路,NBR1作为HSC中p62缺乏的合成易感性出现,该通路可增强抗肿瘤CD8+ T细胞反应,从而抑制HCC进展。该文章于2024年10月发表在《Molecular cell》,IF:14.5。
摘要图:

主要研究结果:
1. NBR1失活损害p62缺乏驱动的增强的肝脏肿瘤发生
由于p62的全身消融促进小鼠的肝癌发生,并且NBR1与p62相互作用,作者假设NBR1可能在p62缺乏增强体内肝脏肿瘤发生的能力中发挥作用。为了验证这一假设,在2周龄时给NBR1 (NBR1 -/-)、p62 (Sqstm1-/-)或双p62/NBR1 (Sqstm1-/- NBR1 -/-)的野生型(WT)和全身敲除型(KO)小鼠注射肝脏致癌物二乙基亚硝胺(DEN),并喂食高脂肪饮食(HFD)(图1A),遵循有充分记录的方案,在小鼠中诱导肝脏和腺瘤和HCC 与作者之前的观察结果一致,通过肝体重比、肿瘤总数、大肿瘤数量(> 3mm)或Afp mRNA水平以及具有HCC组织学的肿瘤比例(图1B-1G)来确定,16只p62缺陷小鼠与WT相比,肿瘤发生增加。虽然Nbr1-/-小鼠没有表现出显著的表型(图1B-1G),但Sqstm1 -/-Nbr1-/-小鼠恢复了由p62缺失驱动的肿瘤进展增加(图1B-1G和S1A)。这些发现表明,NBR1在由全身p62缺乏驱动的肝肿瘤恶性增强中起关键作用。由于Sqstm1-/-肝脏的致瘤前表型是由于产生了有利于HCC的TME,因此通过肝内注射将来自DEN + HFD处理小鼠的肿瘤的侵袭性同基因HCC细胞系(DihXD3)移植到WT、Sqstm1-/-、Nbr1-/-和Sqstm1-/-Nbr1-/-小鼠中(图1H)。四周后,与Sqstm1-/-小鼠相比,DihXD3细胞在Sqstm1-/-小鼠肝脏中产生的原发性肿瘤更少(图1I、1J和S1B),这表明NBR1的缺失逆转了p62全身消融产生的致瘤性肝脏TME。基于作者之前的观察,证实了HSC间室p62缺失是TME的一个重要因素,16作者假设NBR1缺失的影响也可能归因于NBR1在HSC中以前未被认识到的作用。为了验证这种可能性,将从WT、Sqstm1-/-、Nbr1-/-或Sqstm1-/- -Nbr1-/-小鼠中分离的造血干细胞与DihXD3细胞一起植入先前喂食HFD 2个月的WT小鼠肝脏中(图1K)。与作者的假设一致,植入DihXD3 + Sqstm1-/- HSC的肝脏肿瘤比植入DihXD3 + WT HSC的肝脏肿瘤大,而植入DihXD3 + Sqstm1-/- NBR1 -/- HSC的肝脏肿瘤发生减少(图1L、1M)。与植入DihXD3 + WT HSC的肝脏相比,植入DihXD3 + Nbr1-/- HSC的肝脏肿瘤发生减少(图1L、1M)。将DiHXD3细胞植入HSC中选择性缺失NBR1的小鼠肝脏(Nbr1f/f; gmap - cre),与对照组(Nbr1f/f)小鼠相比,肿瘤负荷显著降低(图1N-1P)。这些结果表明,与p62相反,HSC中NBR1的缺乏会损害HCC的发展,并逆转p62消融在HSC中的促瘤作用。
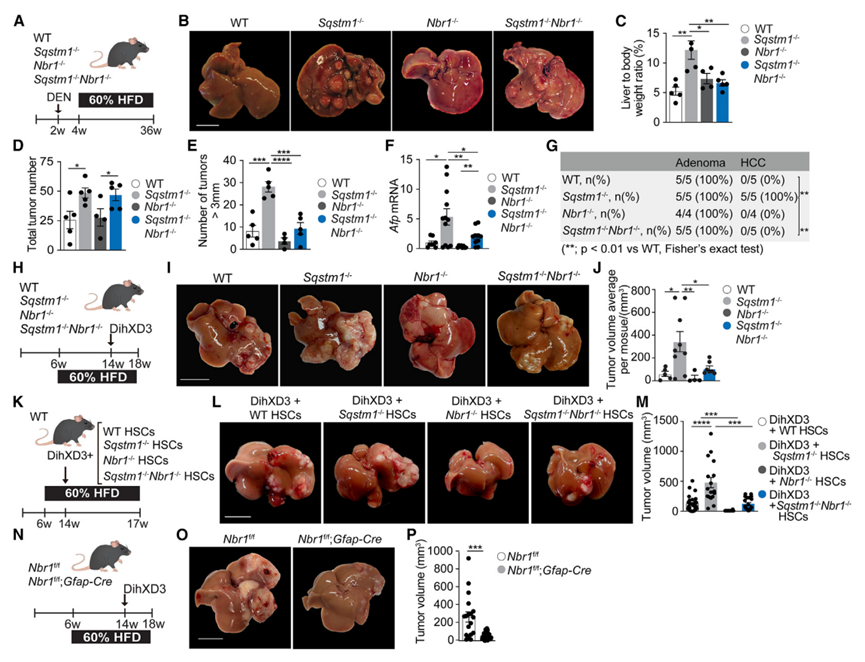
图1 NBR1失活损害p62缺乏驱动的增强的肝脏肿瘤发生
2. NBR1和p62在造血干细胞中拮抗调节IFN通路
为了阐明NBR1和p62调控的信号通路,解释它们在HCC中的不同作用,作者进行了基因集富集分析(GSEA)和基因集变异分析(GSVA),比较了WT、NBR1 -/-、Sqstm1-/-和Sqstm1-/- NBR1 -/- HSC的转录组。作者发现,与WT型HSC相比,Nbr1-/-中与IFN通路激活相关的信号显著上调,这些信号在Sqstm1-/- HSC中被抑制,在Sqstm1-/-Nbr1-/- HSC中恢复(图2A-2C)。这些观察结果通过几个IFN刺激基因的qPCR进一步验证(图2D)。免疫组织化学分析显示,在同时缺失Nbr1的Sqstm1-/- HSC的肝脏中,pSTAT1 (IFN激活的一个指标)减少(图2E-2G)。在共移植或内源性HSC特异性小鼠模型中,Nbr1的缺失足以释放IFN的高pSTAT1染色(图2E-2J)。与HSC中p62或NBR1缺失导致的IFN通路的相反调控一致,作者发现Sqstm1-/- HSC模型的肝肿瘤中CD8+ T细胞缺失,NBR1缺失能够通过促进CD8+ T细胞浸润增加来挽救这种表型(图2E-2J)。
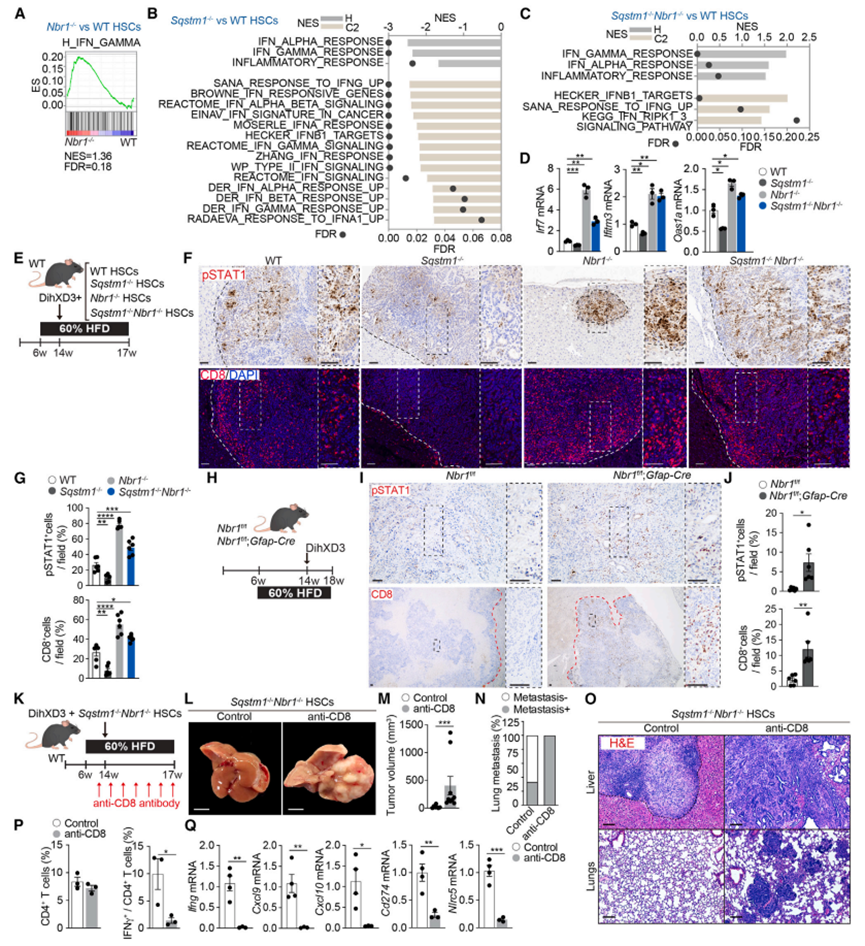
图2 NBR1和p62在造血干细胞中拮抗调节干扰素通路
3. HSCs中NBR1缺失产生的肿瘤保护反应是由CD8+ T细胞介导的
与CD8+ T细胞和IFN反应是TME中关键的抗癌元件一致,中和了抗CD8抗体,有效地消耗了大约90%的肿瘤浸润性CD8+ T细胞,恢复了由Sqstm1-/- NBR1 -/- HSCs存在引起的肿瘤发展抑制(图2K和2L)。肿瘤体积明显增大(图2M),抗cd8处理小鼠均出现肺转移(图2N、图2O)。流式细胞术和转录分析显示,CD8+ T细胞的缺失完全恢复了Sqstm1-/- NBR1 -/- HSC产生的IFN相关免疫反应(图2P和2Q)。这种反应与免疫抑制细胞或其他免疫细胞群的募集无关。这些结果表明,p62缺陷造血干细胞中NBR1的缺失诱导了依赖于IFN级联的CD8+ T细胞介导的抗肿瘤反应。
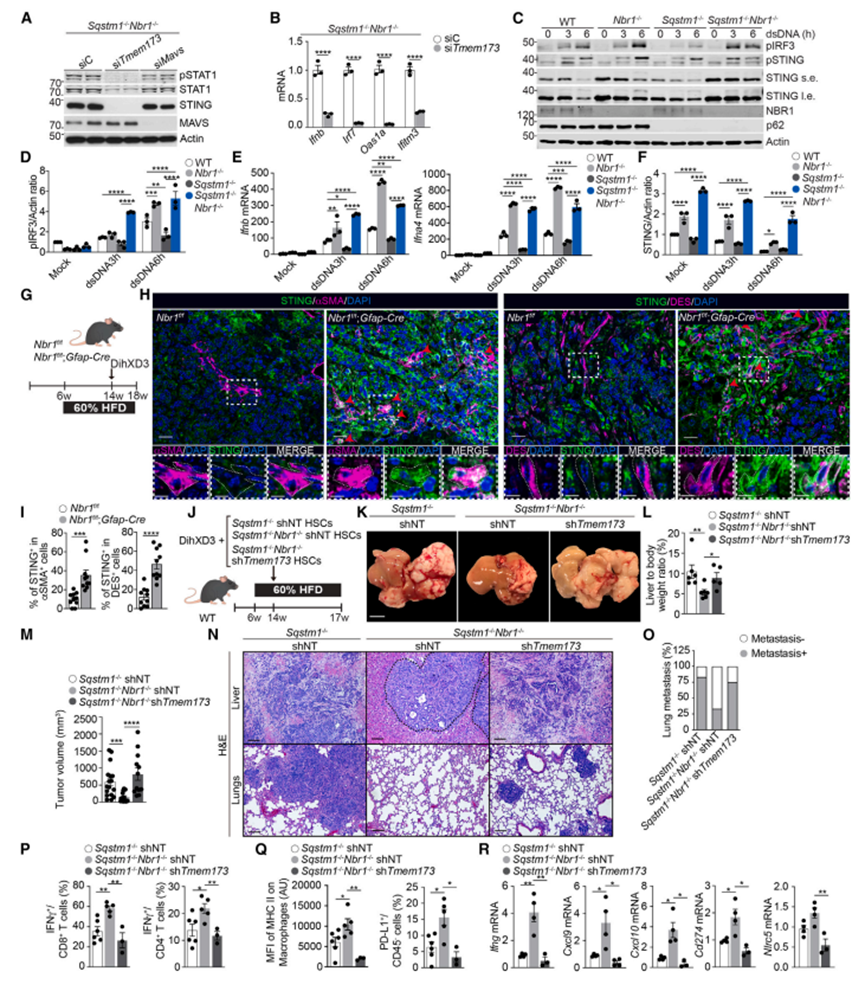
图3 STING对造血干细胞中NBR1缺失的抗肿瘤活性至关重要
4. NBR1和p62对STING介导的IFN通路具有相反的调控作用
激活IFN通路的两种主要机制包括cGAS/STING和RIG-I/MAVS级联,它们分别是由细胞质中双链DNA (dsDNA)或双链RNA (dsRNA)的存在诱导的为了研究这两种信号通路对NBR1缺失驱动的表型的贡献,作者分别通过敲除Sqstm1-/- NBR1 -/- HSC中的STING (Tmem173基因)或MAVS来靶向这两种机制。敲低STING可降低Sqstm1-/- NBR1 -/- HSC中pSTAT1和STAT1水平,并降低ifn相关基因的表达,而敲低MAVS则无影响(图3A和3B)。通过干扰素调节因子3 (IRF3)的磷酸化确定,用dsDNA处理不同基因型的HSC导致STING信号级联的更强激活,与WT HSC相比,Nbr1-/和Nbr1-/-Sqstm1-/- HSC中干扰素调节因子3 (IRF3)的磷酸化在Sqstm1-/- HSC中显著降低(图3C和3D)。代表性ifn应答基因在Nbr1-/和Nbr1-/-Sqstm1-/- HSC中表达增强,但在Sqstm1-/- HSC中表达受损(图3E)。用环GMP-AMP (cGAMP)刺激,一种直接的STING激动剂,复制了Nbr1-/- HSC中IFN激活的增强和Sqstm1-/- HSC中IFN信号的受损(图S3A和S3B),证明了Nbr1和p62对STING的直接作用独立于cGAS。与WT型HSC相比,Nbr1-/和Nbr1-/-Sqstm1-/- HSC显示未磷酸化和磷酸化的STING水平升高,而Sqstm1-/- HSC则没有(图3C和3F)。体内内源性Nbr1缺失后,造血干细胞中STING水平也升高(图3G-3I)。这些结果表明,尽管NBR1和p62通过STING拮抗IFN通路,但它们可能利用不同的机制。与此一致的是,NBR1过表达(NBR1 OV细胞)导致STING水平降低和IFN激活降低,而p62过表达(p62 OV细胞)增强了IFN通路的激活,但不改变STING含量。这表明虽然NBR1通过调节STING水平影响IFN通路,但p62使用不同的机制。
5. STING对造血干细胞中NBR1缺失的抗肿瘤活性至关重要
基于这些结果,作者假设Sqstm1-/- NBR1 -/- HSC的致瘤活性降低可能与STING介导的IFN级联上调有关。在Sqstm1-/- NBR1 -/- HSC中,STING的敲低会损害pSTAT1的激活和Ifnb的表达。将STING缺陷HSC与DihXD3细胞共植入hfd喂养的WT小鼠的肝脏,在p62失活的情况下,NBR1缺陷的肿瘤抑制活性得以恢复(图3J – 3O)。这种被拯救的表型包括肺转移发生率的增加,其程度与Sqstm1-/- shNT细胞相当(图3N和3O)。流式细胞术分析CD45+浸润细胞的结果显示,DihXD3与Sqstm1-/- NBR1 -/- shNT共植入造血干细胞时,IFNg的产生比与Sqstm1-/- shNT共植入造血干细胞时更多,以CD8+ T细胞为主,CD4+ T细胞较少(图3P)。与这种增强的IFN反应一致,与Sqstm1-/- NBR1 -/- shNT细胞相比,Sqstm1-/- shNT造血干细胞显著增加了巨噬细胞表面主要组织相容性链II (MHCII)的表达,以及表达程序性死亡配体1(PD-L1)的非免疫细胞的百分比(图3Q)。在Sqstm1-/- NBR1 -/- shNT造血干细胞形成的肿瘤中,几个IFN相关基因也有所增加(图3R)。这些结果表明,p62缺陷造血干细胞中NBR1的缺失通过STING/ IFN依赖机制促进抗肿瘤免疫反应。
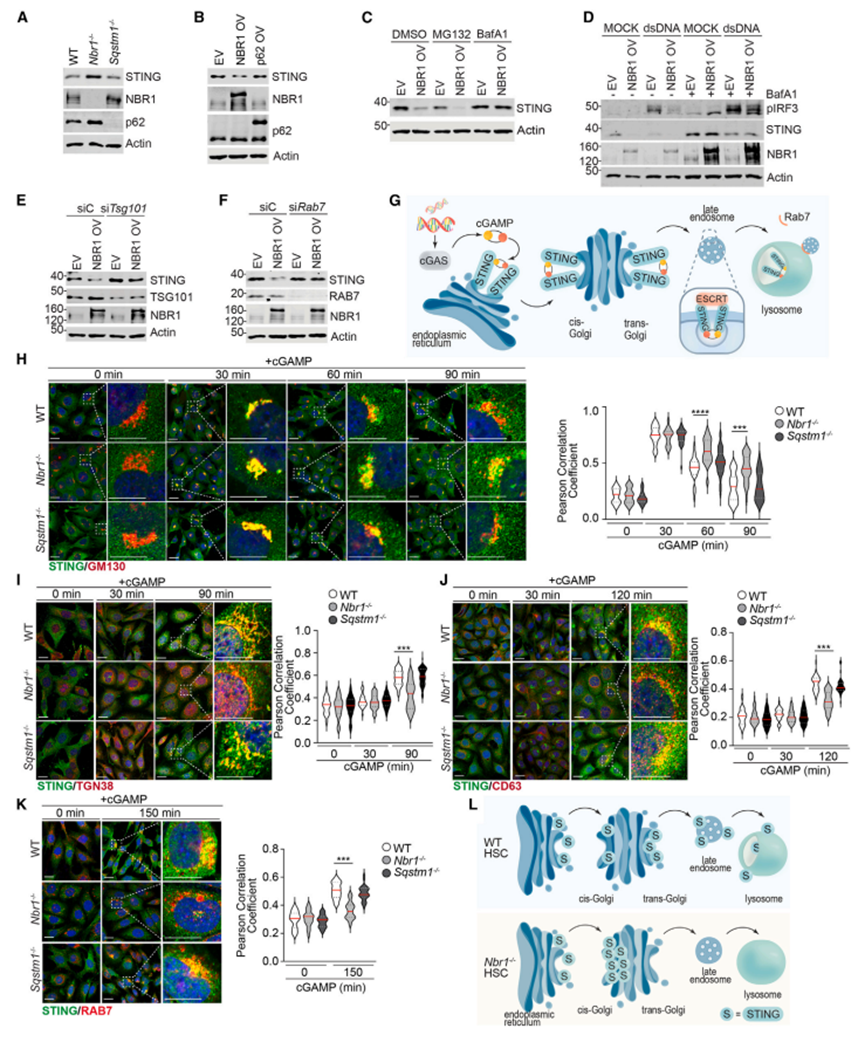
图4 NBR1而非p62通过控制其从高尔基体到溶酶体的运输来调节STING蛋白水平
6. NBR1而非p62通过溶酶体运输调节基础STING水平
作者的研究结果表明,Nbr1-/- HSC,而不是Sqstm1-/- HSC,具有更高的基础STING水平,并且Nbr1的过表达,而不是p62,诱导STING蛋白量的减少,独立于转录(图4A和4B)。因此,作者假设NBR1在介导STING蛋白水解中具有潜在的选择性作用。为了确定NBR1诱导STING降解的主要途径,作者用蛋白酶体(MG132)或溶酶体(巴菲霉素A1 [BafA1])抑制剂处理NBR1过表达(OV)和对照空载体(EV)造血干细胞。BafA1而不是MG132可以抑制NBR1诱导的STING降解(图4C)。BafA1处理不仅阻断了STING降解,还恢复了NBR1 OV细胞中pIRF3的激活(图4D),支持STING溶酶体降解在NBR1控制IFN通路中的重要性。

图5 NBR1和p62的竞争性结合调控STING信号传导
货物可以通过三种主要的降解途径递送到溶酶体:巨噬、内体微自噬和伴侣介导的自噬(CMA)。为了确定这些机制对NBR1诱导的溶酶体介导的STING降解的贡献,作者使用特定的小干扰RNA (siRNA)选择性地靶向每个途径的关键组分:Atg5(大自噬)、Lamp2a (CMA)、Tsg101(运输所需的内体分选复合体[ESCRT]/内体微自噬)和Rab7(参与从内体到溶酶体运输的GTPase)。虽然Atg5或Lamp2a的敲低并不影响NBR1诱导的STING降解,但Tsg101或Rab7的敲低显著消除了这种影响(图4E和4F),这表明NBR1促进STING降解的机制主要涉及escrt依赖性溶酶体途径。这些结果与先前的报告一致,表明STING水平主要由escrt驱动的微自噬途径控制。
根据该模型,cGAMP与STING结合触发其从内质网(ER)向顺高尔基体、反式高尔基网络和核内体的易位。一旦STING到达核内体,它通过ESCRT内化成多泡体(MVBs)。rab7介导的MVBs与溶酶体融合后,STING在酸化的溶酶体环境中被降解(图4G)。接下来,作者确定了NBR1是否在IFN通路激活期间调节STING从内质网到内溶酶体的运输。NBR1或p62基因失活不影响cgamp触发的STING从内质网到高尔基体的转运(图4H)。然而,NBR1缺乏症阻碍了STING从高尔基体的出口,导致其长时间滞留在这个细胞隔室中(图4H)。STING在高尔基体停留时间的延长可能促进了TANK结合激酶1(TBK1)和IRF3的募集和磷酸化,从而促进了NBR1缺陷造血干细胞中IFN信号的增强。一致地,作者发现STING向反式高尔基网络(图4I)以及其他后高尔基区室(如晚期核内体(图4J)和rab7阳性区室(图4K)的进展延迟,这也解释了NBR1缺失的HSC中STING降解的减少。相比之下,p62缺失并不影响STING从内质网向不同细胞区室的运输(图4H-4K),这与p62缺失不改变STING水平的事实是一致的(图4A和4B)。因此,这些结果表明,NBR1驱动STING及时从高尔基体中退出,确保了基础STING的适当稳态降解(图4L)。
7. NBR1和p62的竞争性结合调控STING信号传导
考虑到p62和NBR1在STING介导的IFN通路中的拮抗作用,以及p62不会改变STING的基础水平,作者接下来研究了它们在调节STING信号传导中的潜在作用。在过表达蛋白的共免疫沉淀实验中,NBR1和p62与STING相互作用。在基础条件下,NBR1与STING的结合强于p62。然而,cGAMP刺激在p62募集的同时促进了NBR1与STING的分离,其动力学与IFN通路激活的动力学一致。在造血干细胞中,内源性蛋白的免疫沉淀(图5A和5B)、免疫荧光实验中的共定位(图5C和5D)以及邻近结联实验(图5E和5F)也观察到了NBR1和p62与STING在cGAMP刺激下的动态相互作用。这些实验表明,NBR1在基础条件下与STING结合,但在cGAMP刺激下释放。相比之下,cGAMP促进p62与STING的结合。与该模型一致,NBR1在内质网与STING共定位,而cGAMP刺激后在ESCRT检测到p62-STING共定位,分别用ER和ESCRT的标志物Calnexin和HGS进行免疫荧光检测。这表明p62和NBR1与STING的相互作用可能是互斥的。事实上,共转染实验表明,p62过表达破坏了基础NBR1-STING复合物的形成(图5G),这表明p62和NBR1在与STING相互作用方面存在竞争。与该模型一致,p62缺陷导致NBR1与STING的组成性结合,这与IFN激活的损伤相关(图5H)。通过共免疫沉淀实验和免疫荧光共定位检测,cGAMP刺激触发了时间依赖性的NBR1-p62相互作用(图5I和5J)。由于它们各自的PB1结构域介导p62和NBR1的相互作用,作者突变了p62的PB1结构域(K7A)和NBR1的PB1结构域(D50R),并证明它破坏了它们与STING的相互作用。然而,删除泛素相关(UBA)结构域或其他结构域并不影响这些相互作用。这些结果支持了一个模型,即NBR1与STING的结合被p62的诱导募集破坏,p62取代了NBR1(图5K)。与此一致的是,顺序共免疫沉淀实验显示,在cGAMP刺激下,p62、NBR1和STING没有三聚体复合物,与STING结合的p62复合物不包括NBR1(图5L)。
8. NBR1和p62在STING寡聚化中的相反作用
作图实验表明,STING的二聚化结构域都需要与NBR1和p62结合(图5M)。在cGAMP刺激下,p62的缺失会破坏STING寡聚化,而Nbr1-/- HSC在基础和刺激条件下显示出增加的STING寡聚化(图5N和5O)。由于STING的二聚化对其激活至关重要,31这些结果与Nbr1-/和Sqstm1-/- HSC在STING信号传导上的相反表型一致。与此相一致的是,位于STING二聚体界面(人类STING中为N154S,小鼠STING中为N153S)的与婴儿期起病的STING相关的血管病变(SAVI)患者相关的功能获得突变降低了STING与NBR1的结合(图5P)。这些结果支持NBR1在STING介导的IFN信号传导中的负作用,通过控制STING基础水平并阻止其在cGAMP刺激下的激活和寡聚化,而p62在cGAMP刺激下取代NBR1并促进STING寡聚化及其激活。
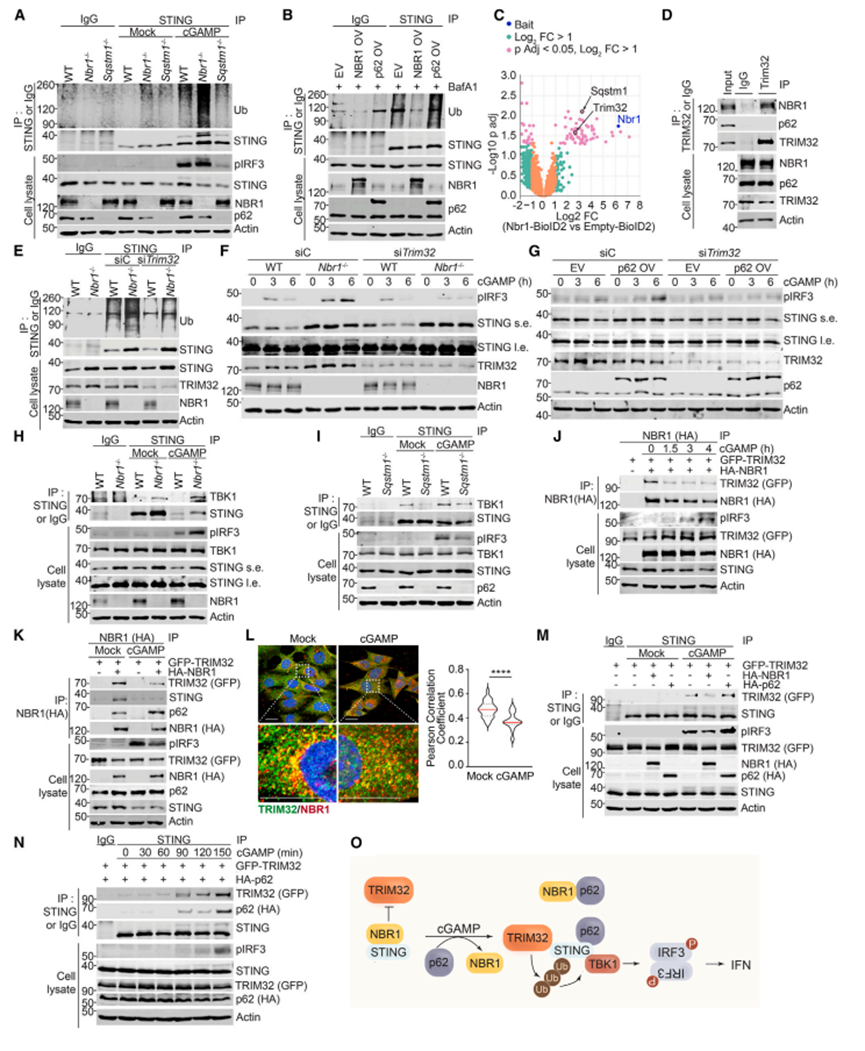
图6 NBR1和p62通过TRIM32调控STING泛素化
9. NBR1和p62通过TRIM32调控STING泛素化
鉴于泛素化在STING激活中的关键作用,作者接下来研究了NBR1和p62对其的潜在调控。与之前的报道一致,cGAMP刺激促进了STING的泛素化,在Nbr1-/中增强,而在Sqstm1-/- HSC中降低,同时激活了pIRF3(图6A)。一致地,NBR1的过表达抑制了STING泛素化,而p62的过表达促进了STING泛素化(图6B)。STING在k63链中泛素化。以NBR1为诱饵,通过邻近依赖生物素化试验(BioID2)进行无偏筛选,发现E3泛素连接酶三方基序蛋白(TRIM32)是NBR1的相互作用伙伴(图6C)。这在异位表达HEK293细胞的共免疫沉淀实验和造血干细胞的内源性免疫沉淀实验中得到证实,表明TRIM32通过其UBA结构域优先结合NBR1而不是p62(图6D)。Trim32敲低抑制了NBR1缺陷细胞中增强的STING泛素化和IFN信号传导(图6E和6F),证明了NBR1-TRIM32相互作用的功能相关性。TRIM32缺失严重损害了p62 OV细胞中增强的pIRF3诱导(图6G)。TRIM32-缺陷细胞没有显示出STING含量的改变(图6F和6G),表明TRIM32不控制STING降解,这与TRIM32促进k63泛素化这一通常不是降解信号的事实一致。与此一致的是,TRIM32敲低后,STING的溶酶体运输没有变化。TRIM32水平在NBR1缺陷细胞中上调,这表明,与STING的情况一样,NBR1也控制着TRIM32的稳态基础水平(图6E和6F)。这些发现确立了TRIM32在NBR1和p62拮抗调节STING介导的IFN信号传导机制中的关键作用。
先前的数据表明,TRIM32介导的STING泛素化促进了TBK1-STING相互作用,这是STING介导的IFN激活的关键步骤与NBR1和p62对STING泛素化的相反作用一致,NBR1的缺失增加,p62的缺失损害了TBK1与STING的结合(图6H和6I)。通过绘制TRIM32诱导的STING泛素化位点,很明显,STING泛素化缺陷突变体不与TBK1相互作用,但对其与NBR1或p62的相互作用没有影响。另一方面,在Nbr1-/-细胞中观察到的STING- tbk1相互作用增强与TRIM32向STING募集增加相关,而在Sqstm1-/-细胞中则受损,这表明p62通过与TRIM32相互作用促进STING泛素化的关键作用,即使在Nbr1缺失的HSC中,TRIM32也不直接与p62相互作用(图6D)。
作者的数据预测NBR1阻止TRIM32促进STING泛素化。cGAMP刺激使NBR1与TRIM32分离,这一事实支持了这一观点(图6J-6L)。与作者的假设一致,NBR1过表达破坏了TRIM32与STING之间的相互作用(图6M),表明NBR1负调控TRIM32-STING复合物的形成,阻碍了STING泛素化。p62的逐渐募集导致NBR1与STING的分离,促进了TRIM32随后与STING的关联(图6N),从而启动了IFN通路的激活。这些结果表明,NBR1和p62在IFN级联中的相反作用是通过它们影响TRIM32诱导的STING泛素化的能力介导的,这是TBK1募集和IFN信号激活的关键事件(图6O)。
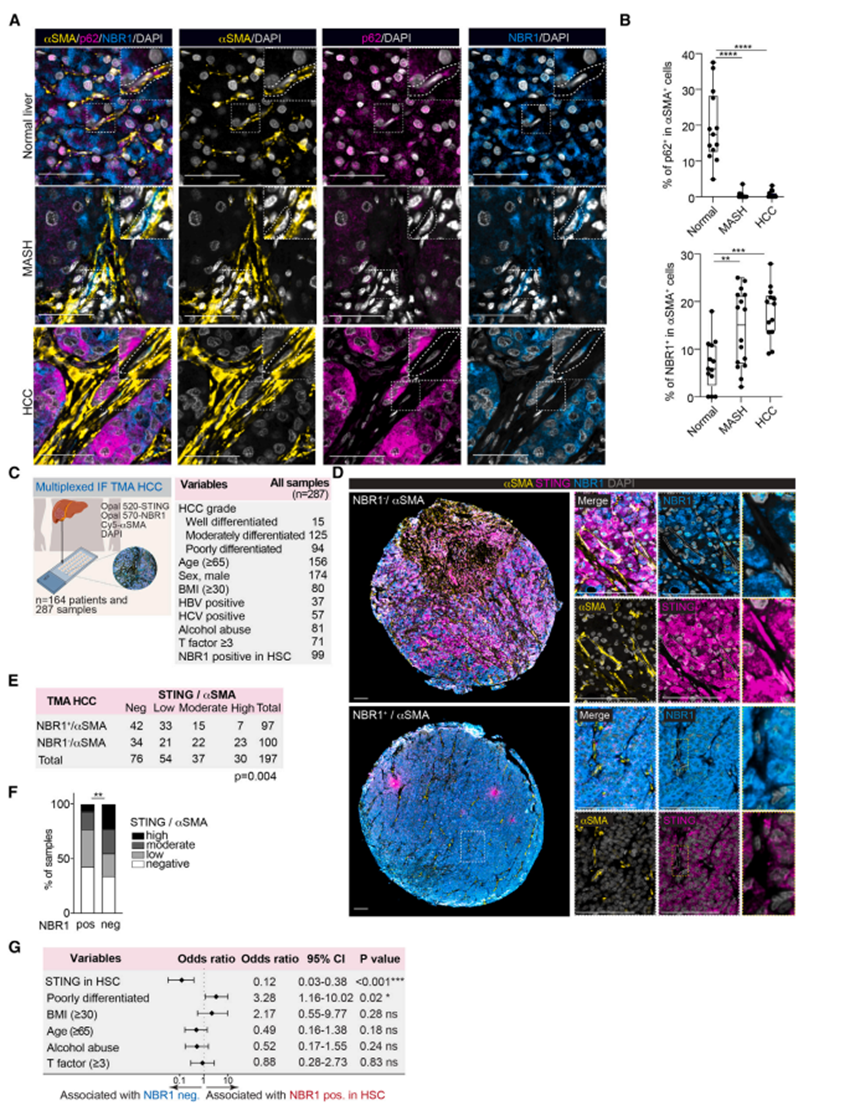
图7 在HCC进展过程中,NBR1在HSC中上调,并与低STING水平相关
10. 在HCC进展过程中,NBR1在HSC中上调,并与低STING水平相关
为了支持作者研究结果的生理学相关性,作者首先评估了HCC进展过程中HSCs中p62和NBR1的表达。作者用OPAL-multiplex法对来自正常肝脏、MASH和HCC的人类临床标本进行p62、NBR1和aSMA染色。与作者之前发表的数据一致,与正常肝脏相比,MASH和HCC样本中HSC中的16p62水平降低(图7A和7B)。相比之下,HSCs中的NBR1表达在从正常肝脏到MASH的过渡过程中逐渐增加,并在HCC中进一步增加(图7A和7B)。在两种体内损伤/纤维化小鼠模型中,HSCs中的NBR1水平一致地显著升高。
为了验证p62和NBR1在人类标本中IFN通路中的相反作用,作者首先查询了公开可用的单细胞RNA测序(RNA-seq)数据集,其中包括来自健康供体和HCC患者的HSC。来自肿瘤样本的造血干细胞被标记为癌症相关成纤维细胞(CAFs),根据NBR1和SQSTM1的表达进行分类。该分析显示,在NBR1低表达的HSC中,IFN应答特征显著富集,而在SQSTM1低表达的HSC中,IFN应答特征显著减少(图S7C-S7N)。这些数据支持NBR1和p62在调节人类HSC中IFN信号通路中的相反作用。为了进一步验证NBR1在人类HCC中作为STING负调节因子的作用,作者使用OPAL-multiplex分析了大量手术切除的HCC标本。在组织微阵列(TMA)的287个样本中,根据aSMA+细胞中NBR1的表达水平对200个样本进行分层(图7C和7D)。偶然性分析显示,与NBR1阴性染色的HCC患者相比,HSCs中可检测到NBR1表达的HCC患者的STING阴性/低发生率更高(图7E和7F)。与此一致的是,多变量logistic回归分析表明,HSCs中NBR1阳性表达与STING低水平相关,独立于其他病理特征(图7G),表明NBR1在HCC人类肿瘤中调节IFN信号通路中起主要作用。多变量logistic回归分析还表明,HSCs中NBR1的表达是低分化HCC的重要预测因子(图7G),这表明HSCs中NBR1的表达对于产生免疫抑制微环境至关重要,该微环境通过STING-IFN级联驱动。
结论:
作者之前报道过p62的缺失破坏了一种机制,该机制通过维生素D受体(VDR)级联的持续激活来维持造血干细胞处于静止、未分化状态因此,p62的缺失驱动造血干细胞向肌成纤维细胞的分化,这是导致肝癌的促炎和纤维化微环境的原因。这些先前的数据和本文报道的数据提出了p62在肝脏炎症中起双重作用的模型。p62通过VDR级联阻止HSC的活化,并通过STING控制NBR1拮抗的免疫监视。作者的数据支持旨在消耗NBR1或损害其与STING相互作用的策略,以促进CD8+驱动的免疫疗法在p62水平降低的HCC肿瘤中。
实验方法:
细胞培养实验、流式细胞术分析、组织学、免疫组织化学和免疫荧光、组织微阵列分析、原位接近结扎试验、免疫印迹和免疫沉淀试验、基于bioid2的筛选、基于bioid2筛选的LC-MS/MS分析、BioID数据分析、基因表达分析、生物信息学分析
参考文献:
Nishimura, S., Linares, J. F., L'Hermitte, A., Duran, A., Cid-Diaz, T., Martinez-Ordoñez, A., Ruiz-Martinez, M., Kudo, Y., Marzio, A., Heikenwalder, M., Roberts, L. R., Diaz-Meco, M. T., & Moscat, J. (2024). Opposing regulation of the STING pathway in hepatic stellate cells by NBR1 and p62 determines the progression of hepatocellular carcinoma. Molecular cell, S1097-2765(24)00782-2. Advance online publication. https://doi.org/10.1016/j.molcel.2024.09.026






