IL-34介导的肿瘤相关巨噬细胞重编程是p53失活驱动的免疫逃逸的关键环节
作为癌症中最常见的基因改变,超过一半的人类癌症具有导致转录失活的p53突变。然而,p53如何调节免疫图谱以创造免疫逃逸的生态位仍然难以捉摸。作者发现癌症干细胞(CSCs)中建立了白细胞介素-34(IL-34)调控的生态位来促进p53失活肝癌的肿瘤发生。机制上发现Il34是一个被p53转录抑制的基因,p53丢失导致CSCs分泌IL-34。IL-34诱导CD36介导的脂肪酸氧化代谢升高,驱动泡沫样肿瘤相关巨噬细胞(TAMs)的M2极化。IL-34调节TAMs抑制CD8+T细胞介导的抗肿瘤免疫以促进免疫逃逸。阻断IL-34-CD36轴引起抗肿瘤免疫,并与抗PD-1免疫治疗协同作用。本研究结果揭示了p53调节肿瘤免疫微环境的潜在机制,并为p53失活的癌症免疫治疗提供了潜在的靶点。
该研究于2024年10月8日发表在《Immunity》,IF:25.5
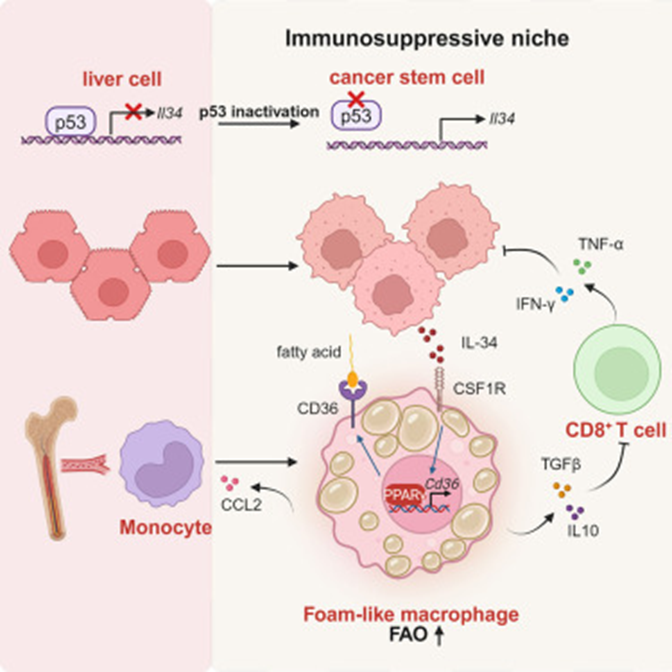
机制图
主要研究结果
1. IL-34是p53失活驱动的肿瘤发生所必需的
为了了解p53如何调节肿瘤微环境,用CRISPR-Cas9和转座子介导的基因组编辑系统生成p53缺陷(Trp53null)(Trp53+Pten,Trp53+Kras)和p53野生型(Trp53WT)(Ctnnb1+Pten,Kras+Pten)的自发性肝癌模型。接下来对Trp53WT和Trp53null肿瘤进行了RNA-seq。细胞因子是肿瘤微环境中细胞通讯的关键介质,决定肿瘤微环境的组成。通过对RNA-seq数据的分析,注意到IL-34是Trp53null肿瘤上调基因中最明显增加的细胞因子(图1A)。q-PCR、ELISA和免疫印迹显示,与WT肝脏、CCl4处理的肝脏和Trp53WT肿瘤相比,Trp53null肿瘤中IL-34的表达明显更高(图1B)。此外,从自发性肝癌模型中提取原发肿瘤细胞用于随后的机制和移植实验,其中PT细胞来自Trp53null肿瘤(Trp53+Pten),CT细胞来自Trp53WT肿瘤(Ctnnb1+Pten)。
为确定哪个细胞亚群在肿瘤微环境中分泌IL-34,对Trp53null(Trp53+Pten)和Trp53WT(Ctnnb1+Pten)肿瘤进行了单核RNA测序(snRNA-seq;10×Genomics)。在数据的质量过滤后,使用Seurat进行的无监督聚类分析产生了14个聚类,然后使用已知的标记对每个聚类进行注释。通过分析snRNA-seq数据,发现Il34在Trp53null肿瘤中的表达明显高于Trp53WT肿瘤。在Trp53null肿瘤中,CSCs表现出强烈的IL-34表达,而在所有其他细胞类型中,IL-34的表达都很弱(图1C-1F)。多重免疫组化染色显示,IL-34和EpCAM在Trp53null肿瘤中共同定位(图1G)。这些结果表明,在Trp53null肿瘤中,CSCs优先分泌IL-34。这些结果共同表明p53失活的CSCs是分泌IL-34的主要细胞亚群。
为研究IL-34对Trp53null肝癌发展的潜在影响,首先评估了IL-34过表达的自发性肝癌模型(Ctnnb1+Pten)的进展,发现IL-34过表达显著加速了Trp53WT肝癌的进展。接下来生成了IL34-/-小鼠,然后注射Trp53+Pten或Trp53+Myc质粒来诱导自发性Trp53null肝癌。与Il34+/-对照组相比,在Il34-/-小鼠中没有观察到Trp53null肝癌的肿瘤发生,病理学家将接受Trp53+Pten质粒的Il34−/-小鼠中的小病变确定为脂肪变性,而不是癌前病变或结节(图1H-1K)。这些发现表明白细胞介素-34是p53失活驱动的肿瘤发生所必需的。
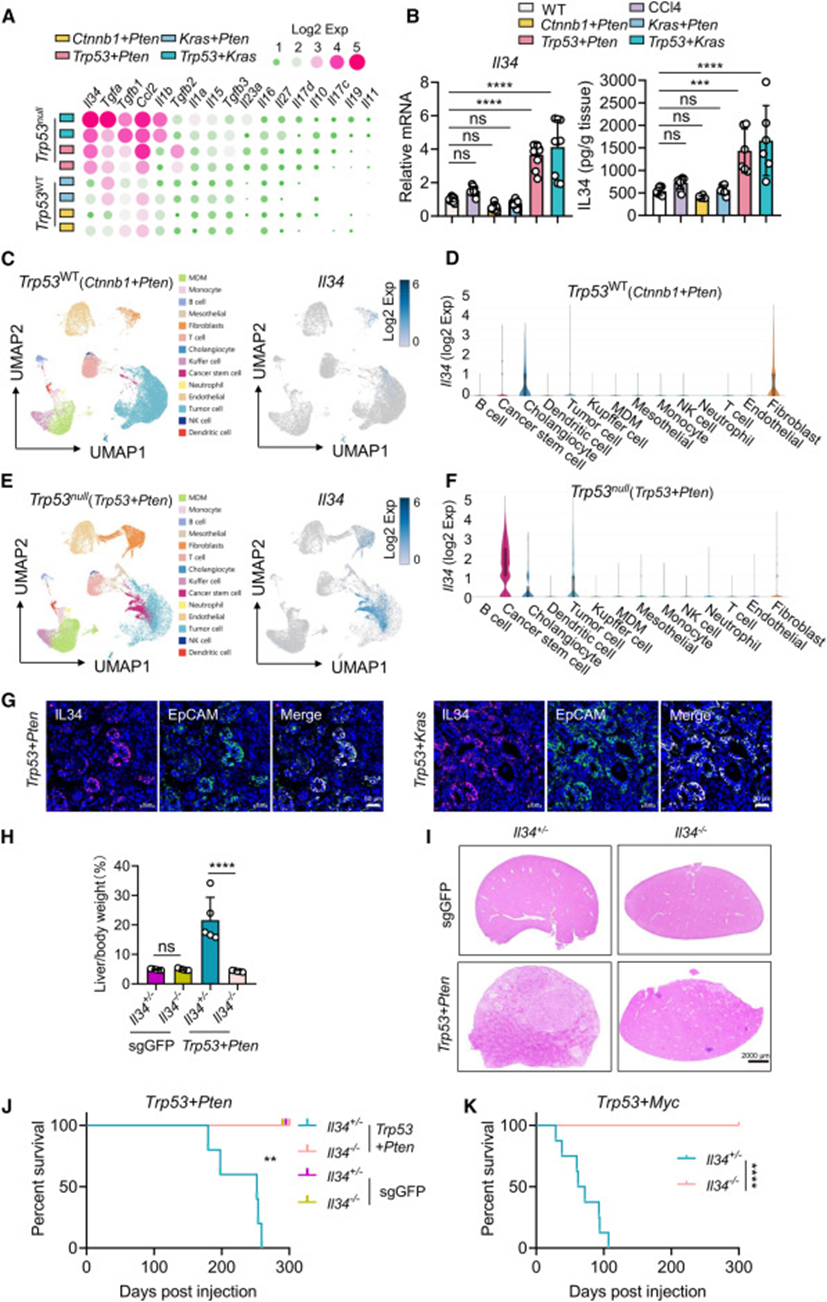
图1:p53失活的CSC异常高分泌IL-34促进肝癌发生
2. p53功能缺失直接触发IL-34分泌
考虑到在p53失活的CSCs中观察到IL-34高表达,并考虑到p53作为转录因子的已知功能,推测p53可能抑制Il34转录。在CT细胞(Trp53+/+)和AML12细胞(小鼠肝细胞系)中,Trp53的基因缺失导致用Nutlin-3预处理细胞时无法增加p21的表达(图2A和2E)。事实上,观察到Trp53的基因缺失导致IL-34的表达上调(图2B-2D和2F)。相比之下,在PT细胞中Trp53过表达时,IL-34转录被显著抑制(Trp53-/-)(图2G)。
与小鼠数据一致,HepG2细胞(人肝癌细胞,TP53WT)中TP53基因缺失后IL-34表达上调(图2H-2J)。为了确定p53是否结合IL-34的调节区域,使用p53抗体进行ChIP及高通量测序。在IL34和CDKN1A(p21)位点观察到p53结合(图2K)。ChIP-PCR和DNA下拉分析还显示p53结合到IL34启动子(图2L和2M)。这些结果表明p53直接抑制IL34转录。接下来探究p53是否调节IL34启动子的转录活性。构建含有IL34启动子的荧光素酶报告质粒(转录起始位点-2kb),并与WT p53过表达质粒共转染到293T细胞中。与空载体相比,p53过表达导致标准化荧光素酶活性降低(图2N)。请注意,当与突变型p53(R249S或R175H)共转染时,没有观察到这些降低(图2O)。为确定IL34启动子上的结合区域,截断了IL34启动子,并注意到当从-1,200到-800的区域缺失时,p53的调节活性丧失(图2P)。值得注意的是,一个一致的p53结合位点(RRRCWWGYYY)34位于IL34启动子的-858至-838(图2Q),并突变该结合位点废除了WT p53过表达时荧光素酶活性的降低(图2R),这些数据表明p53直接抑制IL34转录,p53缺失和突变p53都失去了对IL34的转录调节活性。
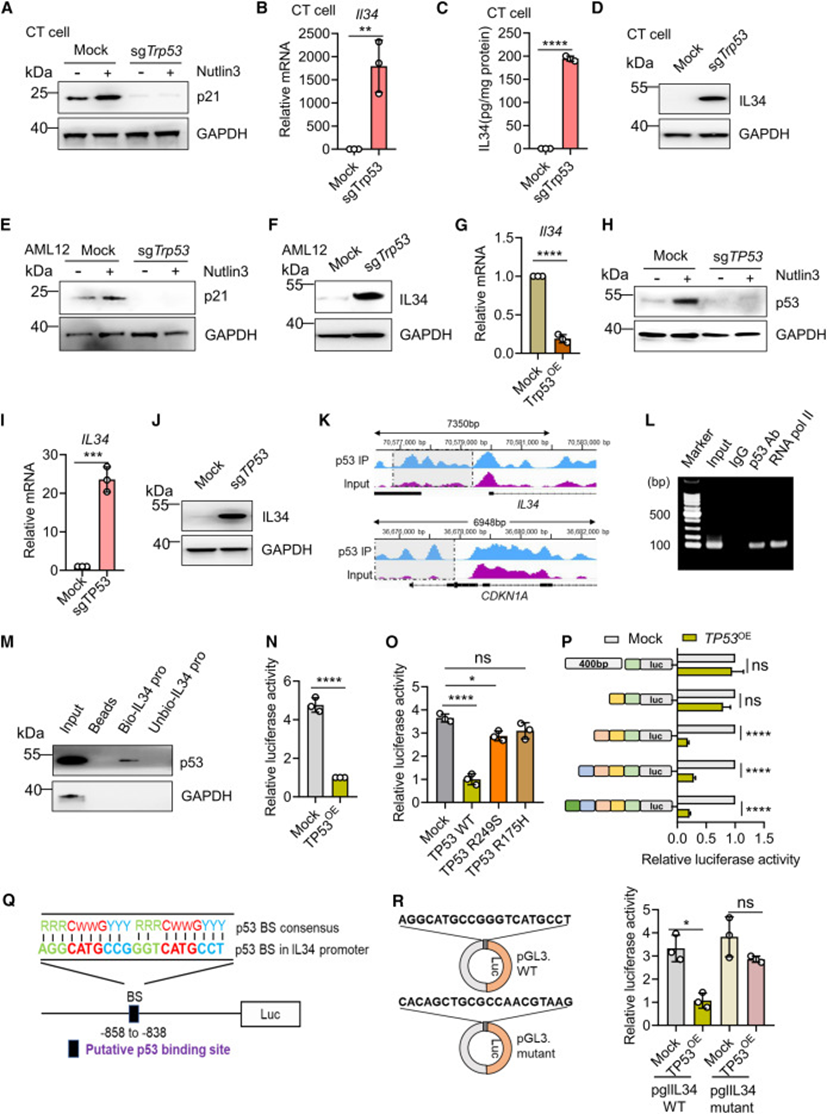
图2:p53功能丧失直接触发IL-34分泌
3. IL-34诱导的促肿瘤泡沫样巨噬细胞在p53失活的CSCs附近聚集
鉴于IL-34是一种参与单核细胞增殖、存活和分化为巨噬细胞的细胞因子,接下来通过CIBERSORT36调查肝脏肿瘤免疫细胞的组成,发现IL-34表达与巨噬细胞比例之间存在正相关关系。此外,snRNA-seq数据显示Trp53null肿瘤中巨噬细胞的比例明显高于Trp53WT肿瘤中的比例。然后对Trp53null肿瘤进行了空间转录组测序(10×Genomics)和注释。发现许多MDMs(Lyz2,Cx3cr1)分布在IL34+细胞周围(图3A)。多重免疫组化染色进一步证实TAMs在Trp53null肿瘤中分泌IL-34的CSC附近积累(图3B)。接下来想探究Trp53null肿瘤中TAMs的特征,并对Trp53null和Trp53WT肿瘤中的TAMs进行分类,以进行RNA-seq。GO分析显示,Trp53null肿瘤中的TAMs富集与促进巨噬细胞向泡沫细胞分化相关的基因。GSEA表明,Trp53null肿瘤中的TAMs富集了脂滴特征。接下来使用BODIPY脂肪酸探针对TAMs进行染色:Trp53null肿瘤中的TAMs比Trp53WT肿瘤中的TAMs积累了更多的脂肪酸,并形成了更多的脂滴(图3C和3D)。表明Trp53null肿瘤中的TAMs类似于泡沫样巨噬细胞。
为确定p53失活的CSCs是否通过IL-34诱导这些TAMs,首先使用IL-34在体外治疗BMDMs,发现IL-34暴露显著增加细胞内脂肪酸并促进BMDMs中脂滴的形成(图3E和3F)。此外,IL-34暴露还上调了M2相关标志物(例如,MRc1、Arg1、Ccl2、TGFβ和IL-10)的表达。值得注意的是,CCL2负责CCR2+单核细胞的招募。接下来,将BMDM与Trp53+/+或Trp53-/-肿瘤细胞共同培养,并检测来自Trp53+/+或Trp53-/-肿瘤的TAMs。与Trp53-/-肿瘤细胞培养的BMDM和来自Trp53-/-肿瘤的TAMs积累了更多的脂肪酸,并且更倾向于促肿瘤表型。请注意,Trp53-/-肿瘤细胞中Il34的基因缺失消除了BMDM和TAMs的这些变化(图3G、3H)。这些结果支持IL-34负责促进Trp53null肿瘤中TAMs的脂质积累和促肿瘤极化。
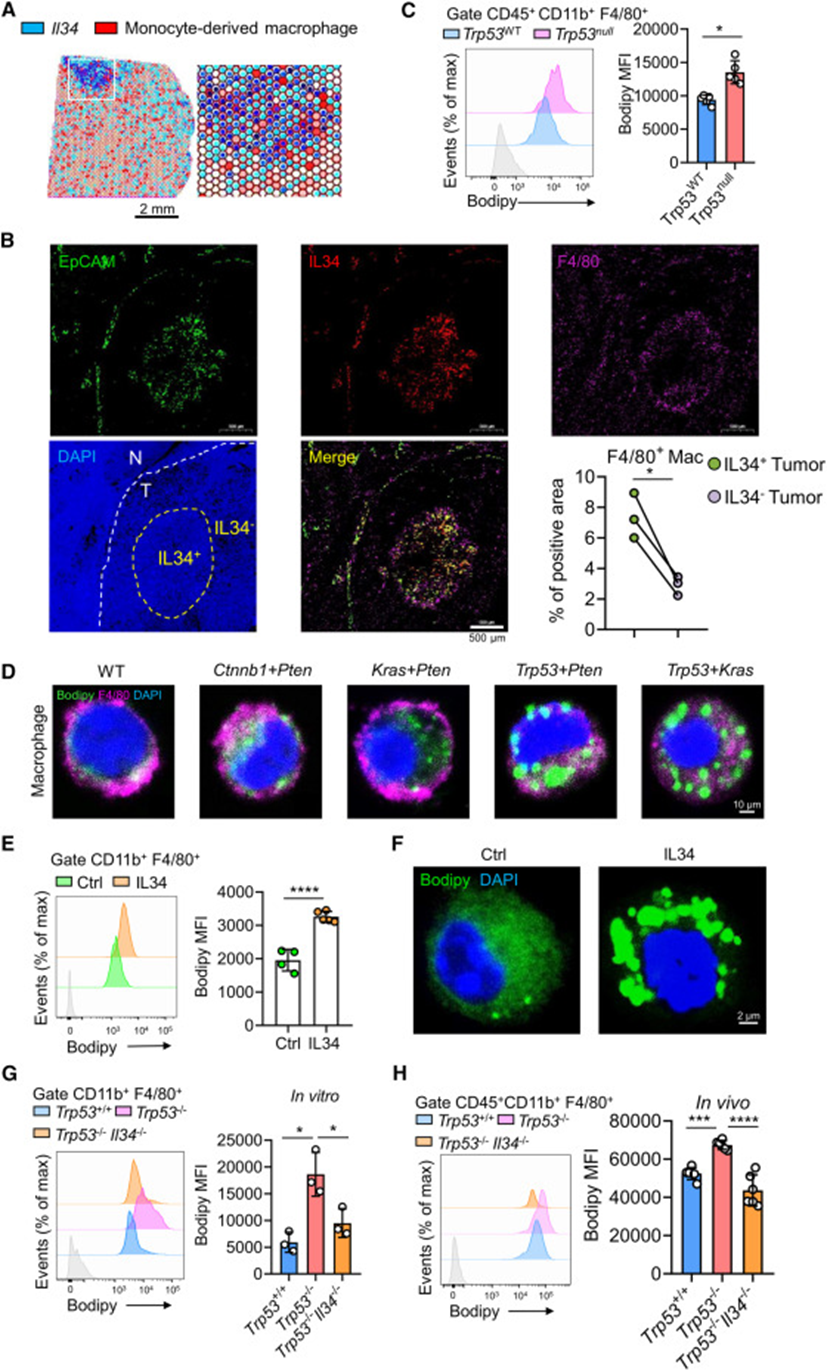
图3:IL-34在CSCs附近诱导p53失活的泡沫样TAMs
4. IL-34通过CD36促进脂肪酸摄取,并通过FAO代谢重编程诱导巨噬细胞的促肿瘤极化
接下来想知道IL-34如何促进TAMs中的脂质积累。因此使用脂肪酸BODIPY FL C12探针进行了测定,发现IL-34暴露的BMDMs中脂肪酸摄取显著较高(图4A)。RNA-seq分析显示,IL-34暴露的BMDMs中CD36的表达升高),CD36与长链脂肪酸的结合有高亲和力。qPCR和流式细胞术分析证实,IL-34处理导致BMDMs中CD36表达显著增加(图4B和4C)。然而,在使用CD36抑制剂磺基琥珀酰亚胺油酸酯(SSO)或CD36抗体预处理BMDMs时,IL-34暴露并没有促进巨噬细胞脂质积累(图4D和4E),这支持了CD36是TAMs脂肪酸含量升高的原因。PPAR-γ是编码具有脂质调节活性的蛋白质的基因的转录调节因子,包括CD36。因此推测IL-34可能通过上调PPAR信号活性来促进CD36的表达。
先前的研究表明,IL-4通过代谢重编程诱导M2样巨噬细胞极化,从而显著提高脂肪酸氧化(FAO)作为能量来源。IL-34可能诱导类似的代谢重编程以促进巨噬细胞M2样巨噬细胞极化的想法,GSEA分析表明,在IL-34暴露的BMDM中,FAO基因被富集和上调(图4F)。与糖酵解相比,FAO消耗更多的氧并产生更多的ATP。Seahorse分析表明,IL-34暴露增加了BMDM的氧消耗,并且这种增加在用FAO酶CPT1的抑制剂(依托莫昔尔)预处理细胞时被阻止(图4G)。这些发现共同支持IL-34可以诱导巨噬细胞向FAO能量代谢重编程。然而,作者又注意到IL-34暴露并没有引起CD36沉默的RAW264.7细胞(巨噬细胞系)耗氧量和M2样巨噬细胞极化的增加(图S4E-S4H)。在用SSO或依托莫西预处理BMDMs时,IL-34暴露也没有促进M2样巨噬细胞极化(图4H和4I)。也就是说,当CD36和FAO被破坏时,IL-34无法诱导巨噬细胞M2样的巨噬细胞极化,这支持了它们是巨噬细胞极化过程的重要组成部分。由于IL-34诱导CD36表达,并且IL-34和CD36都是向FAO重编程所必需的,提出了“IL-34-CD36轴”负责形成泡沫样的促肿瘤TAMs。
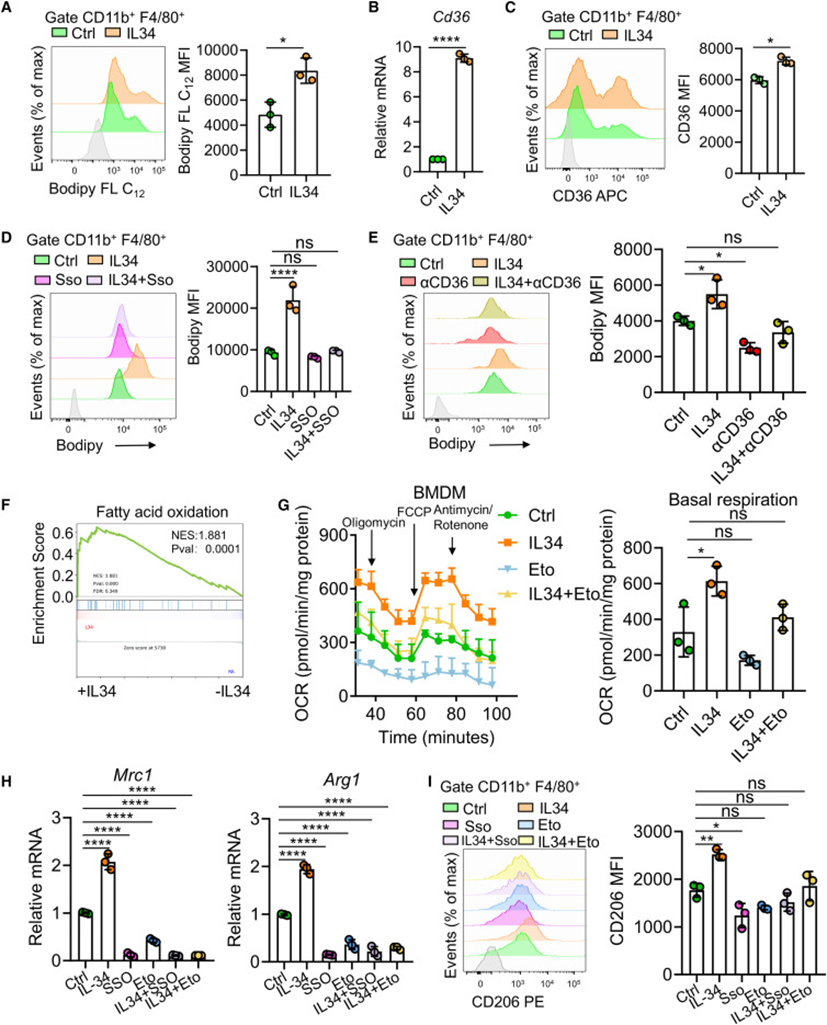
图4:IL-34通过CD36促进脂肪酸摄取并通过FAO代谢重编程诱导巨噬细胞M2极化
5. IL-34-CD36介导的代谢重编程以驱动Trp53null肿瘤中TAMs的促肿瘤极化
接下来研究了IL-34-CD36轴在Trp53null肿瘤中泡沫样促肿瘤TAMs中的参与。首先与Trp53+/+或Trp53-/-肿瘤细胞共同培养BMDMs。与Trp53+/+肿瘤细胞培养的BMDMs相比,用Trp53+/+肿瘤细胞培养的BMDMs中CD36和FAO基因Cpt1a的表达显著高于用Trp53+/+肿瘤细胞培养的BMDMs(图5A和5B)。值得注意的是,Trp53-/-肿瘤细胞中Il34的基因缺失消除了BMDMs中CD36和Cpt1a的表达增加(图5C和5D)。因此,Trp53-/-肿瘤细胞分泌的IL-34可以诱导巨噬细胞中的CD36表达和FAO诱导。还重新分析了Trp53null肝脏肿瘤的snRNA-seq数据,并注意到CD36的表达在MDMs中最高。MDM的KEGG分析表明富集了包括脂肪酸降解和脂肪酸代谢在内的途径。流式细胞术分析还显示,Trp53null肝脏肿瘤的TAMs中CD36的表达明显高于Trp53WT肝脏肿瘤的TAMs(图5E)。请注意,通过多重免疫荧光染色,发现Trp53null肝脏肿瘤中确实存在特异性表达CD36的TAMs群体(图5F)。这些发现共同支持IL-34诱导CD36介导的脂肪酸代谢变化,以驱动Trp53null肿瘤中泡沫样巨噬细胞的M2样巨噬细胞极化。为了提供IL-34-CD36轴促进体内TAM脂质积累和M2样巨噬细胞极化的直接证据,首先构建了IL-34过表达的CT细胞(Trp53+/+)和IL-34消融的PT细胞(Trp53-/-),然后将这些细胞皮下接种到小鼠体内,观察到IL-34过表达肿瘤中TAMs的百分比高于CT肿瘤,IL-34过表达显著增加了TAMs中CD36和CD206的表达以及脂质含量。这些结果共同证明了IL-34-CD36轴驱动Trp53null肿瘤中泡沫样巨噬细胞的M2样巨噬细胞极化。
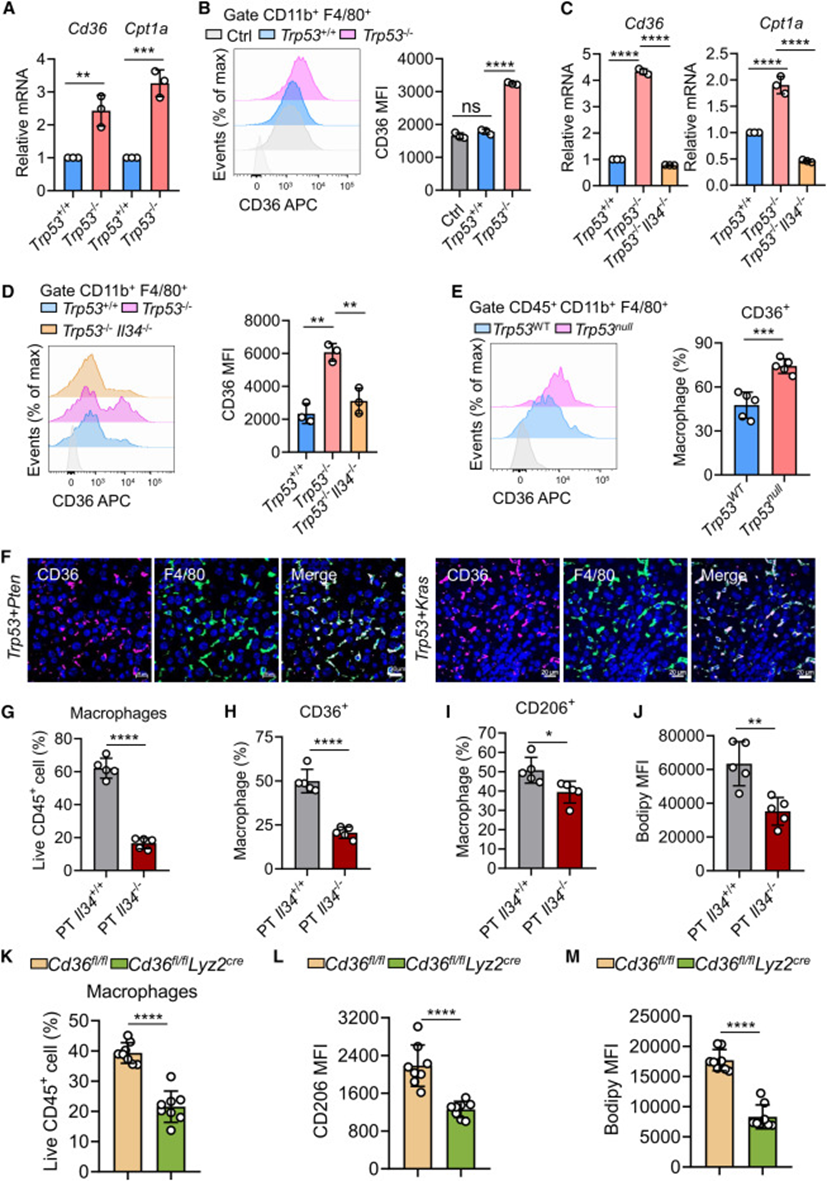
图5:IL-34协调CD36介导的代谢重编程以驱动Trp53null肿瘤中TAMs的促肿瘤极化
6. IL-34调控的TAMs抑制T细胞介导的抗肿瘤免疫,促进肿瘤免疫逃逸
接下来讨论了IL-34诱导的TAMs在肿瘤发育中的作用,观察到IL-34在PT肿瘤中的遗传缺失导致小鼠明显的生长受限(图6A)。然而,通过注射氯膦酸脂质体对巨噬细胞的系统性消耗消除了IL-34缺陷的PT肿瘤和对照PT肿瘤之间肿瘤生长的差异(图6A、6B)。这些数据表明IL-34调控的TAMs促进肿瘤免疫逃避。
TAMs可以通过抑制T细胞介导的抗肿瘤免疫来促进肿瘤免疫逃逸,从snRNA-seq数据来看,Trp53null肿瘤中肿瘤浸润T细胞的比例明显低于Trp53WT肿瘤。接下来研究了肿瘤浸润T细胞的特征,并将Trp53null和Trp53WT肝脏肿瘤中的T细胞(CD45+CD3+)进行了RNA-seq。差异基因分析显示,Trp53null肿瘤中的T细胞比Trp53WT肿瘤中的T细胞具有更高的耗尽标志物表达(例如,Pdcd1,Ctla4,Lag3和havcr2)(图6C)。流式细胞术显示,Trp53null肿瘤中的CD8+T细胞产生的IFN-γ和TNF-α低于Trp53WT肿瘤(图6D)。接下来从Trp53null和Trp53WT肝肿瘤中筛选TAMs,并将它们与脾T细胞共同培养用于体外T细胞抑制试验:来自Trp53null肿瘤的TAMs对T细胞增殖和IFN-γ产生的抑制能力强于来自Trp53WT肝肿瘤的TAMs。这些数据表明来自Trp53null肿瘤的TAMs可能抑制T细胞介导的抗肿瘤免疫。值得注意的是,PT(Trp53−/−)肿瘤中IL-34的基因缺失导致肿瘤浸润性T细胞增加(图6E)。来自IL-34缺陷PT肿瘤的肿瘤浸润性T细胞比来自对照PT肿瘤的T细胞表达较低的PD-1和较高的IFN-γ和TNF-α(图6F-6H)。类似地,TAMs上CD36的条件性基因缺失导致PT肿瘤明显的生长限制,但没有导致CT(Trp53+/+)肿瘤(图6I),并导致PT肿瘤中肿瘤浸润性T细胞增加(图6J)。然而,当小鼠接受CD8抗体腹腔注射时,IL-34缺陷PT肿瘤和对照PT肿瘤中肿瘤生长的差异完全丢失(图6K)。这些数据共同表明,IL-34-CD36轴编排的TAMs通过抑制Trp53null肝癌中T细胞介导的抗肿瘤免疫来促进肿瘤逃逸免疫。
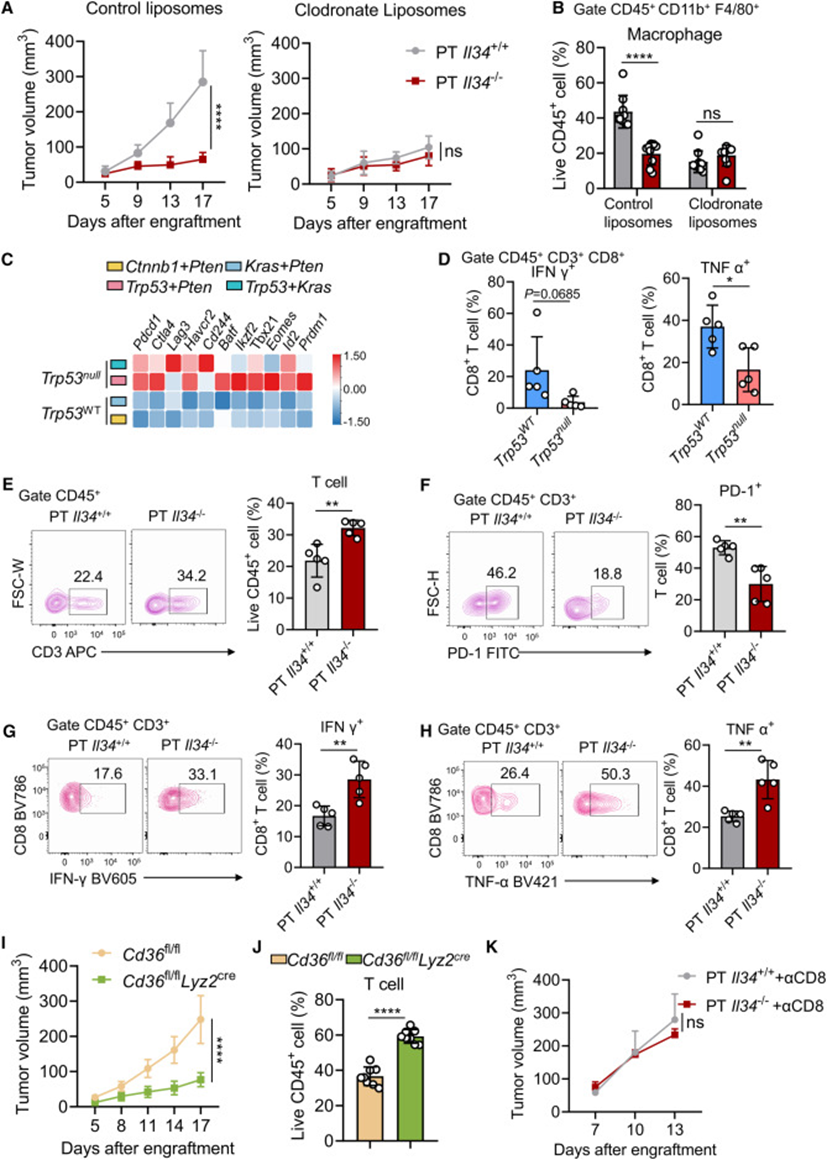
图6:IL-34调控的TAMs抑制T细胞介导的抗肿瘤免疫,促进肿瘤免疫逃逸
7. 阻断IL-34信号可作为TP53突变癌症的潜在免疫疗法
鉴于IL-34-CD36轴诱导的TAMs在Trp53缺失的肝脏肿瘤中促进肿瘤免疫逃避,想了解阻断IL-34-CD36轴是否可以抑制肿瘤生长。用IL-34或CD36的中和抗体处理Trp53−/−PT荷瘤小鼠。IL-34或CD36的抗体阻断导致肿瘤生长明显受限(图7A和S7A)。通过IL-34或CD36的抗体阻断,单核细胞TAMs的比例显著降低,TAMs的脂质含量和CD206表达降低。此外,阻断IL-34或CD36导致T细胞浸润和产生IFN-γ和TNF-α的T细胞百分比显著增加。值得注意的是,抗IL -34和抗CD6联合治疗PT荷瘤小鼠,对小鼠的生长限制更强,存活时间明显延长(图7B和7C)。这些数据表明,IL-34-CD36轴是p53失活肝癌的潜在治疗靶点。
与之前的报道一致,皮下和肝脏接种的Trp53-PT肿瘤对抗PD-1治疗没有反应(图7D-7F)。然而,Il34的基因缺失与抗PD-1联合强烈协同抑制肿瘤生长,导致高达75%的病例完全缓解(图7D-7F)。随后通过再次治疗完全缓解的小鼠来检查联合阻断是否赋予长期免疫。注意到与新生小鼠相比,再次治疗的小鼠仍然可以拒绝PT肿瘤(图7G)。IL-34,CD36和PD-1的联合治疗完全阻断了Trp53-PT肿瘤的发展(图7H),甚至在已建立的较大肿瘤中引起强烈的生长限制(图7I和7J)。之后研究了IL-34在TP53突变的人肝癌中的高表达是否会增加CD36+促肿瘤巨噬细胞的浸润。对TCGA数据库的分析显示,TP53突变的肝癌比TP53 WT的肝癌有更大程度的巨噬细胞浸润。通过利用TISIDB网站,IL34的表达与巨噬细胞的浸润丰度呈正相关。通过利用TIMER 2.0网站,IL34的表达与CD36、TGFB1和CCL2的表达呈正相关。对TP53突变肝癌的公共单细胞RNA-seq数据的分析表明,高表达IL34的肿瘤细胞和TAMs表现出CD36的强劲表达,而它们在所有其他细胞类型中的表达都很弱。此外染色显示,与TP53 WT相比,TP53突变的肝癌增加了CD36+TAM浸润,接受ICI治疗的TP53突变的癌症患者总生存率较低。总的来说,研究结果表明阻断IL-34信号可能是TP53突变癌症患者的潜在免疫治疗。
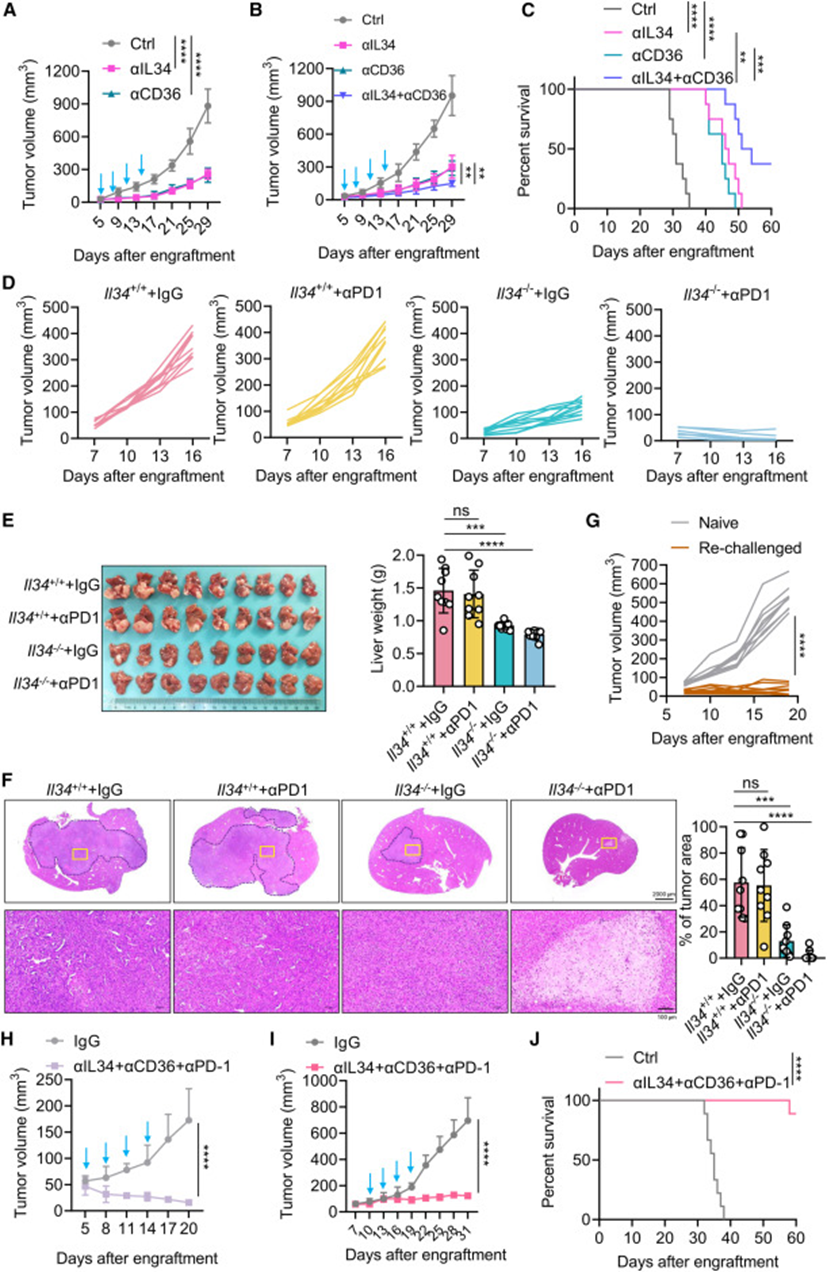
图7:阻断IL-34信号通路抑制p53失活诱导的肝癌生长
结论
本项研究中,作者揭示了 IL-34 在肿瘤细胞中表达的转录调控机制。作者发现 IL-34 被 p53 转录抑制,p53 转录功能的丧失导致 IL-34 表达上调,从而塑造了驱动肿瘤免疫逃逸的免疫抑制生态位。因此,IL-34 塑造肿瘤微环境是 p53 失活肿瘤的常见特征,阻断 IL-34 信号传导可作为靶向 p53 泛突变的治疗策略。
实验方法
动物实验模型和研究参与者详细信息;CRISPR Cas9等构建质粒;自发性肝癌模型;流式细胞仪和细胞分选;ELISA;线粒体、脂肪酸摄取和脂质含量测定;细胞能量代谢分析;荧光素酶报告基因测定;T细胞抑制试验;RNA-Seq和数据分析;DNA pull-down;单核RNA测序和数据分析;空间转录组测定;肿瘤移植、抗体治疗和巨噬细胞耗尽;分析TCGA/ICGC数据和公共scRNA-seq数据
参考文献
Nian Z, Dou Y, Shen Y, Liu J, Du X, Jiang Y, Zhou Y, Fu B, Sun R, Zheng X, Tian Z, Wei H. Interleukin-34-orchestrated tumor-associated macrophage reprogramming is required for tumor immune escape driven by p53 inactivation. Immunity. 2024 Oct 8;57(10):2344-2361.e7. doi: 10.1016/j.immuni.2024.08.015. Epub 2024 Sep 24. PMID: 39321806. IF: 25.5 Q1.






