PYCR1通过乳酸化修饰促进肝癌细胞生长和转移
肝癌(LC)是世界上最致命的癌症之一,现有的治疗方法疗效有限。本研究旨在阐明PYCR1作为LC的潜在治疗靶点的作用和潜在机制。我们发现PYCR1在HCC中表达显著升高,且这种高表达与HCC患者预后不良相关。在体内和体外,敲除或抑制PYCR1均可抑制HCC细胞的增殖、迁移和侵袭。此外,我们发现敲除或抑制PYCR1可以抑制HCC细胞中的糖酵解,减少IRS1组蛋白的H3K18乳酸化,从而抑制IRS1的表达。我们的研究结果确定PYCR1是影响肿瘤细胞代谢和基因表达的LC进展的关键调节因子。通过证明靶向PYCR1抑制LC细胞增殖和转移的潜力,本研究确定PYCR1是一个有希望的LC治疗靶点。本文于2024年10月发表于Clin Transl Med(IF=7.9)上。
技术路线:

结果:
1)PYCR1在LC中表达上调,其高表达与LC患者预后不良相关
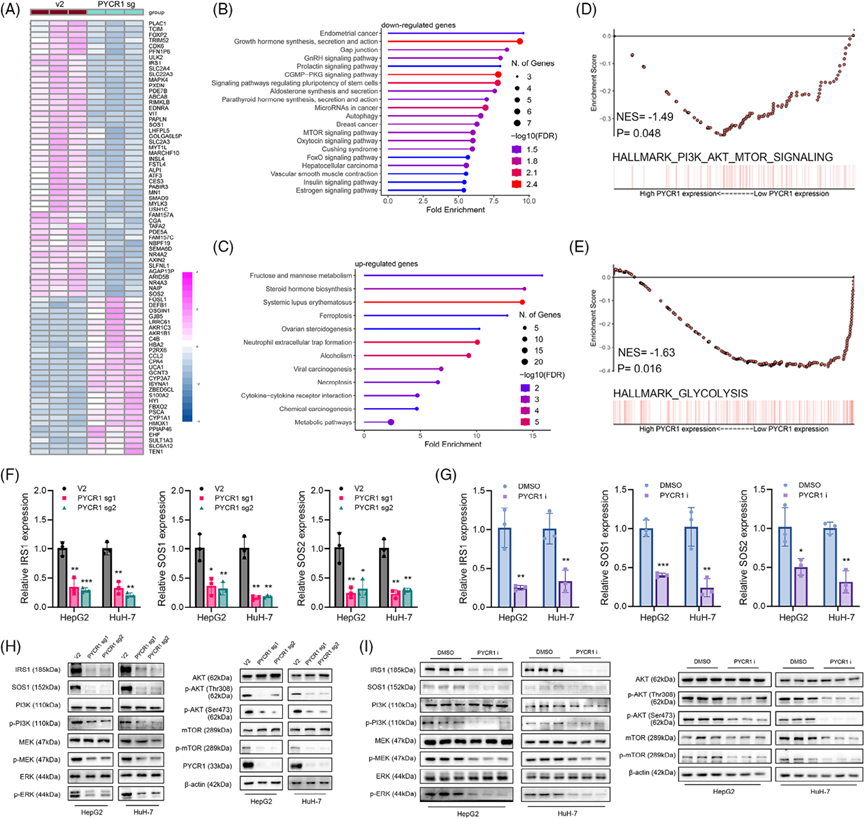
LC和癌旁组织的RNA测序数据来自TCGA和GEO数据库的分析。结果显示,肺癌中PYCR1 RNA水平显著升高(图1A)。此外,PYCR1高表达与肺癌患者预后不良显著相关(图1B)。通过蛋白质印迹分析验证,肺癌组织中的PYCR1蛋白水平显著高于癌旁组织(图1C)。利用包含83对肺癌样本的组织微阵列的免疫组化(IHC)结果也显示,PYCR1在肺癌中表达显著上调,并与肺癌患者的生存相关(图1D、E)。随后的Cox生存分析进一步支持了这些结果(图1F)。PYCR1的甲基化水平与其表达水平呈负相关(图1G)。为了验证这一观察结果,我们用甲基化抑制剂5-氮杂胞苷(5-AZA;10μM)处理细胞系。蛋白质印迹结果显示,经5-AZA处理后,蛋白质水平显著升高(图1H)。综上所述,PYCR1在肺癌中高表达,并与预后不良相关,其表达部分受DNA甲基化的调控。
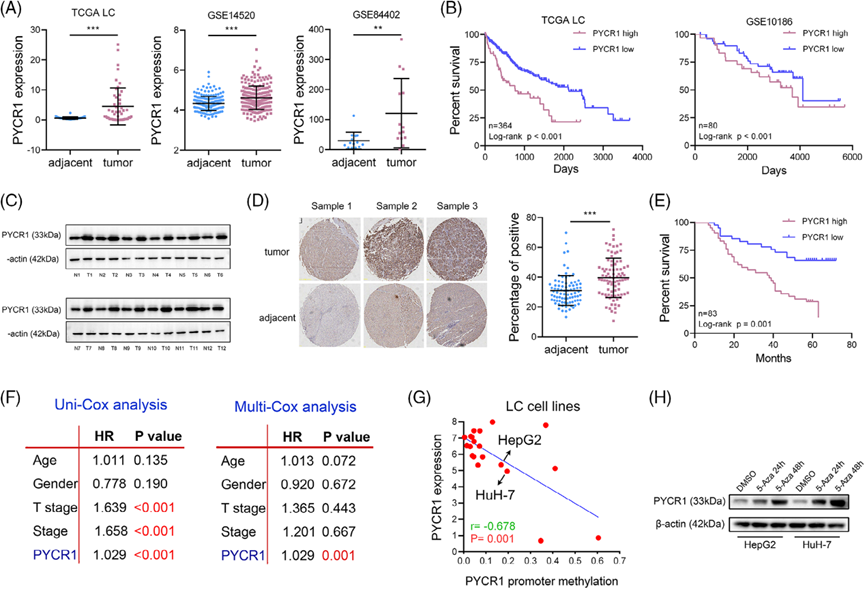
2)在体外敲除或抑制PYCR1可抑制LC细胞的生长和转移
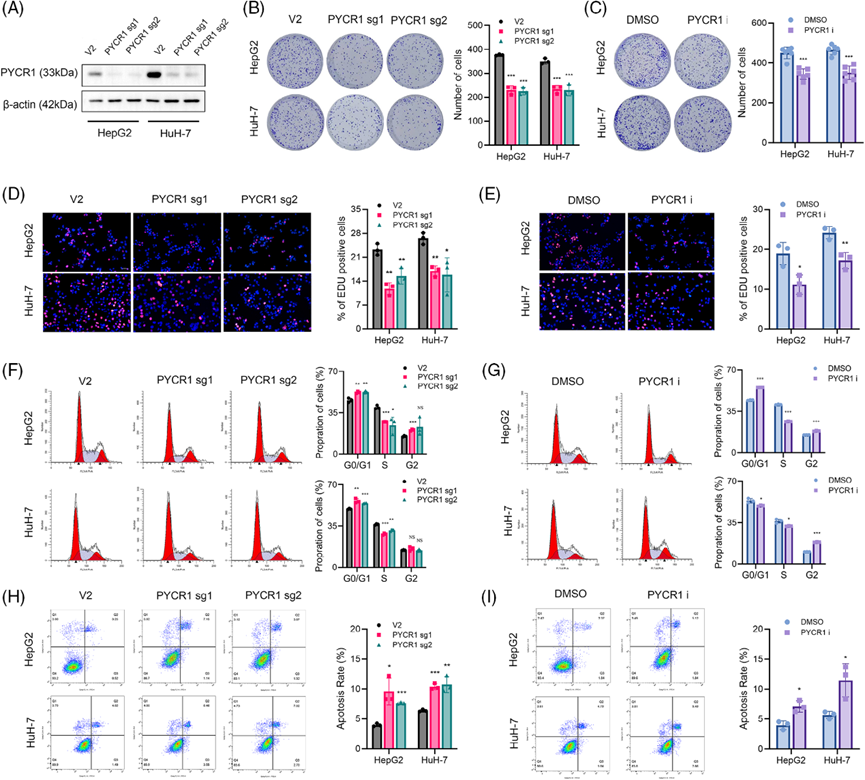
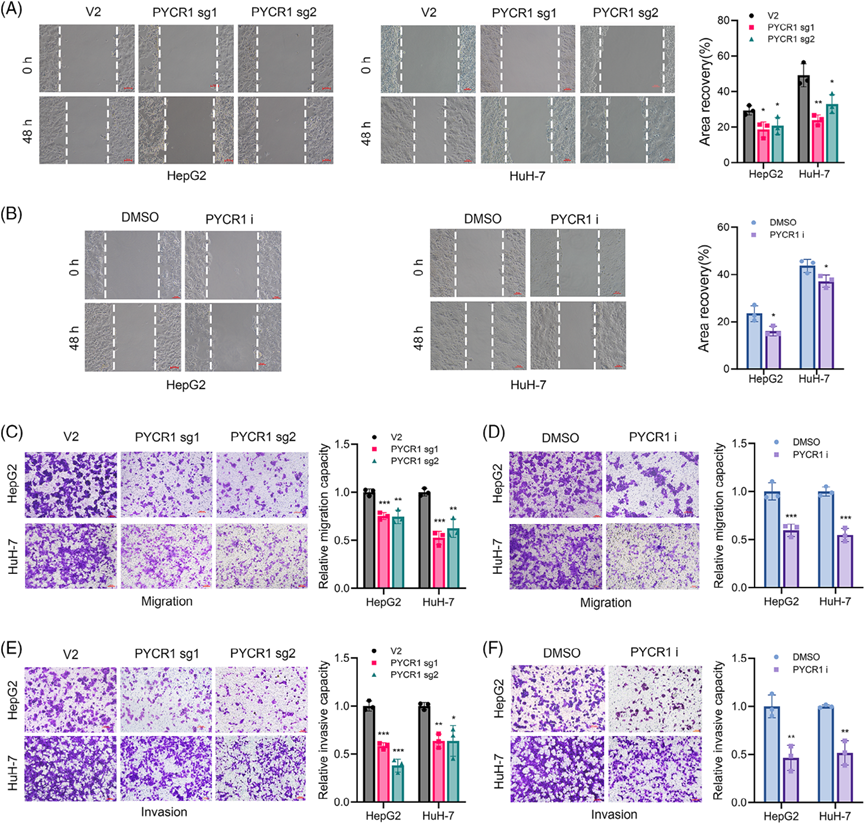
利用CRISPR-Cas9基因编辑技术构建稳定的PYCR1敲除HepG2和HuH-7细胞。Western blot验证敲除效率(图2A)。此外,我们在文献中发现了一种PYCR1抑制剂,该抑制剂已在多项研究中使用,并显示出显著的效果。然后,我们委托该公司合成这种抑制剂,并使用稳定的敲除细胞系进行实验,以加强我们的结果。我们测试了这种抑制剂的多个浓度,发现20 μM的浓度能显著抑制HepG2细胞的增殖,其抑制水平与PYCR1敲除相当。为了验证PYCR1对肺癌细胞体外的影响,我们进行了多项表型分析实验。敲减/抑制PYCR1后,细胞形成的克隆数量显著减少(图2B,C)。EdU实验的结果表明,敲除或抑制肺癌细胞中的PYCR1后,增殖细胞的比例显著降低(图2D,E)。此外,流式细胞术分析显示,敲除/抑制PYCR1后,S期细胞的比例显著减少(图2F,G),凋亡分析显示,敲除/抑制PYCR1后,凋亡细胞的百分比显著增加(图2H,I)。这些结果表明,抑制或敲除PYCR1抑制了肺癌细胞的生长。接下来,我们探索PYCR1敲除/抑制对LC细胞转移的影响。伤口愈合实验结果显示,PYCR1敲除或抑制组LC细胞的迁移面积明显小于对照组(图3A,B)。在Transwell迁移和侵袭实验中,敲除/抑制PYCR1后,通过腔室的细胞数量显著减少(图3C-F)。这些结果初步表明,敲除/抑制PYCR1可显著降低LC细胞的转移能力。
3)在体内敲除或抑制PYCR1会阻碍LC细胞的生长和转移
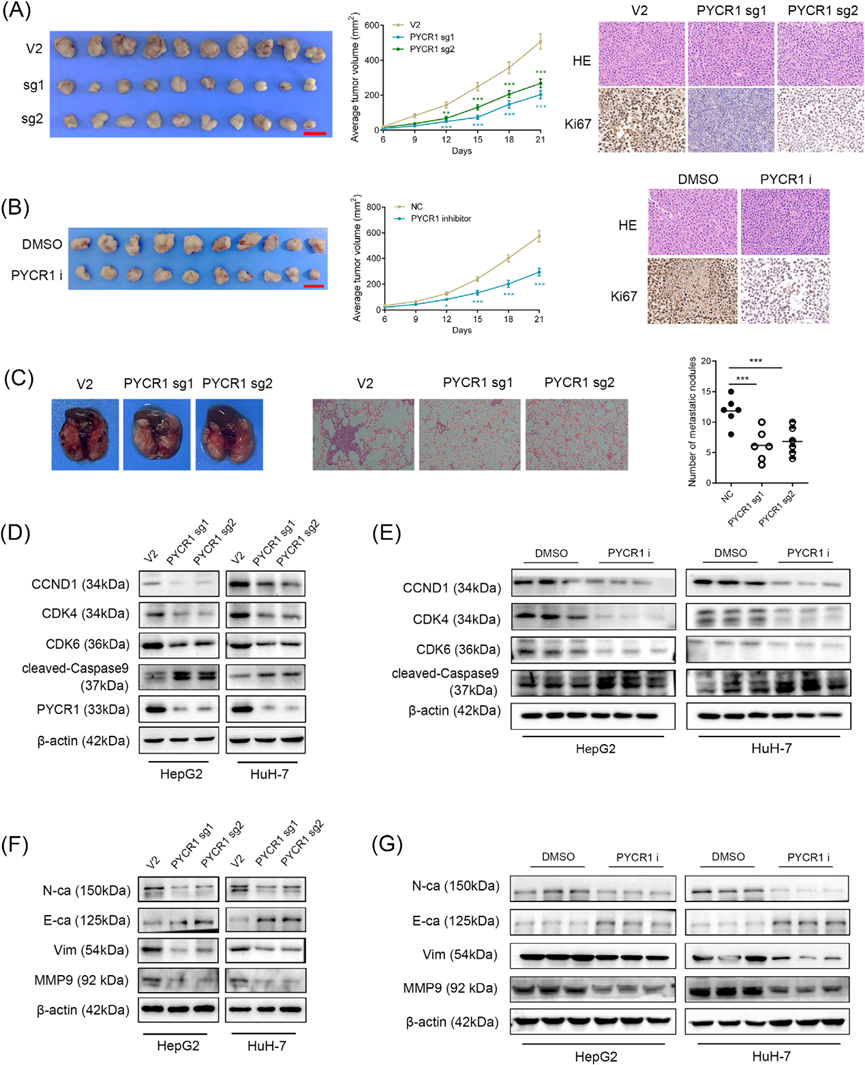
细胞表型实验只能证明PYCR1在体外的角色。因此,我们使用裸鼠异种移植模型和尾静脉注射的肺癌转移小鼠模型来探讨PYCR1敲除或抑制对肺癌体内增殖和迁移/侵袭能力的影响。在使用异种移植模型时,我们观察到敲除组肿瘤的大小显著小于对照组,抑制剂组也观察到了类似趋势。此外,我们对异种移植组织进行了HE和Ki67染色。结果显示,敲减或抑制PYCR1后,Ki67阳性细胞的比例显著减少(图4A,B)。在肺癌转移模型中,PYCR1敲除组小鼠的肺转移结节数量显著少于对照组小鼠(图4C)。为了进一步支持这些结果,我们从敲减和抑制剂组的肺癌细胞中提取蛋白质。然后我们通过Western blot检测了与增殖和周期相关的蛋白、与迁移/侵袭相关的蛋白以及与凋亡相关的蛋白。结果显示,在敲除或抑制PYCR1后,CCND1、CDK4、CDK6、N-钙粘蛋白、波形蛋白和MMP9的表达显著下调。相反,敲除或抑制PYCR1后,E-钙粘蛋白和裂解的caspase 9的表达显著上调(图4D–G)。总结来说,这些发现支持我们之前的研究结果,并验证了高表达的PYCR1在促进肺癌恶性进展中的作用。
4)敲除或抑制PYCR1会干扰LC中PI3K/Akt/mTOR和MAPK/ERK通路
表型实验表明PYCR1促进LC的恶性进展。然而,其潜在机制尚不清楚。接下来,我们使用RNA-seq鉴定HepG2细胞中PYCR1敲除后表达水平显著改变的基因(图5A)。途径富集分析显示,PYCR1敲除后表达下调的基因主要富集于间隙连接途径、mTOR途径和胰岛素途径,而PYCR1敲除后表达上调的基因主要富集于铁死亡和坏死性凋亡途径(图5B、C)。此外,LC组织RNA-seq数据的基因集富集分析(GSEA)显示PYCR1表达与PI3K/Akt/mTOR通路显著正相关(图5D)。此外,我们观察到PYCR1表达与糖酵解代谢途径之间存在显著的正相关(图5E)。我们发现PI3K/Akt/mTOR通路的上游基因IRS1在敲除PYCR1后显著下调。此外,参与调控MAPK/ERK通路的下游基因IRS1、SOS1和SOS2在敲除PYCR1后也显著下调。这些结果经qPCR证实(图5F,G)。为了进一步验证上述现象,我们从PYCR1敲除的LC细胞中提取蛋白质进行Western blot。结果显示,PI3K/AKT/mTOR通路和MAPK/ERK通路主要蛋白水平降低(图5H, 1)。这两种途径可以强烈地影响癌症的进展,它们的联合作用可以解释在以前的表型实验中观察到的变化。
5)敲除或抑制PYCR1通过调节IRS1的表达来损害LC的进展
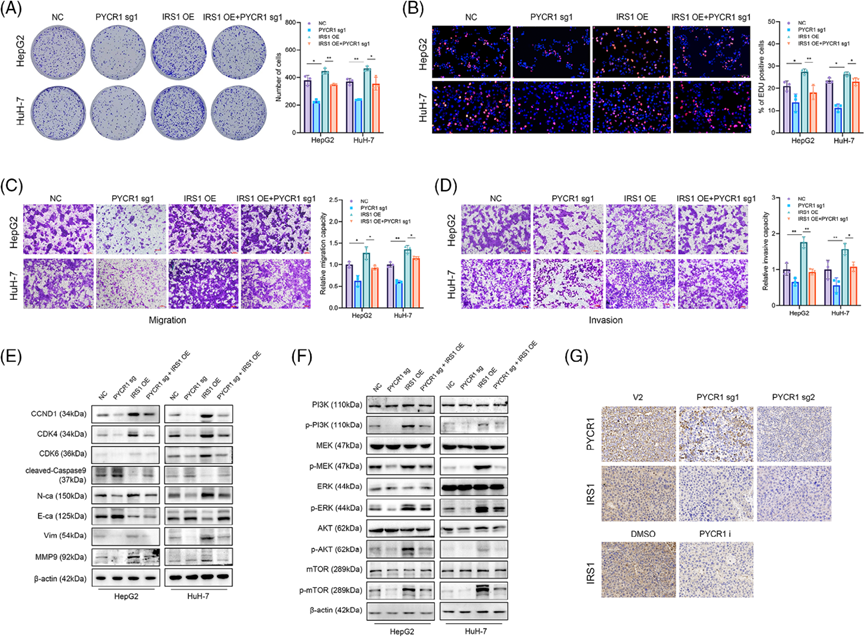
接下来,我们探讨了PYCR1是否通过IRS1促进了LC的进展。在LC细胞中敲除PYCR1, IRS1过表达,然后将两种处理联合使用。集落形成和EdU染色结果表明,在PYCR1敲除细胞中,IRS1过表达后,细胞的增殖能力显著提高(图6A,B)。Transwell实验证实IRS1过表达后细胞迁移和侵袭能力增加(图6C,D)。Western blot结果显示,在PYCR1敲除或抑制的LC细胞中,IRS1过表达后,细胞周期相关蛋白、凋亡相关蛋白和肿瘤转移相关蛋白的表达变化被消除(图6E)。IRS1过表达还挽救了PI3K/Akt/mTOR和MAPK/ERK通路中关键分子被抑制的磷酸化(图6F)。此外,对先前动物实验的肿瘤组织进行免疫组化,证实体内PYCR1敲低/抑制后IRS1下调(图6G)。这些发现表明,PYCR1的敲低/抑制导致的LC进展损伤是由于IRS1的抑制。
6)PYCR1通过调节IRS1启动子区域的H3K18乳酸化来影响IRS1的表达
尽管我们确定了PYCR1通过IRS1促进肺癌进展,但这两种分子之间的联系机制仍然未知。PYCR1主要位于线粒体中,而IRS1位于细胞质中。这些细胞器之间没有直接接触,使得相互作用变得困难。我们的免疫沉淀和质谱结果也排除了这两种分子之间相互作用的可能(结果未显示)。我们发现PYCR1敲减组中糖酵解的代谢产物乳酸的含量显著减少(图7A–C)。使用生化试剂盒也观察到了乳酸含量的显著下降(图7D)。最近的研究发现,乳酸可以主导蛋白质的乳酸化修饰。因此,我们假设IRS1的下调是由细胞内乳酸含量的减少引起的,进而导致组蛋白H3K18乳酸化的下调。为了验证我们的推测,我们首先使用Western blot分析了总体蛋白质的乳酸化水平。结果显示,当PYCR1被敲减或抑制时,总体细胞质蛋白的乳酸化水平和组蛋白H3K18位点的富集都下调了(图7E)。然后我们进行了ChIP-PCR实验来检测IRS1启动子区域的H3K18la富集情况。结果显示,PYCR1敲除后,IRS1启动子区域的H3K18la富集显著减少(图7F)。此外,IRS1启动子荧光素酶报告基因实验的结果显示,响应PYCR1的IRS1转录活性显著降低(图7G)。海马细胞代谢分析结果显示,LC细胞中PYCR1抑制/敲低后,糖酵解程度显著降低(图7H)。Western blot分析证实了PYCR1敲除后葡萄糖摄取相关蛋白(GLUT2/3/4)的表达减少(图7I)。

结论:
我们的研究揭示了PYCR1在LC中的表达模式和促瘤作用,并确定了PYCR1促进LC进展的下游靶点IRS1。此外,我们的研究表明,PYCR1可以通过组蛋白乳酸化调节LC中乳酸代谢,影响基因表达。我们的研究为寻找治疗LC的新靶点提供了新的途径。
实验方法:
CRISPR-Cas9基因敲除,EdU,流式,伤口愈合实验,Transwell,RNA测序,ChIP‒PCR,荧光素酶报告基因实验。
参考文献:
Wang H, Xu M, Zhang T, Pan J, Li C, Pan B, Zhou L, Huang Y, Gao C, He M, Xue Y, Ji X, Zhang X, Wang N, Zhou H, Wang Q, Li JZ. PYCR1 promotes liver cancer cell growth and metastasis by regulating IRS1 expression through lactylation modification. Clin Transl Med. 2024 Oct;14(10):e70045. doi: 10.1002/ctm2.70045.






