乳腺癌中表达NRP2的细胞是S-亚硝基化枢纽,可减轻辐射诱导的氧化应激
尽管新辅助化疗极大的改善了乳腺癌患者的治疗效果,但部分患者仍有残留病灶。放射治疗作为治疗恶性肿瘤的主要手段之一,在影像技术和人工智能发展帮助下,可以为患者提供最佳的个性化治疗。然而三阴性乳腺癌(Triple-negative breast cancer, TNBC)患者对放射治疗具有抵抗性。在该研究中,研究者发现了一种蛋白质S-亚硝基化修饰介导的放疗抵抗机制并设计了恢复放疗敏感性的靶向抗体。该文章于2024年10月发表在《Journal of Clinical Investigation》,IF=13.3。
技术路线
研究结果
1.抑制VEGF/NRP2增强TNBC的放射敏感性
肿瘤干细胞(cancer stem cells, CSCs)在TNBC中富集,并且对电离辐射产生的ROS具有抵抗性。研究者已经发现VEGF通路通过单次跨膜蛋白NRP2维持CSC的功能,但是VEGF/NRP2通路在氧化应激缓冲方面的作用尚不清楚。
研究者通过对比人正常乳腺细胞和TNBC原代细胞单剂量放疗后的基因表达谱,发现相比于对照组,22个编码细胞表面蛋白的基因在放射治疗的TNBC原代细胞中高表达。其中,NRP2与接受放疗的TNBC患者不良预后相关(图1A)。研究者发现在放疗抵抗的TNBC细胞系中NRP2在细胞表面的表达量与辐射剂量相关(图1B)。为研究NRP2表达是否是放疗后存活的关键调节因素,研究者在辐射处理后的TNBC细胞中干扰了NRP2表达,并通过流式细胞术检测凋亡细胞以及克隆形成实验得到肯定的结果(图1C和D)。研究者进一步使用NRP2 mAb(aNRP2-10)阻断VEGF/NRP2结合,增加了TNBC细胞对辐射的敏感性(图1E-G),表明VEGF/NRP2轴具有克服放疗细胞毒性的潜力。
为评估数据的转化相关性,研究者在体外实验中模拟了临床常规放疗方案,发现放疗抵抗的细胞中NRP2表达上调,使用aNRP2-10则增加了放疗敏感性(图1F)。研究者还使用了TNBC患者来源的类器官(PDOs)和异种移植物(PDXs)证明阻断NRP2以增强放疗敏感的有效性。免疫荧光和细胞活力实验证明aNRP2-10处理使PDO对辐射敏感(图1H)。依据NRP2细胞表面表达水平对PDX进行分选,研究者发现NRP2低表达细胞对放疗更敏感,而aNRP2-10处理增加了NRP2高表达细胞对放疗的敏感性(图1I)。

图1 抑制VEGF/NRP2增强TNBC的放射敏感性
2.表达NRP2的细胞是NO信号传导的枢纽
为研究NRP2促进放疗抵抗的机制,研究者对NRP2低表达和NRP2高表达TNBC细胞的转录组进行了分析,发现一氧化氮合酶NOS2上调以及一氧化氮(NO)介导的信号转导的相关基因富集(图2A)。一氧化氮是一种能够引发放射抗性的独特生物活性信使。随后,研究者通过免疫荧光检测了患者组织中NO的替代标志物硝基酪氨酸和NRP2的表达,尽管硝基酪氨酸和NRP2的定位存在显著的肿瘤内异质性,但Pearson共定位系数表明这两个标记物之间存在很强的线性关系(图2B)。研究者假定,NRP2表达的细胞通过调节NOS2表达,构成一个硝基化反应的核心枢纽。为证明VEGF/NRP2轴可以调节NOS2,研究者分别干扰了NRP2、VEGF-C的表达,以及使用aNRP2-10阻断VEGF/NRP2结合,发现TNBC细胞中NOS2显著下调(图2C)。并且在NRP2敲降的细胞中,NO替代标志物亚硝酸盐也减少(图2D)。为评估NO在细胞内的扩散能力,研究者做了如下实验:收集NRP2高表达细胞的培养基,添加DMSO或NO清除剂(c-PTIO),用于培养NRP2敲降的细胞。结果显示NRP2高表达细胞的培养基增加了硝基酪氨酸含量,使用c-PTIO则消除了这种作用(图2E)。
接下来,研究者从TCGA数据库中选择接受放射治疗的癌症患者,并根据其NRP2和NOS2 mRNA的表达进行分离。生存分析表明,NRP2和NOS2表达均高于中位的患者无病生存时间较短。为了验证NRP2/NOS2轴在放疗抵抗中的作用,使用化学抑制剂1400W或shRNAs抑制TNBC细胞中的NOS2活性,观察到在宽范围的辐射剂量下细胞存活率显著降低。在NRP2敲降细胞中过表达NOS2则逆转了放疗抵抗的表型(图2F)。重要的是,当用aNRP2-10处理时,NOS2过表达的TNBC细胞的放射敏感性没有发生变化,这表明aNRP2-1治疗后NOS2抑制对调节放射敏感性的必要性。
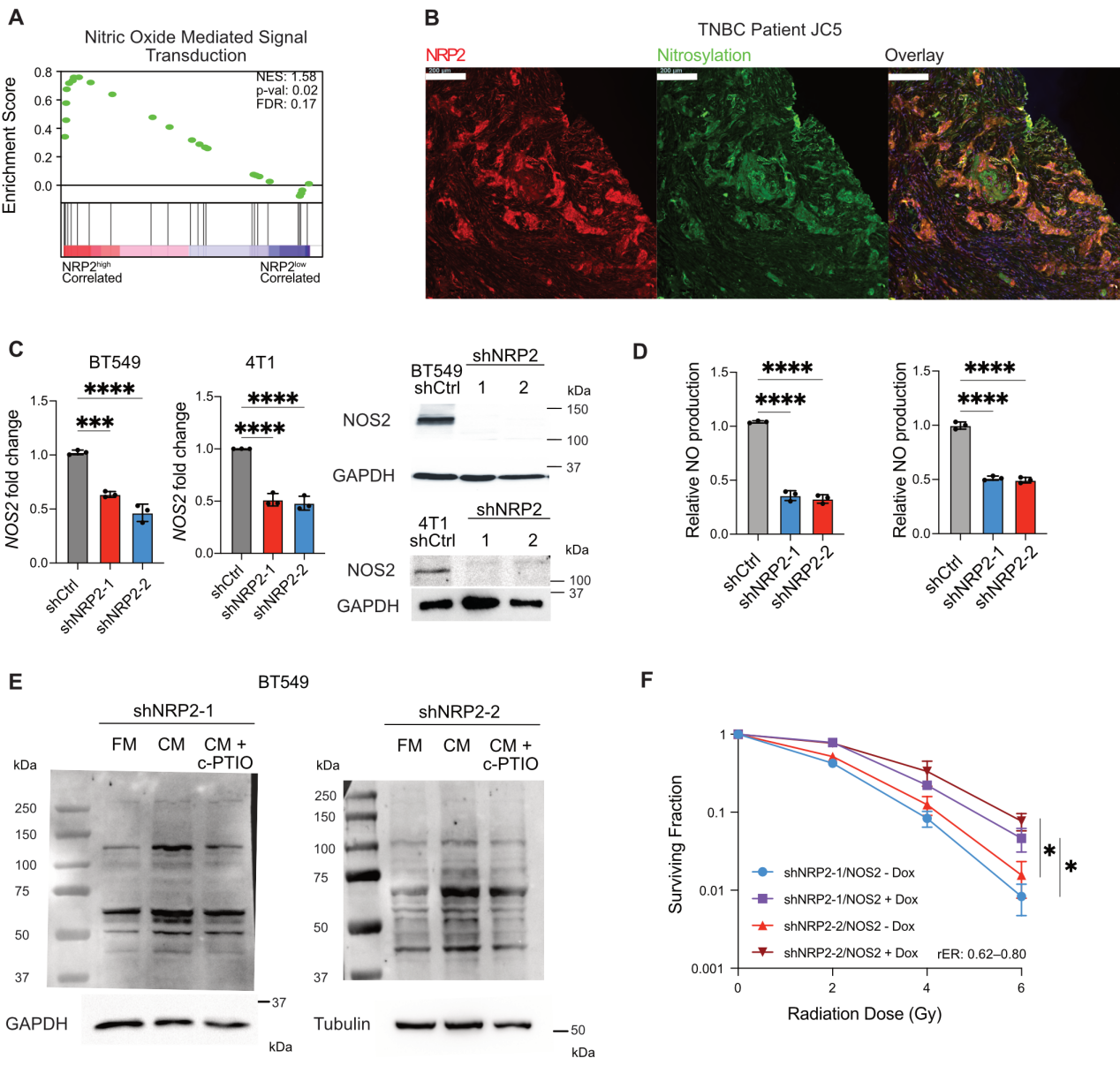
图2 表达NRP2的细胞是NO信号传导的枢纽
3.NRP2诱导NOS2表达以减轻辐射诱导的ROS
为进一步研究NRP2作用的硝基化反应介导放疗抵抗的机制,研究者评估了减轻辐射诱导的关键因素:DNA损伤修复和氧化应激。DNA损伤修复的指标之一是追踪照射后γ-H2AX焦点随时间的衰减。相比于对照组,NRP2敲降细胞检测到更多的γ-H2AX焦点,表明受到了更多的DNA损伤,或者其DNA损伤修复能力受到了影响(图3A)。研究者进一步检测了NRP2敲降细胞中ROS水平,ROS是引起DNA损伤积累的因素之一。使用ROS指示剂H2DCFDA,研究者发现辐射诱导NRP2敲降细胞和NRP2功能阻断的细胞中ROS增加(图3B和C)。在检测DNA损伤的彗星实验中,NRP2敲降细胞DNA损伤程度更高,而使用抗氧化剂N-乙酰半胱氨酸可以减轻NRP2敲降细胞DNA损伤,而对对照细胞没有作用(图3D)。以上实验表明,VEGF/NRP2可以最大限度地减少辐射诱导的ROS积累,并减轻DNA损伤。为检测VEGF/NRP2轴对ROS的缓冲作用是否依赖NOS2活性,使用1400W抑制NOS2功能,结果发现在NRP2敲降细胞中抑制NOS2,ROS水平没有明显变化,而对照组细胞抑制NOS2功能导致ROS水平上升(图3E)。并且在NRP2敲降细胞中过表达NOS2可以减少辐照诱导的ROS水平(图3F)。以上结果表明,NRP2/NOS2轴察省的NO可以减轻辐射诱导的氧化应激导致的DNA损伤。

图3 NRP2诱导NOS2表达以减轻辐射诱导的ROS
4.VEGF/NRP2通过Gli1调节NOS2转录
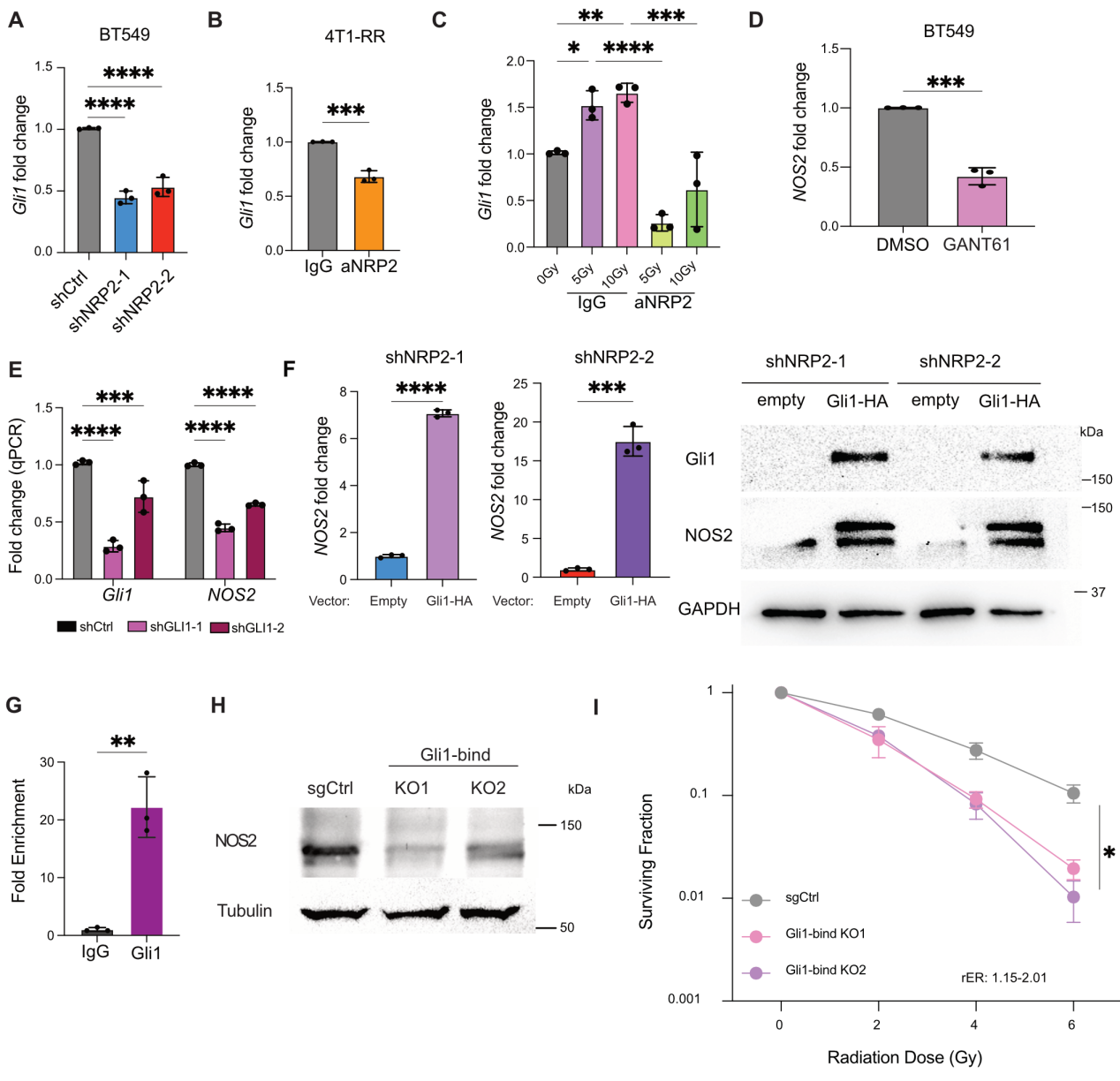
研究者过去研究发现,VEGF/NRP2下游信号通路诱导转录因子Gli1表达,在NRP2敲降和功能阻断细胞中Gli1表达降低(图4A和B)。并且,辐射增加了Gli1表达,但是在NRP2功能阻断后Gli1表达降低(图4C)。研究者假设NOS2是Gli1的靶基因,使用Gli1抑制剂GANT61处理TNBC细胞,发现NOS2 mRNA表达显著降低(图4D)。敲降Gli1得到了一致的实验结果(图4E)。而在NRP2敲降细胞中过表达Gli1则增加NOS2表达(图4F)。研究者结合已发表的Gli1 ChiP-seq数据和ChIP-qPCR实验,证明了Gli1可以与NOS2启动子结合(图4G)。为进一步证明Gil1驱动NOS2转录,研究者用CRISPR-Cas9技术敲除了Gil1与NOS2启动子结合的转录调控元件,结果导致NOS2 mRNA表达减少(图4H),并且这些细胞对辐照敏感(图4I)。以上结果说明NOS2表达依赖于Gli1的转录调控。
![]()
图4 VEGF/NRP2通过Gli1调节NOS2转录
5.NFE2L2活性依赖于NRP2诱导的NOS2表达
研究者接下来通过分析放疗敏感的TNBC细胞系和放疗抵抗的TNBC细胞系的转录组数据,进一步探索下游机制。NOS2 mRNA在放疗抵抗的TNBC细胞系中上调,并且NFE2L2/KEAP1通路在差异基因中富集。NFE2L2是抗氧化反应元件的关键调节因子,可以减轻癌症细胞中的ROS水平,并受NO调节。研究者假设,VEGF/NRP2通过诱导基于KEAP1(Cullin 3的泛素连接酶的成分之一)的S-亚硝基化,促进NFE2L2定位到细胞核。免疫荧光证明NRP2敲降和功能阻断细胞中,NFE2L2核定位减少(图5A和B)。研究者借助检测NFE2L2靶基因的表达证明NRP2敲降导致NFE2L2稳定性降低(图5C)。为证明NFE2L2依赖NOS2发挥活性,研究者敲降NOS2表达或者抑制其功能,发现NFE2L2核定位减少取决于NOS2表达,而不是NRP2(图5D)。
研究者发现使用NO清除剂c-PTIO会导致NFE2L2靶基因转录本减少;用对照组的培养液处理NRP2敲降细胞导致靶基因转录本增多,添加c-PTIO则会抵消这种效果。向NRP2敲降细胞中添加NO供体SNAP可以增加NFE2L2核定位(图5E)。接下来,研究者对在NRP2表达的细胞中NFE2L2靶基因的表达取决于NO产生和随后KEAP1的S-亚硝基化进行验证。研究者通过生物素转化和碘-TMT转化检测S-亚硝基化水平。NRP2敲降细胞中KEAP1的S-亚硝基化水平明显降低(图5F和G)。进一步,研究者构建了一个没有KEAP1结合结构域的活性NFE2L2(caNFE2L2)质粒,转入NRP2敲降细胞中。caNFE2L2的表达增加了辐射抵抗(图5H)。研究者发现分级辐射仅能在对照细胞中诱导NFE2L2激活,而NRP2敲除细胞没有这种反应(图5J)。这一结果表明,肿瘤在放射治疗期间依赖于表达NRP2的细胞来促进NFE2L2的激活,从而促进抵抗性。
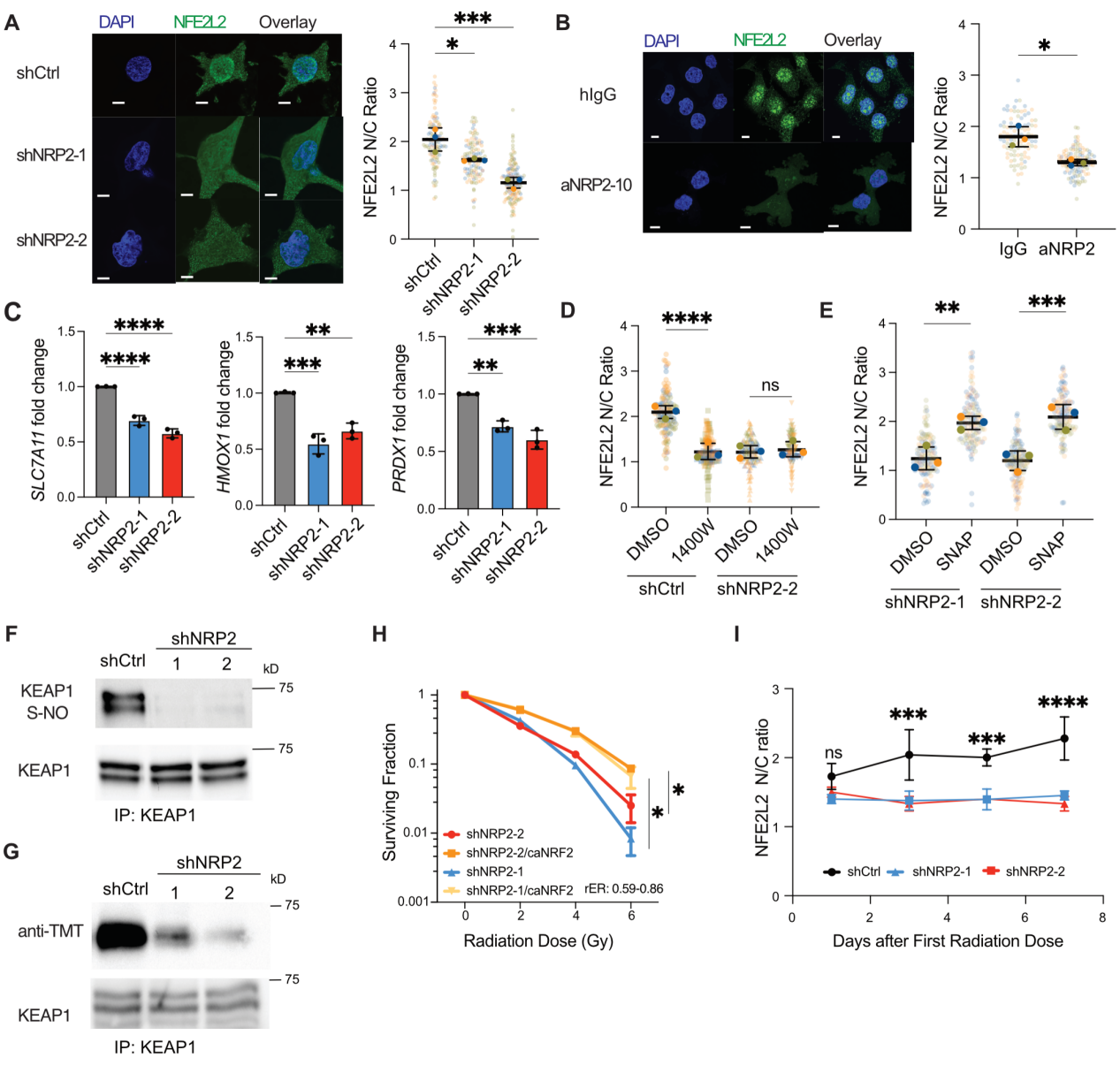
图5 VEGF/NRP2通过Gli1调节NOS2转录
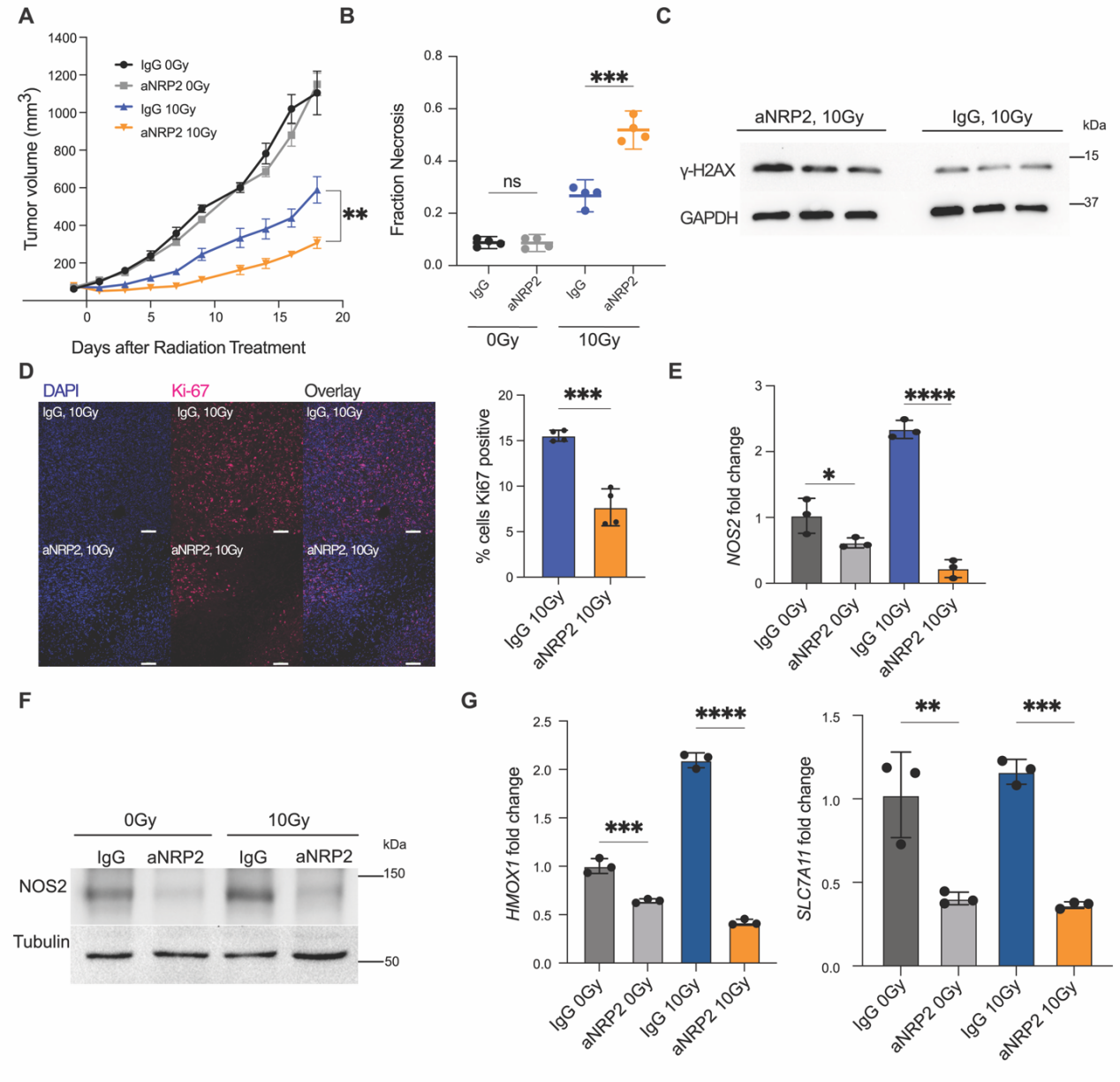
图6 NFE2L2活性依赖于NRP2诱导的NOS2表达
6.单剂量或常规分次放疗联合VEGF/NRP2抑制可延缓肿瘤生长
为了探究VEGF/NRP2抑制增强体内放射敏感性的潜力,研究者首先使用小鼠4T1三阴性乳腺癌(TNBC)细胞和单剂量放疗建立了同种异体移植模型。单次10Gy放疗剂量与aNRP2-28治疗的组合显著抑制了肿瘤生长,与单独任一治疗相比(图6A)。此外,联合治疗比其他治疗方案增加了肿瘤中的坏死(图6B)。使用γH2AX作为放射敏感性的可靠标记(37, 38),研究者观察到与IgG对照相比,VEGF/NRP2功能阻断抗体在放疗后增加了γH2AX的表达(图6C)。为了评估肿瘤的增殖能力,研究者分析了Ki-67的表达,并量化了有丝分裂细胞的数量。用aNRP2-28治疗的肿瘤在Ki-67阳性细胞的百分比上显著降低(图6D)并且有丝分裂细胞数量减少,表明VEGF/NRP2功能阻断抗体也限制了放疗后的肿瘤增殖。研究者证实了之前的研究结果,即VEGF/NRP2抑制抑制了NOS2(图6,E和F)和NFE2L2靶基因(图6G)的表达。与对照组相比,放疗的肿瘤中NOS2和NFE2L2靶基因的表达更高,而用aNRP2-28治疗则减轻了这些通路的表达。然后,研究者分析了常规分割放疗与aNRP2-28的组合效果。与单剂量放疗实验类似,VEGF/NRP2抑制与常规分割放疗的组合减轻了肿瘤的生长潜力(图7A),在肿瘤内增加了坏死(图7B),并且增加了γH2AX的保留(图7C)与单独IgG与传统分割放疗组相比。此外,aNRP2-28和放疗的联合治疗降低了NOS2(图7D)和NFE2L2靶基因(图7E)的表达,与单独传统分割放疗组相比。关于aNRP2的作用和安全性,小鼠体重或正常乳腺实质的组织学变化没有显著变化。
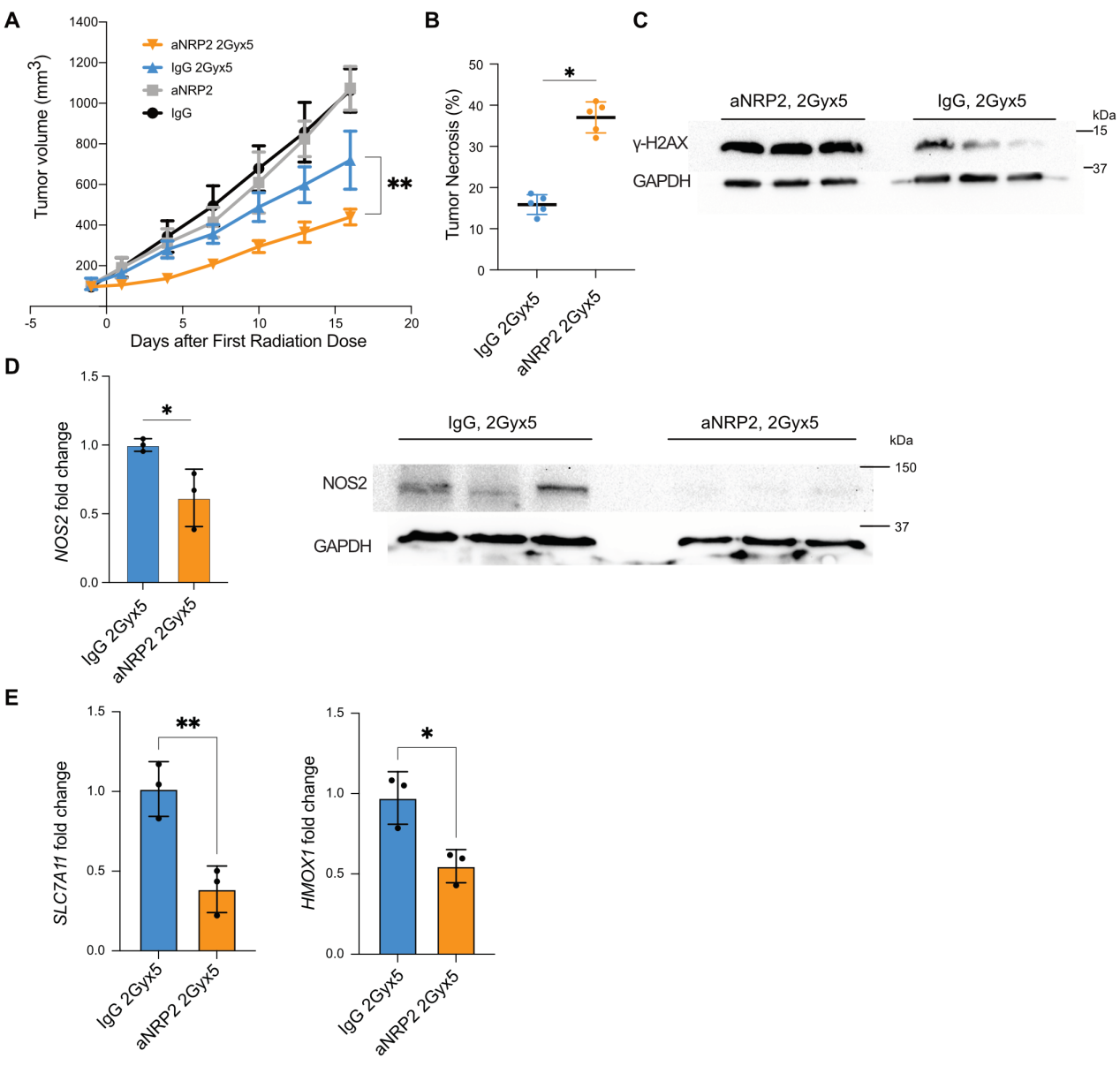
图7 单剂量或常规分次放疗联合VEGF/NRP2抑制可延缓肿瘤生长
7.aNRP2分次放疗促进肿瘤消退
放疗技术的进步和几项临床试验推动了在早期、低风险乳腺癌中使用低分割放疗。标准治疗通常需要25次分割的50Gy,而低分割减少了5-15次分割的数量,每次分割的辐射剂量更高。在这个实验中,研究者使用了一种侵袭性的TNBC PDX模型。当肿瘤达到适当的大小时,研究者开始按照图8A中概述的进行放疗和抗体治疗。单独的分割放疗或单独的aNRP2-10对肿瘤生长没有影响,这与TNBC对放疗的已知不敏感性一致。然而,联合治疗导致显著的肿瘤退缩(图8B),降低了肿瘤重量并增加了坏死(图8C)。研究者使用相同的实验方法与4T1移植模型,也导致与单独分割放疗相比,联合治疗组肿瘤退缩、肿瘤重量减轻和坏死增加。此外,与其它组相比,联合治疗组的肿瘤中检测到更高水平的γH2AX(图8D)。研究者观察到与单独放疗相比,联合治疗组的肿瘤中NOS2和NFE2L2靶基因的表达显著降低(图8E)。最后,aNRP2与低分割放疗的联合治疗对小鼠体重没有影响,与单独低分割组相比,在PDX或4T1模型中均无影响。
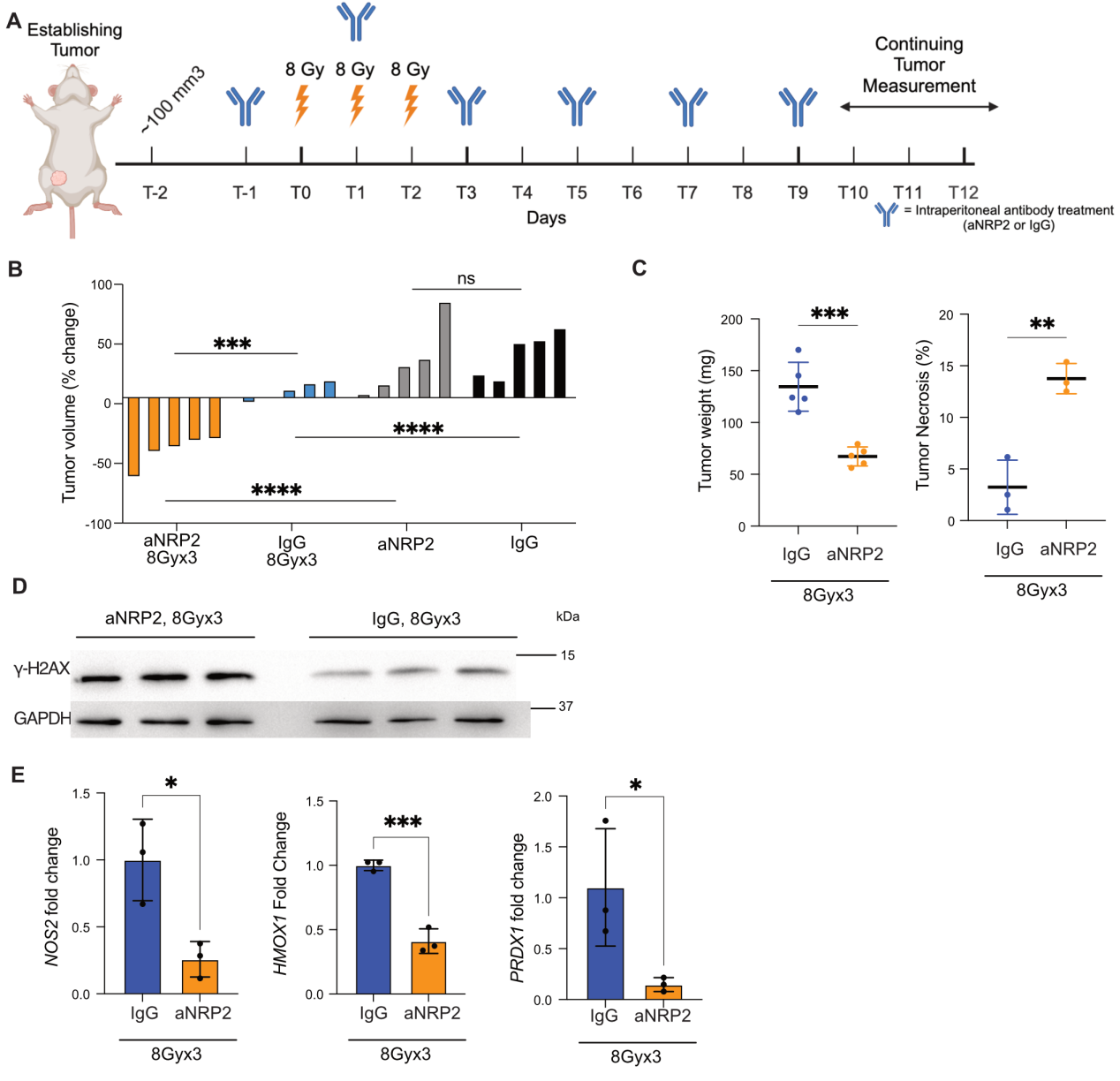
图8 aNRP2分次放疗促进肿瘤消退
结果
这项研究揭示了癌症中的一种信号通路,可用于提高肿瘤对放射治疗的敏感性。具体而言,TNBC中具有依赖于VEGF/NRP2信号传导的干细胞特性的细胞亚群作为局部产生NO的枢纽,促进KEAP1等效应蛋白的S-亚硝基化,使NFE2L2介导的抗氧化基因得以表达。因此,肿瘤细胞可以缓冲辐射诱导的ROS的积累,并减轻其下游效应,包括DNA损伤和细胞死亡。使用功能阻断的NRP2单克隆抗体来阻断这些细胞的亚硝化能力,恢复肿瘤细胞对放射治疗敏感性。
实验方法
基因表达谱分析、转录因子结合位点分析、RNA测序、免疫荧光和共定位分析、ChIP-qPCR实验、CRISPR-Cas9基因编辑、S-亚硝基化检测、细胞培养与辐射处理、克隆形成实验、细胞活力检测、流式细胞术、ROS检测、碱性彗星实验、NO浓度检测、同种异体移植模型、患者来源的异种移植物模型
参考文献
Kumar A, Goel H, Wisniewski C, et al. Neuropilin-2 expressing cells in breast cancer are S-nitrosylation hubs that mitigate radiation-induced oxidative stress. J Clin Invest. Published online October 1, 2024. doi:10.1172/JCI18136






