新发现!前列腺癌放疗抵抗标志物miR-200c-3p
放射治疗是前列腺癌(PCa)的主要治疗方法,但一些患者会出现放疗抵抗(RR)和复发。遗传和表观遗传改变、肿瘤本身或肿瘤微环境可能影响放射治疗的效果。更好地了解放疗抵抗的潜在机制以开发新的治疗方法至关重要,同时也需要敏感、稳健且侵入性最小的工具来预测对放射治疗(RT)的反应。在该研究中,作者发现miR-200c-3p可以作为前列腺癌的无创预后生物标志物并对其参与放疗抵抗的机制进行探讨。文章于2024年10月发表在《Cell Death & Disease》,IF=8.1。
技术路线
研究结果
1. miR-200c-3p在放疗抵抗的细胞及其细胞外囊泡中下调
亲本细胞(DU145和PC3)及其衍生的耐药细胞(DU145 RR和PC3 RR)被暴露在0、2、4和6Gy的递增剂量下,评估它们的辐射敏感性。克隆存活曲线确认,与亲本细胞相比,RR细胞具有显著的放疗抵抗(AUC DU154 RR 2.665 vs. DU145 2.164, RPF = 1.23),p < 0.01;以及AUC PC3 RR 1.698 vs. PC3 1.294, RPF = 1.31, p < 0.05)(图1A)。接下来,研究者对这些细胞进行了小RNA NGS,其中4个miRNA(表1,图1B),在DU145和PC3 RR细胞及其亲本对应物之间表达差异显著。hsa-miR-141-5p、hsa-miR-200c-3p、hsa-miR-335-3p和hsa-miR-138-5p在PCa放疗抵抗细胞中的表达与敏感细胞相比显著下调。研究者通过RT-qPCR确认了这些结果,除了hsa-miR-138-5p(图1C)。
然后,研究者调查了是否可能在细胞外检测到这些miRNA,以获得非侵入性生物标志物。通过Western blotting检测DU145细胞EVs中外泌体标记物的存在来评估EV纯度(图1D)。扫描透射电镜和TRPS技术用于检查小EVs的形态(图1D),观测值在典型小EVs的范围内。对这些小EVs进行了小RNA NGS(图1E)。与亲本细胞相比,从RR细胞衍生的小EVs中也发现了miR-200c-3p的显著下调。RT-qPCR验证了miR-200c-3p下调(图1F)。总之,这些结果表明miR-200c-3p是PCa化疗抵抗的潜在标志物。

图1 miR-200c-3p 在放疗抵抗的细胞及其细胞外囊泡中下调
2. MIR200C启动子甲基化水平与放疗抵抗相关
然后研究者研究了MIR200C启动子的DNA甲基化状态,以确定其表达下调是否是由于甲基化增加所致。焦磷酸测序发现MIR200C启动子在DU145细胞中略微甲基化,平均启动子范围的甲基化水平为6.5%,而在DU145 RR细胞中高度甲基化,启动子范围的平均值为57.5%(图2A)。而在获得放疗抵抗过程中的DU145细胞中,启动子的整体甲基化水平为40.7%(图2A)。
循环肿瘤DNA被用来评估微小残留病变和治疗反应监测的肿瘤特异性突变,但循环DNA的表观遗传特征,如甲基化模式,最近也被研究。因此,研究者使用甲基化敏感的qPCR方法测量了从DU145 RR和亲本细胞提取的DNA中小EVs中MIR200C启动子的DNA甲基化,与焦磷酸测序结果一致(图2B)。总体而言,细胞外DNA中MIR200C启动子的DNA甲基化水平可能是PCa放疗抵抗的另一个潜在标志物。
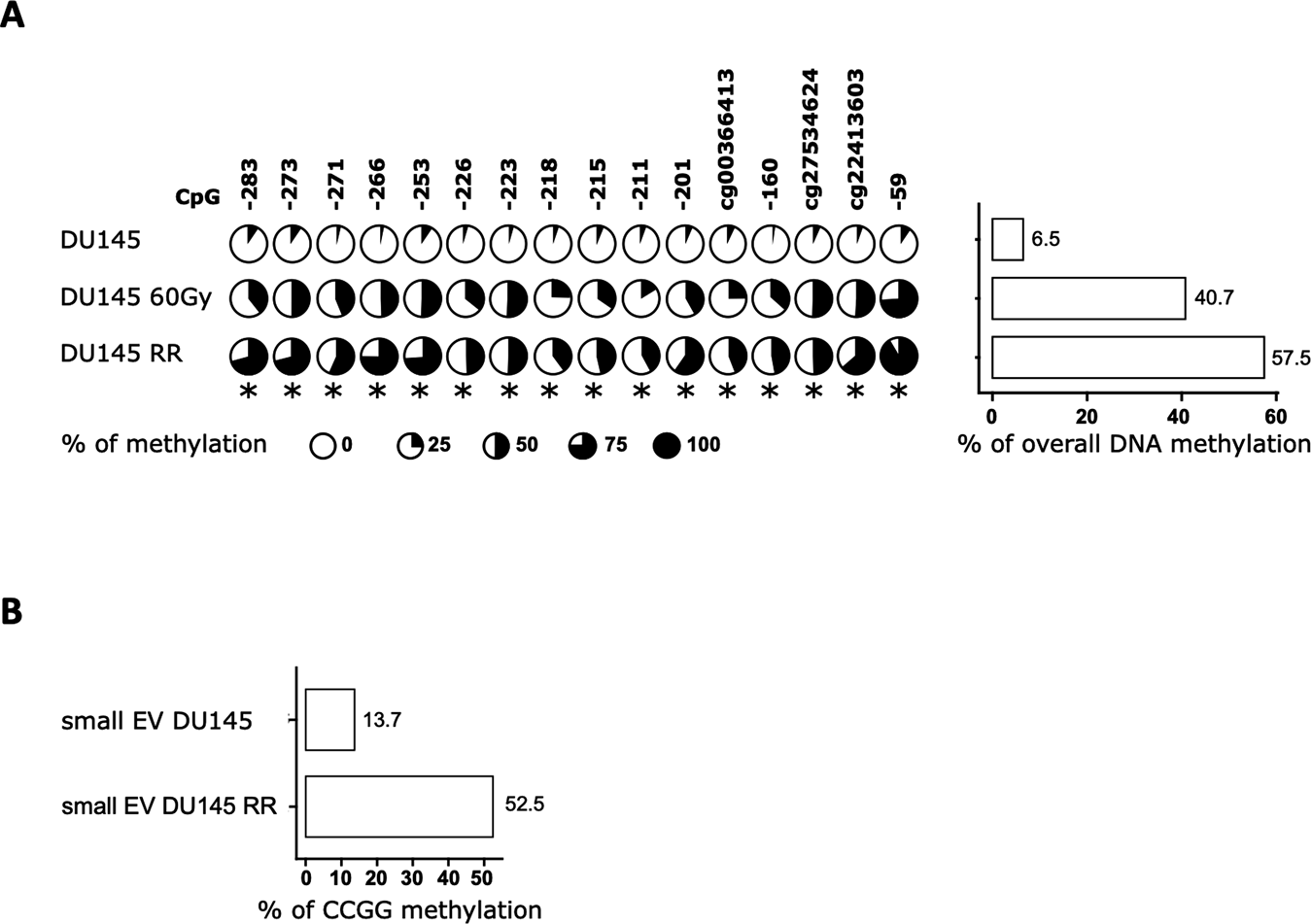
图2 MIR200C启动子甲基化水平与放疗抵抗相关
3. 外泌体miR-200c-3p通过阻碍DNA修复恢复放疗抵抗细胞的敏感性
由于在放疗抵抗(RR)细胞中miR-200c-3p的表达受到抑制,研究者想知道这种miRNA是否仅仅是一个生物标志物,或者它在获得抗性方面是否发挥作用。因此,研究者调查了通过外源性添加miR-200c-3p是否能使RR细胞重新对辐射敏感,证实转染miR-200c-3p的DU145 RR细胞在6Gy辐射后的放疗抵抗显著低于对照miRNA(miR-neg)的DU145 RR细胞(图3A)。外源性miR-200c-3p还降低了细胞的存活率(图2B),这表明这种miRNA促进了放疗抵抗细胞的死亡。
为了进一步研究miR-200c-3p促进DU145 RR细胞辐射敏感性的机制,研究者通过免疫荧光测量了辐射诱导的双链断裂(DSBs)的标记物γ-H2AX的表达。在6Gy辐射后多达6小时,转染miR-200c-3p的DU145 RR细胞和对照miRNA的细胞之间γ-H2AX焦点的数量非常接近。然而,在24小时后,转染了miR-200c-3p的DU145 RR细胞中γ-H2AX焦点的数量显著多于转染了对照miRNA的细胞(图3C,D)。与这些发现一致,研究者观察到在转染了miR-200c-3p的DU145 RR细胞中,DNA DSBs相关蛋白53BP1的水平比转染了对照miRNA的细胞更高(图3C,E)。综合研究者的结果表明,miR-200c-3p减少了辐射后的DNA修复,可能通过这种方式使放疗抵抗细胞重新敏感。
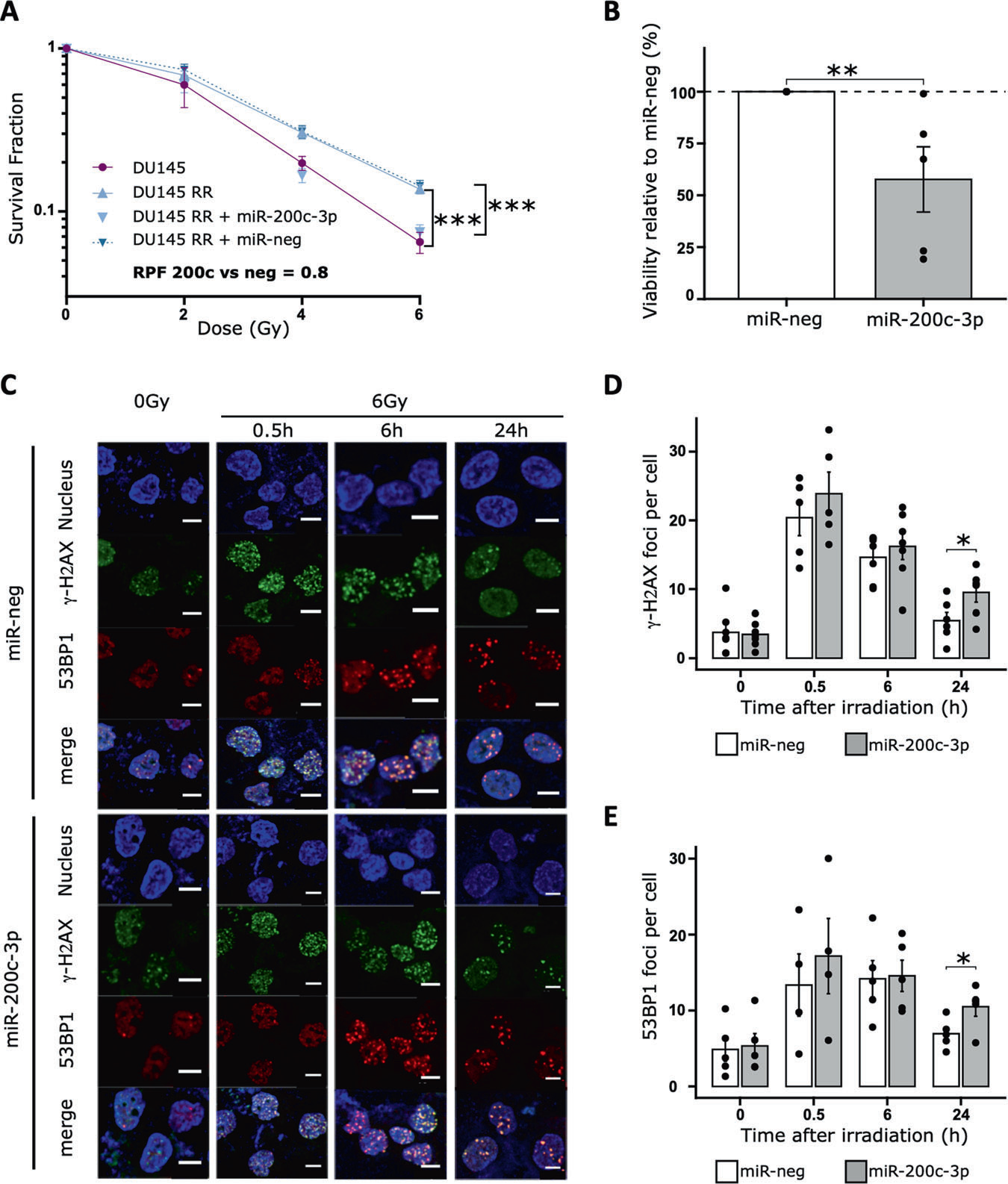
图3 外泌体miR-200c-3p通过阻碍DNA修复恢复放疗抵抗细胞的敏感性
4. miR-200c-3p通过下调HP1α阻碍DNA修复
为了确定miR-200c-3p在DNA修复中的靶点,研究者对DU145、DU145 RR以及转染miR-200c-3p或对照miRNA的DU145 RR细胞进行了3' RNA测序。发现在DU145 RR细胞和亲本细胞之间有934个显著差异表达的mRNA(图4A),其中482个在DU145 RR细胞中下调,452个上调。通过分析转染了miR-200c-3p和对照miRNA的DU145 RR细胞的转录组,研究者鉴定出1114个差异表达的mRNA(图4B),其中606个在转染miR-200c-3p的细胞中上调,508个下调。KEGG通路分析显示,与增殖相关的多种功能富集,如细胞周期通路(图4C,D),以及DNA修复,如NHEJ通路。然后研究者将两次转录组分析交叉对比,以识别在DU145 RR细胞相对于DU145细胞中上调,而在转染miR-200c-3p的细胞中下调的mRNA,寻找已有功能验证的miR-200c-3p靶基因。通过这种方式,研究者鉴定了19个mRNA作为DU145 RR细胞中上调的潜在miR-200c-3p靶基因(图4E)。其中一个有趣的候选基因是CBX5(chromobox homolog 5),它编码HP1α(Heterochromatin Protein 1 alpha)蛋白,该蛋白涉及异染色质形成并与DNA修复机制密切相关。通过RT-qPCR验证了CBX5的3' RNA测序结果后,研究者评估了miR-200c-3p对CBX5的直接靶向作用。共转染miR-200c-3p与选定的CBX5 3'UTR序列下游的RenSP荧光素酶报告基因进入HEK-293细胞(图5A)。研究者发现miR-200c-3p直接结合到CBX5 3'UTR。引入3(mut1)到4(mut2)个错配消除了这种相互作用(图5A)。Western blot验证了miR-200c-3p转染对HP1α蛋白表达的影响,miR-200c-3p可以下调CBX5 mRNA导致其蛋白HP1α表达的减少(图5B)。综合这些数据,miR-200c-3p对放疗抵抗的影响可能是通过调节HP1α表达介导的。
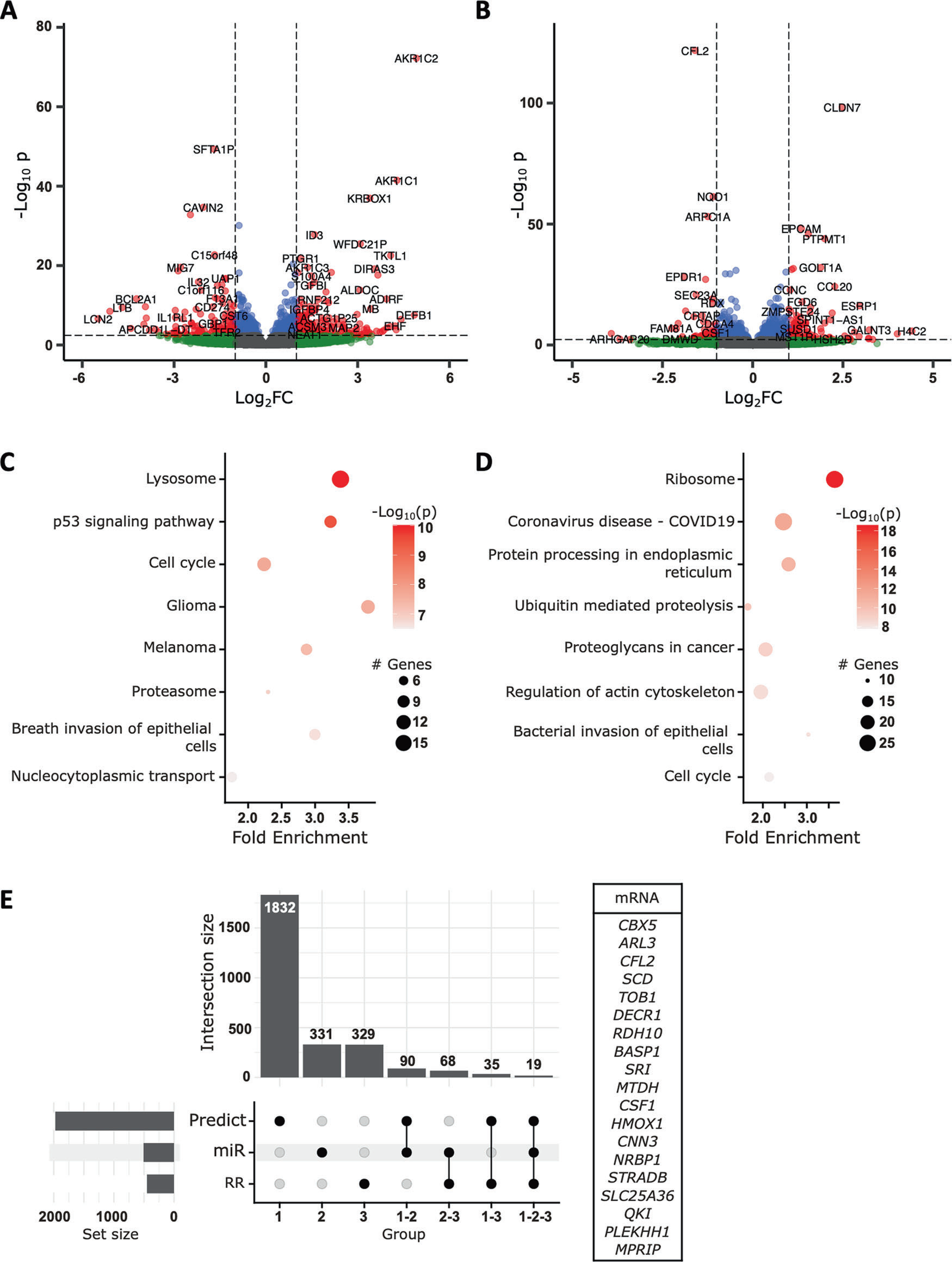
图4 miR-200c-3p通过下调HP1α阻碍DNA修复
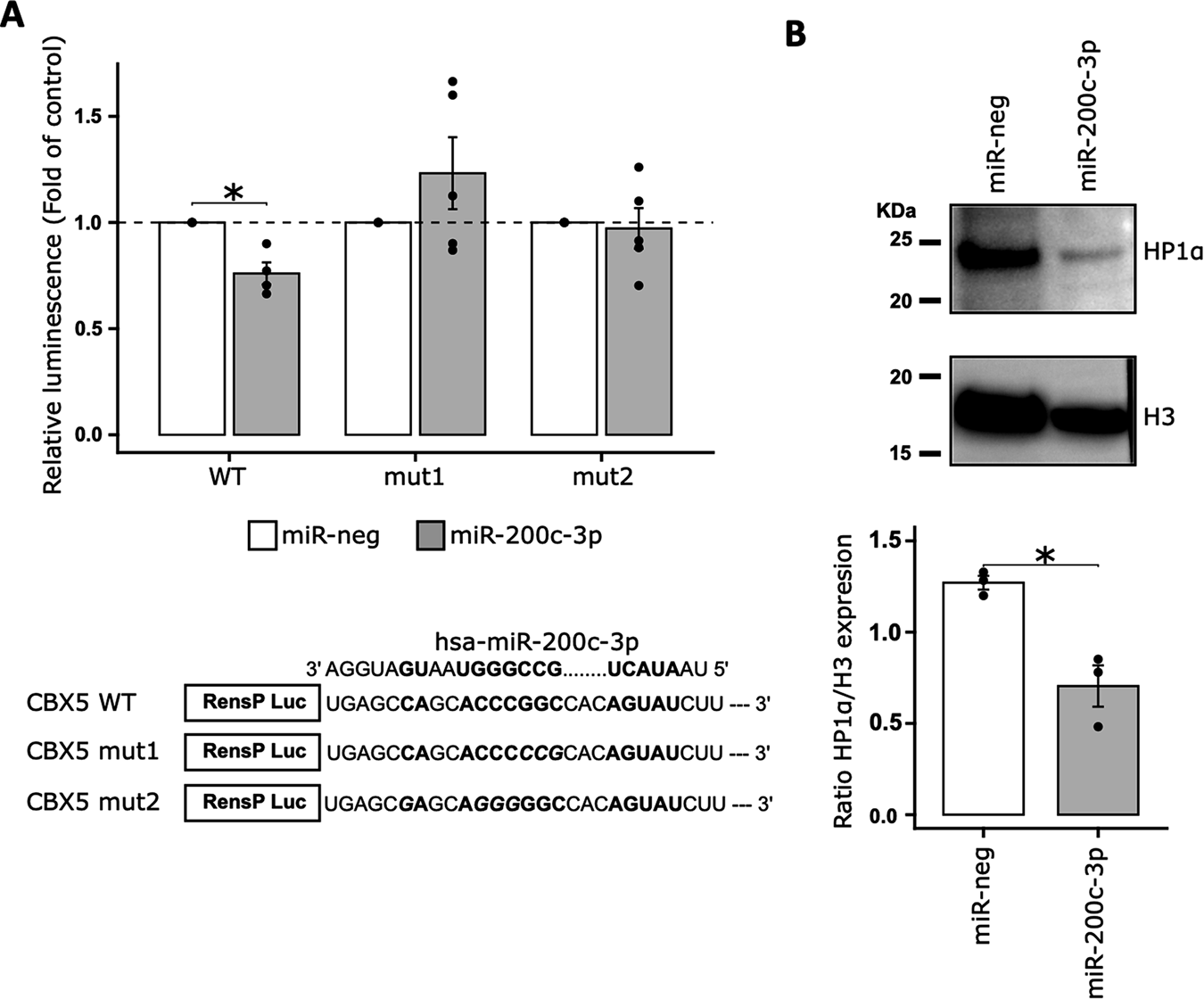
图5
5. miR-200c-3p沉默是放疗抵抗的常见机制
接下来,研究者想知道这种机制是否特异于PCa,通过测量其他接受放疗的癌症细胞系中miR-200c-3p的表达。在肺癌中,研究者发现5个细胞系(H838、ADCA211、ADCA233、ADCA72和A549)表现出miR-200c-3p表达水平较低,3个细胞系(H1975、H358和H1437)表达水平高,还有一个表达水平介于两者之间(ADCA153)(图6A)。健康细胞似乎显示出miR-200c-3p表达水平较低。有趣的是,除了H1437在从单个细胞生长到克隆方面效率不高外,研究者观察到miR-200c-3p表达与6Gy辐射后细胞存活相关(图6B)。表达水平低的细胞系比表达水平高的miR-200c-3p的细胞系有显著存活。研究者还评估了两个乳腺癌细胞系之间的这种相关性,一个是已知对辐射有抗性的,即MDA-MB-231,另一个是已知对放疗敏感的(MCF-7),并确认在抗性细胞中miR-200c-3p表达显著低于MCF-7细胞(图6C)。此外,miR-200c-3p表达与其启动子的DNA甲基化水平在肺癌和乳腺癌细胞系中强烈相关(图6D)。
接下来,研究者调查了这些表达miR-200c-3p水平低的RR细胞是否可以通过外源性添加来重新对辐射敏感。克隆形成证明转染了miR-200c-3p的ADCA72和A549细胞在6Gy辐射后的放疗抵抗显著低于转染了对照miRNA(miR-neg)的ADCA72和A549细胞(图6E)。为了评估在这些细胞中CBX5是否也是miR-200c-3p的一个重要靶标,研究者首先通过RT-qPCR评估了其表达。研究者观察到在肺癌细胞系中miR-200c-3p表达与其潜在靶标CBX5之间存在良好的相关性。接下来,研究者通过RT-qPCR测量了转染miR-200c-3p或对照miRNA的ADCA72和A549细胞中CBX5的表达。在A549细胞系中,CBX5似乎不是miR-200c-3p的主要靶标,而在ADCA72细胞系中,研究者观察到当细胞转染miR-200c-3p与miR-neg相比时,CBX5表达的下降与DU145 RR细胞中观察到的相同(图6F)。研究者认为这些细胞系之间涉及抗性的机制是共同的。研究者得出结论,miR-200c-3p沉默是不同类型癌细胞中放疗抵抗的共同机制。
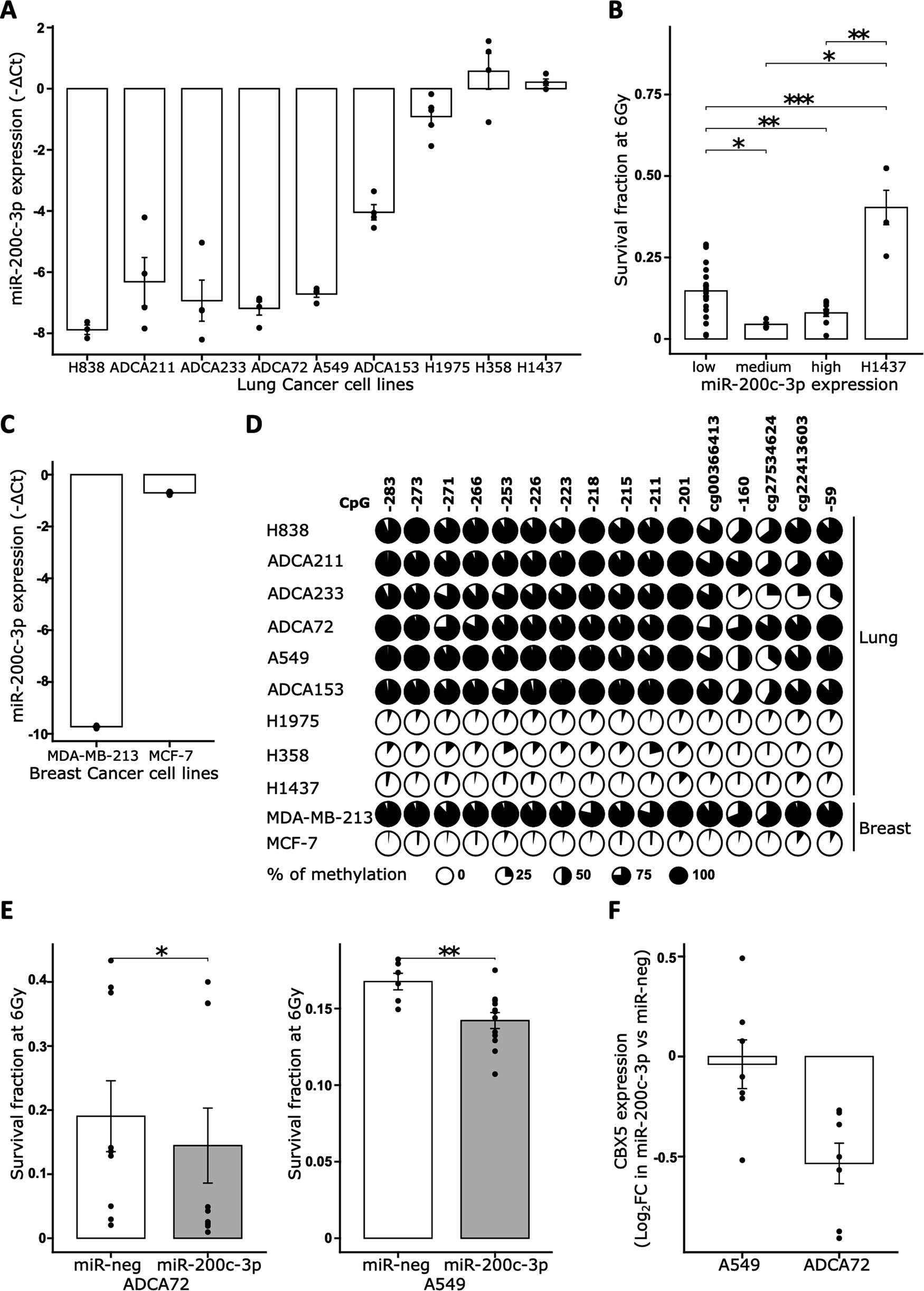
图6 miR-200c-3p沉默是放疗抵抗的常见机制
结论
本文的结论指出,miR-200c-3p在前列腺癌中的表达下调与放疗抵抗相关,并且其通过靶向HP1α来延迟DNA修复,从而增强癌细胞对放射治疗的敏感性。此外,miR-200c-3p的沉默及其启动子的甲基化在多种癌症中是放疗抵抗的共同机制,使其成为一个有潜力的生物标志物,用于预测和监测放射治疗的反应。
实验方法
KEGG通路分析、靶基因预测与分析、小RNA测序、3' RNA测序、DNA甲基化分析、荧光素酶报告基因分析、Western Blot、RT-qPCR、细胞培养与辐射处理、克隆形成实验、细胞外囊泡(EVs)的纯化和定量、细胞活性实验、免疫荧光实验
参考文献
Seok, H.J., Choi, J.Y., Lee, D.H. et al. Atomoxetine suppresses radioresistance in glioblastoma via circATIC/miR-520d-5p/Notch2-Hey1 axis. Cell Commun Signal 22, 532 (2024). https://doi.org/10.1186/s12964-024-01915-






