CircHipk3通过促进NLRP 3转录以及抑制自噬在巨噬细胞炎性坏死中发挥双重作用,进而诱导腹主动脉瘤形成
腹主动脉瘤(AAA)是一种严重的慢性炎症性疾病,可导致腹主动脉局部扩张超过正常直径的50%,可能引发血管破裂,导致高发病率和死亡率。目前已知 circRNA可调控巨噬细胞焦亡,进而促进AAA中的炎症与基质金属蛋白酶(MMP)活性协同作用,但circRNA在调节AAA中巨噬细胞焦亡的具体作用尚不明确。本研究旨在探讨巨噬细胞焦亡启动子circHipk3对AAA的贡献及其潜在机制。研究发现,与正常动脉相比,主动脉瘤中CircHipk3明显上调。在经circHipk3治疗的小鼠中,巨噬细胞焦亡促进了炎症与MMP合成的协同作用,显著加速了血管紧张素(Ang)II和猪胰弹性蛋白酶(PPE)酶诱导的AAA形成。机制方面,通过RNA纯化分离染色质表明,circHipk3通过与Stat3相互作用促进巨噬细胞焦亡,增加主动脉中的NLRP 3水平,并通过结合Snd 1促进Ptbp1 mRNA降解以抑制自噬。总之,该研究揭示了circHipk3在巨噬细胞焦亡中的重要作用,其通过双重机制诱导动脉瘤形成和进展。该研究于2024年11月发表在《Clinical and Translational Medicine》上,IF:7.9。
技术路线:

主要研究结果:
1. 人类腹主动脉瘤和血管紧张素II诱发的小鼠AAA中均观察到细胞焦亡标志物表达升高和纤维化增加
为了确定细胞焦亡是否在人类和小鼠动脉瘤中发挥作用,作者评估了细胞焦亡标志物,包括NLRP3、CASP1、GSDMD和IL-1β,并分析了人类主动脉瘤和小鼠AAA中的MMP2/9。此外,作者进行了Masson三色染色以观察胶原纤维的状况。从接受AAA切除术的患者身上采集了人体组织和相应的相邻AAA正常样本。Masson三色染色显示AAA患者主动脉中的胶原蛋白减弱。qPCR结果表明,细胞焦亡标志物NLRP3、CASP1和IL-1β的表达在人类AAA中显著上调。Western blotting结果显示,与非动脉瘤组织相比,诱导细胞外基质(ECM)降解的NLRP3、MMP2和MMP9在人和小鼠主动脉瘤组织中显著增加。在Ang II诱导的小鼠AAA中,Masson三色染色、qPCR和Western blotting实验的结果与人AAA样本的结果一致。免疫组化呈现NLRP3、CASP1、GSDMD和IL-1β的表达趋势。免疫组化用于检查人和小鼠AAA样本中NLRP3、CASP1、GSDMD和IL-1β的表达趋势。结果显示,在人和小鼠AAA中,这些与细胞焦亡相关的关键蛋白的表达水平均上调。总的来说,研究结果表明增强的细胞焦亡与AAA的病理进展之间存在潜在关联。
2. CircHipk人类和小鼠AAA组织表达增加
CirHipk3是一个1099bp的环状RNA,来源于Hipk3基因外显子2,位于2号染色体(qE2),如circBank(http://www.circbank.cn/;mmu_circ_0001052;图1A)中所述。图1B说明了circHipk3的三维结构。首先,作者证实circHipk3比线性转录本更稳定(图1C)。进行免疫荧光染色(图1D)并使用定量实时PCR从巨噬细胞中分离细胞质和核RNA(图1E)以确定circHipk3的亚细胞分布。结果表明circHipk3主要位于巨噬细胞的细胞质中。
接下来,为了验证circHipk3参与AAA形成的病理过程,作者检测了人AAA和小鼠AAA中circHipk3的表达情况。qPCR检测和ISH结果均表明,人AAA组织中circHipk3的表达明显高于邻近的非动脉瘤组织(图1F,G)。如前所述,作者建立了AngII诱导的小鼠AAA模型和PPE诱导的小鼠AAA模型,以及两者的对照,以研究AAA组和对照组小鼠主动脉circHipk3表达水平的不同。总体而言,与对照组小鼠相比,AAA模型小鼠的腹主动脉凸起更明显,表明成功建立了广为接受的AAA模型类型(图1H)。qPCR和ISH鉴定出AngII和PPE诱导的AAA模型小鼠中circHipk3的表达水平明显高于野生型对照小鼠(图1H-M)。此外,作者检测了ApoE−/−和C57BL/6J小鼠不同器官和组织中circHipk3的表达,发现qPCR检测显示circHipk3在主动脉中最丰富(图1N)。作者进一步评估了人和小鼠AAA组织中circHipk3与细胞焦亡标志物NLRP3、CASP1和IL-1β表达之间的相关性。结果表明,在人AAA组织中,circHipk3的表达与NLRP3和IL-1β的表达呈正相关。虽然circHipk3和CASP1之间存在正相关的趋势,但并未达到统计学意义。类似地,在小鼠AAA样本中,circHipk3表达与NLRP3和CASP1表达呈正相关。然而,circHipk3和IL-1β之间呈正相关的趋势未达到统计学意义。这表明circHipk3可能与细胞焦亡有关,并可能参与调节AAA的病理过程。此外,为了阐明AAA中circHipk3的细胞来源,作者对人和鼠样本进行了circHipk3与巨噬细胞标志物CD68和平滑肌细胞标志物α-SM-actin的免疫荧光共染色。作者的研究结果显示,在正常小鼠主动脉中circHipk3的表达极少,α-SM-actin的表达较高,表明没有共定位,并且没有CD68表达。在AngII诱导的小鼠AAA中,circHipk3和CD68的表达均显著增加,且存在显著的共定位,而α-SMactin表达显著降低,重叠最小。在PPE诱导的小鼠AAA中也观察到了类似的情况。与小鼠数据一致,人类无病主动脉(NDA)和AAA样本显示出可比的结果。上述结果表明,小鼠AAA中的circHipk3主要来源于巨噬细胞,并且可能主要在这些细胞内发挥其功能。
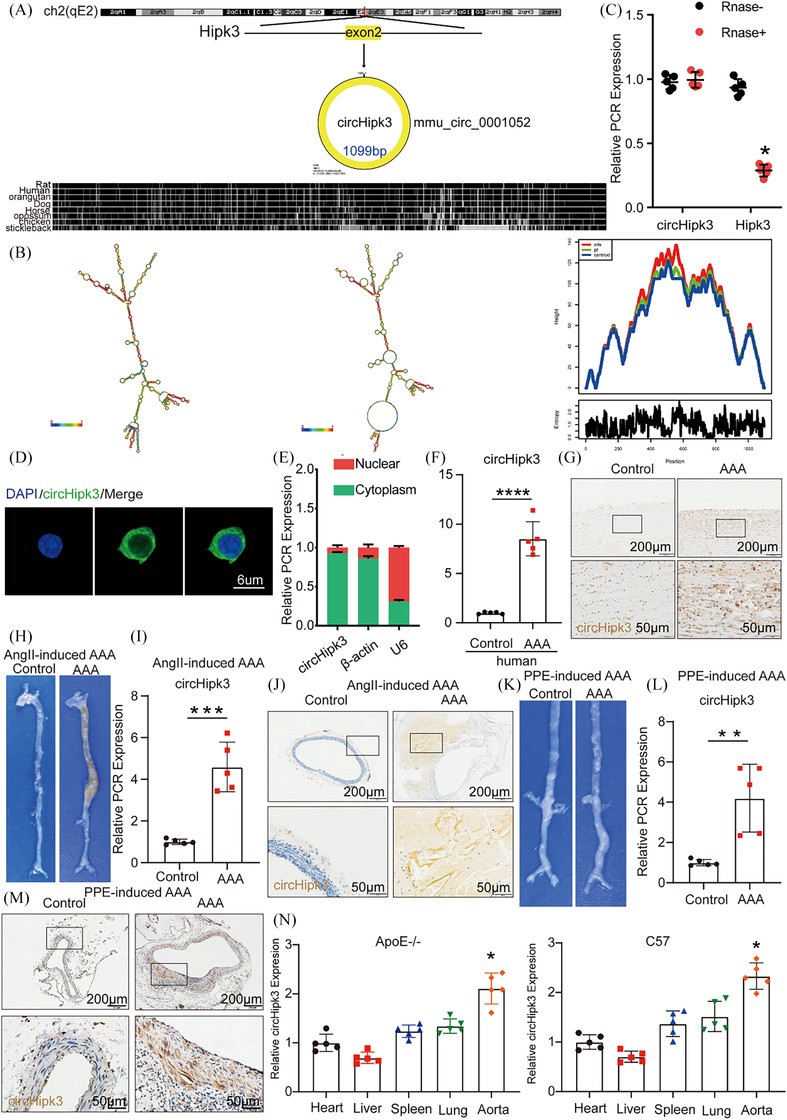
图 1 人类和小鼠腹主动脉瘤(AAA)组织中circHipk3表达增加
3. CircHipk3促进巨噬细胞焦亡
为了检验巨噬细胞是否是导致AAA发生和发展的主要细胞亚群,并确定在AAA的背景下,细胞焦亡是否主要发生在这些巨噬细胞中。作者从健康小鼠和用弹性蛋白酶治疗14天以诱发动脉瘤的小鼠的IAA(GSE152583,PMID:32678909)中获取了scRNA-seq数据。在对scRNA-seq数据集进行质量控制、数据整合、降维和聚类后,作者根据标记基因手动识别了3017个细胞中的九种不同细胞类型(图2A、B)。结果表明,与假手术组相比,AAA组的巨噬细胞百分比显著增加(图2C)。选择通过平均对数(倍数变化)确定的每种细胞类型的前五个特定标记基因,以将每种细胞类型与所有其他细胞类型区分开来(图2D)。此外,通过UMAP和小提琴图可视化,作者观察到与假手术组相比,弹性蛋白酶14 d组的巨噬细胞亚群中,细胞焦亡标志基因NLRP3、CASP1和GSDMD选择性上调(图2E)。作者的研究结果表明巨噬细胞作为细胞焦亡的主要细胞,参与了AAA细胞焦亡的病理过程。进一步探讨circHipk3在巨噬细胞中的生理作用。
在细胞实验中,作者用LPS诱导巨噬细胞发生细胞焦亡。首先,为了进一步确认circHipk3是否除了巨噬细胞外还在血管平滑肌细胞(VSMC)中发挥作用,作者检查了circHipk3在VSMC中的定位、其对细胞焦亡的影响以及其相对含量。作者发现circHipk3也主要位于细胞质中,可以促进VSMC中细胞焦亡标志物NLRP3的表达,但与巨噬细胞相比,其在VSMC中的表达较低,这表明circHipk3主要不在VSMC中起作用。在后续的细胞实验中,作者发现在LPS诱导的细胞焦亡基础上,敲低circHipk3降低了qPCR检测到的NLRP3、CASP1、IL-1β和IL-18的mRNA水平(图2F)。透射电子显微镜显示LPS刺激的巨噬细胞具有指示细胞焦亡的特征,包括:(1)细胞肿胀和细胞内细胞器破坏,(2)大量囊泡和细胞碎片释放,(3)染色质凝聚和核膜破裂。敲低circHipk3后,这些细胞焦亡的形态特征减弱。在染色质染色实验(TUNEL)中,敲低circHipk3导致巨噬细胞凋亡减少。免疫荧光染色显示,敲低circHipk3可降低LPS刺激后巨噬细胞焦亡标志物CASP1和NLRP3的激活(图2G,H)。此外,敲低circHipk3可降低PI染色评估的巨噬细胞坏死率(图2I)。同样,当circHipk3被敲低时,NLRP3、clCASP1、GSDMD-N、IL-1β和IL-18的蛋白质印迹结果也相似(图2J)。总之,结果表明巨噬细胞在AAA焦亡中起主导作用,而circHipk3可以促进巨噬细胞焦亡。

图 2 circHipk3促进巨噬细胞焦亡。骨髓来源的巨噬细胞(BMDM)用si-SCR或circHipk3小干扰RNA片段转染24 h,然后用浓度为 500 ng/mL 的脂多糖 (LPS) 处理另外24 h
4. 敲低circHipk3可抑制ApoE−/−小鼠中AngII诱导的AAA形成,而过表达circHipk3可促进AngII诱导的C57BL/6J小鼠中AAA形成
为了进一步明确circHipk3是否参与AAA的发生发展,作者采用携带circHipk3敲除构建体的AAV-9(sh-circHipk3)或携带circHipk3过表达构建体的AAV-9(AAVcircHipk3)以及相应的假病毒对照组((AAV)-SCR-RNA/AAV-mScarlet)进行功能获得和丧失实验。免疫荧光证实circHipk3过表达或敲低构建体成功整合到主动脉壁中。qPCR证实circHipk3过表达或circHipk3敲低组小鼠主动脉中circHipk3水平上调或下调。宏观观察发现,sh-circHipk3小鼠腹主动脉膨大明显小于SCR-RNA组转染的apoE−/−小鼠(图3A)。同样,超声成像也显示出同样的趋势(图3B)。与SCR-RNA组相比,敲低circHipk3可以降低AAA的发生率(图3C),而sh-circHipk3组的破裂率和主动脉最大直径降低(图3D,E),表明circHipk3可以促进AAA形成。作者进一步观察了circHipk3是否通过促进细胞焦亡和ECM降解来诱导AAA形成。与作者的假设一致,弹性纤维染色(EVG)显示敲低circHipk3可以抑制AngII诱导的弹性蛋白降解,胶原纤维染色(Masson)显示sh-circHipk3组小鼠的纤维化较少(图3F,G)。免疫组化染色显示,在sh-circHipk3小鼠中,巨噬细胞标志物CD68、细胞焦亡标志物NLRP3、CASP1和金属蛋白酶MMP2和MMP9的表达显着降低(图3H-L)。Western印迹结果表明,敲低circHipk3可降低小鼠主动脉中NLRP3、GSDMD-N、cleavedCASP1、IL-18、IL-1β、MMP2和MMP9的表达水平(图3M)。相反,与AAV-mScarlet组相比,在受AngII刺激的C57BL/6J小鼠中过表达circHipk3可促进AAA形成(图4A),而超声成像(图4B)、AAA发生率(图4C)、AAA破裂率(图4D)和最大主动脉直径(图4E),反映AAA病变严重程度的circHipk3在AAV-mScarlet组中增加。与这些结果一致,过表达circHipk3促进了AngII诱导的弹性蛋白降解(图4F),AAV-circHipk3小鼠表现出更多的纤维化(图4G)。免疫组织化学显示,过表达circHipk3上调了巨噬细胞标志物CD68、细胞焦亡标志物NLRP3、CASP1、金属蛋白酶MMP2和MMP9的表达(图4H-L)。Westernblot结果显示,过表达circHipk3显着增加了细胞焦亡标志物NLRP3、GSDMDN、cleavedCASP1、IL-18、IL-1β、金属蛋白酶MMP2和MMP9的表达(图4M)。根据这些结果,circHipk3足以通过促进巨噬细胞焦亡来引发AAA,随后触发炎性细胞因子分泌和ECM降解。为了进一步阐明circHipk3在AAA内巨噬细胞中的作用,作者生成了HBAAV2/2-F4/80病毒,该病毒含有驱动circHipk3表达的巨噬细胞特异性启动子。在确认主动脉巨噬细胞成功转导并评估转导效率后,作者观察到在针对腹主动脉的巨噬细胞中特异性过表达circHipk3导致AAA病变大小增加,NLRP3表达上调。表明circHipk3在巨噬细胞焦亡中起重要作用,并影响AAA的进展。
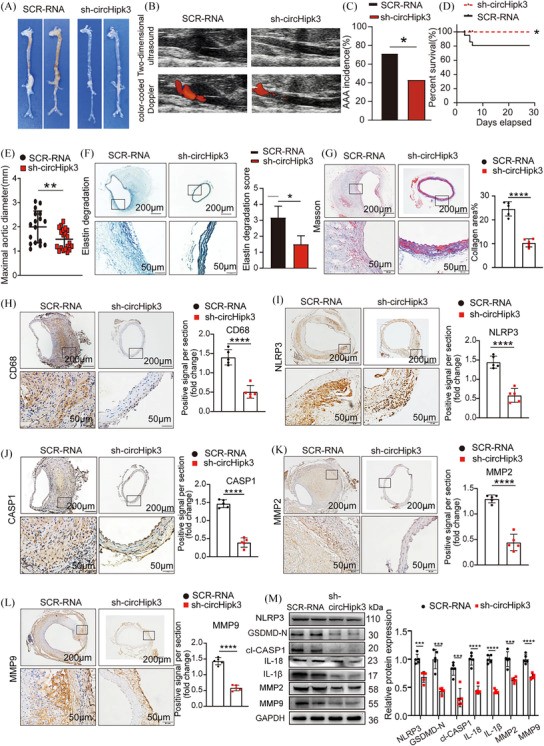
图 3 敲低circHipk3可抑制Ang II诱导的AAA形成并降低与细胞焦亡和金属蛋白酶相关的炎症分子的水平

图 4 circHipk3的过度表达促进Ang II诱导的AAA形成并增加与细胞焦亡和金属蛋白酶相关的炎症分子的水平
5. 敲低circHipk3可抑制C57BL/6J小鼠中PPE诱导的AAA形成,而过表达circHipk3可促进C57BL/6J小鼠中PPE诱导的AAA形成
为了探索circHipk3对AAA形成的潜在影响是否独立于AngII,并考虑到所用动物模型和病毒感染模式的可能影响,作者扩展了研究范围,使用PPE诱导的AAA模型和ADV干预技术深入研究circHipk3在AAA发展中的作用。免疫荧光证实circHipk3过表达或敲低构建体成功整合到主动脉壁中。qPCR证实circHipk3过表达或circHipk3敲低组小鼠主动脉中circHipk3水平上调或下调。将PPE应用于小鼠肾下主动脉外膜2周后,结果显示,宏观上,sh-circHipk3组小鼠腹主动脉凸起不明显,而SCR-RNA组小鼠则无此表现(图5A)。此外,sh-circHipk3组小鼠腹主动脉最大直径减小(图5B)。弹性纤维(EVG)染色显示,shcircHipk3组小鼠弹性蛋白的降解程度较SCR-RNA组轻(图5C)。胶原纤维染色(Masson)结果显示,sh-circHipk3组小鼠纤维化程度较低(图5D)。免疫组织化学染色显示,当敲低circHipk3时,巨噬细胞标志物CD68、细胞焦亡标志物NLRP3、CASP1和金属蛋白酶MMP2和MMP9表现出与AngII诱导的AAA中观察到的趋势相同的趋势(图5E-I)。此外,Westernblot结果显示,敲低circHipk3可降低PPE诱导的AAA中NLRP3、GSDMD-N、cl-CASP1、IL-18、IL-1β、MMP2和MMP9的表达(图5J)。
相反,从宏观上看,与ADVmScarlet组相比,C57BL/6J小鼠中circHipk3的过表达导致PPE诱导下的AAA扩张更显著(图6A)。ADV-circHipk3组的最大主动脉直径增加(图6B)。此外,circHipk3的过表达促进了PPE诱导的弹性蛋白降解(图6C),AAV-circHipk3小鼠表现出更多的纤维化(图6D)。免疫组织化学显示,circHipk3的过表达上调了巨噬细胞标志物CD68、细胞焦亡标志物NLRP3、裂解CASP1、金属蛋白酶MMP2和MMP9的表达(图6E-I)。Westernblot结果显示,过表达circHipk3可显著增加细胞焦亡标志物NLRP3、GSDMDN、cl-CASP1、IL-18、IL-1β、金属蛋白酶MMP2和MMP9的表达(图6J)。总体而言,在PPE诱导的AAA中,circHipk3还会促进巨噬细胞焦亡,从而引发炎症因子的分泌和ECM的降解,加速AAA的进展。
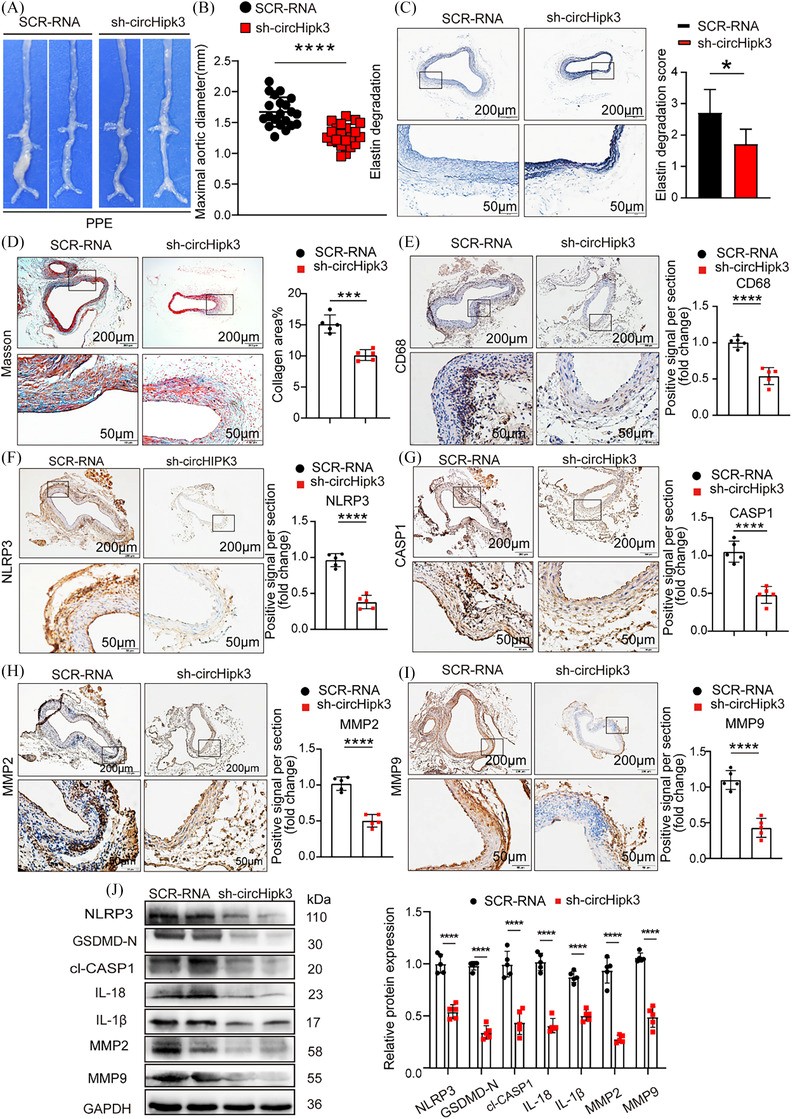
图 5 敲低circHipk3可抑制猪胰腺弹性蛋白酶(PPE)诱导的AAA形成,并降低与细胞焦亡和金属蛋白酶相关的炎症分子水平
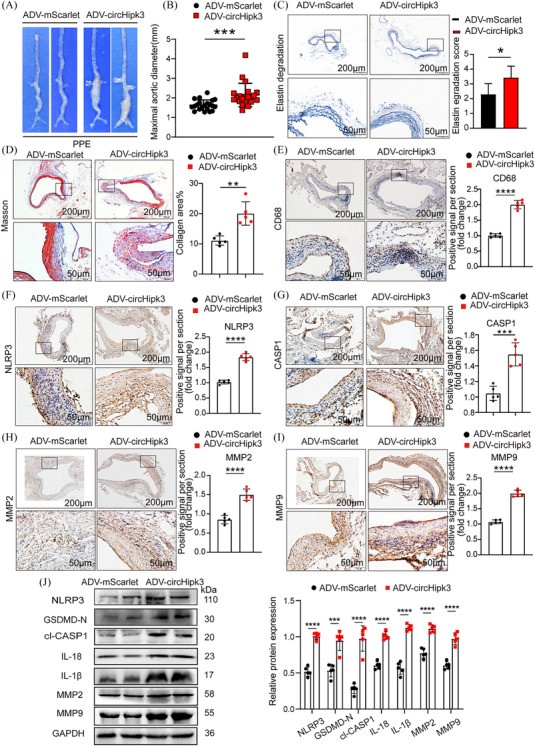
图 6 circHipk3的过度表达促进PPE诱导的AAA形成并增加与细胞焦亡和金属蛋白酶相关的炎症分子的水平
6. CircHipk3通过与Stat3相互作用促进巨噬细胞焦亡
接下来,作者进一步阐明circHipk3在巨噬细胞中发挥作用的潜在机制。作者进行了ChIRP分析并切除了circHipk3特异性带进行质谱分析(图7A)。在将circHipk3特异性结合蛋白与基因卡中的细胞焦亡相关基因重叠后,作者确定了10种重叠的细胞焦亡相关蛋白以供进一步分析(图7B)。随后,作者进行了进一步分析,以展示GSE51227(PMID:25358394)转录组数据集中10种重叠的细胞焦亡相关蛋白的差异表达。PCA显示AAA样本和对照明显分离成离散簇(图7C)。在10种重叠的细胞焦亡相关蛋白中,Stat3和Tlr2的表达水平在GSE51227数据集中不同(图7D,E)。所描绘的热图和差异表示图提供了令人信服的证据,表明Stat3和Tlr2在GSE51227数据集中表现出明显不同的表达水平(图7F、G)。qPCR证实Stat3和Tlr2水平在AAA中上调(图7H)。
作者选择Stat3作为潜在靶蛋白,因为它在激活NLRP3炎症小体中起上游作用,并已确定参与AAA的进展。根据catRAPID网站(http://service.tartaglialab.com/page/catrapid_group)的预测,circHipk3可能与Stat3相互作用(图7I)。此外,作者随后通过进行RIP测定证实了circHipk3和Stat3之间的相互作用,结果表明,与非特异性IgG抗体相比,抗Stat3抗体可使circHipk3富集(图7J)。发现Stat3与circHipk3特异性结合,这通过蛋白质印迹法得到验证(图7K)。根据Genotype-TissueExpression项目(https://gtexportal.org/home/)的表达数据,Stat3mRNA在主动脉和冠状动脉中高度表达(图8L)。Westernbolt的结果表明Stat3在人AAA中高表达(图8M)。接下来,作者研究了circHipk3和Stat3之间的相互作用是否影响Stat3水平。增强的circHipk3显着增加了巨噬细胞中的Stat3蛋白水平(图7N)。为了阐明circHipk3和Stat3相互作用的分子机制,作者使用蛋白质合成抑制剂环己酰亚胺(CHX)处理了circHipk3敲低的巨噬细胞。值得注意的是,与对照巨噬细胞相比,circHipk3敲低的巨噬细胞中Stat3的半衰期显着缩短,这表明circHipk3对Stat3降解具有延缓作用。(图7O)。接下来,作者进一步探讨了Stat3的过表达是否影响NLRP3和IL-1β以及IL-18的蛋白质表达水平。作者的相关性分析表明,在细胞焦亡关键基因中,NLRP3与Stat3的关联程度最高(图7P、Q)。先前的研究表明,Stat3能够结合NLRP3启动子并增强H3K9乙酰化和NLRP3转录,以及NLRP3/CASP1介导的细胞焦亡。19–23Stat3的过表达上调了NLRP3、IL-1β和IL-18的蛋白质表达水平(图7R–U)。此外,为了证明Stat3促进IL-1β和IL-18的成熟,作者评估了过表达Stat3的巨噬细胞中IL-1β和IL-18的RNA水平,并使用ELISA测量细胞上清液中成熟的IL-1β和IL-18的水平。作者的研究结果表明,Stat3的过表达显著上调了巨噬细胞中的RNA水平以及ELISA检测的上清液中IL-1β和IL-18的水平。circHipk3的过表达增强了NLRP3、IL-1β和IL-18的表达;然而,这种影响被Stat3的敲低所消除。总之,上述结果表明circHipk3通过Stat3-NLRP3-IL-1β/IL-18通路调节巨噬细胞焦亡。
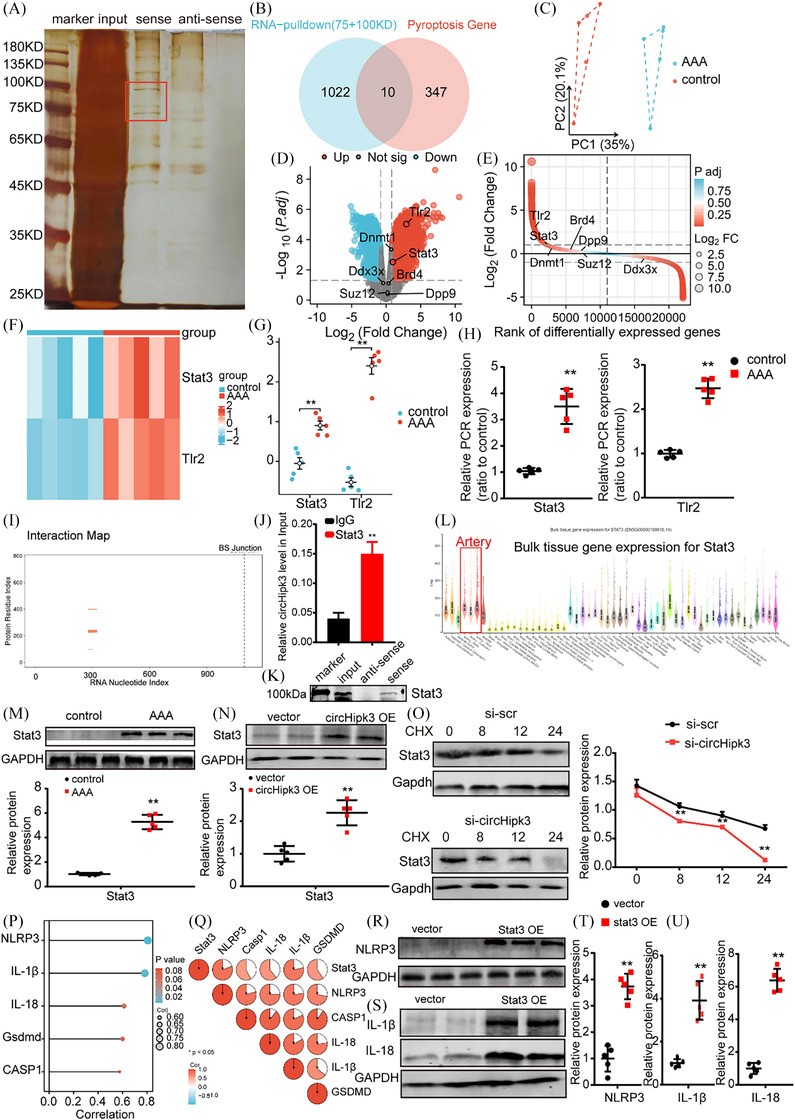
图 7 CircHipk3通过与Stat3相互作用促进巨噬细胞焦亡

图 8 CircHipk3通过促进Ptbp1 mRNA降解来抑制自噬,从而促进巨噬细胞焦亡
7. CircHipk3通过促进Ptbp1mRNA降解来抑制自噬,从而促进巨噬细胞焦亡
先前研究表明,细胞内自噬在清除过量的NLRP3炎症小体中起着关键作用,自噬的减弱会导致NLRP3炎症小体的积累。24–26此外,研究表明circHipk3抑制自噬的形成。27–29作者观察到过表达circHipk3会抑制自噬相关蛋白Atg5和Beclin1的表达(图8A,B)。相反,敲低circHipk3会促进自噬形成,免疫荧光分析和自噬通量增加(图8C)都证明了这一点。此外,作者用透射电子显微镜观察到敲低circHipk3后巨噬细胞的自噬小体显著增加,表明circHipk3对自噬有抑制作用。使用维恩图方法,作者确定了Ptbp1和Snd1是与自噬调节相关的circHipk3下游靶点(图8D)。RIP测定证实了Snd1和Ptbp1与circHipk3的特异性结合,随后的蛋白质印迹法也证实了这一点(图8E-G)。生物信息学预测、qPCR和蛋白质印迹分析进一步证实了AAA条件下Ptbp1和Snd1水平升高(图8H-J)。值得注意的是,circHipk3的过表达与Ptbp1表达增加有关,表明circHipk3水平与Ptbp1稳定性呈正相关。为了探索circHipk3和Ptbp1相互作用的分子机制,先前的研究发现circRNA可以影响Ptbp1mRNA的稳定性。作者研究了circHipk3是否会影响Ptbp1mRNA的稳定性并介导Ptbp1的表达。使用放线菌素D和二甲基亚砜(DMSO)抑制RNA合成的实验表明,circHipk3会随时间破坏Ptbp1mRNA的稳定性(图8K)。对Snd1作用的进一步研究表明,它显著影响BMDM中Ptbp1mRNA的半衰期(图8L、M)。这使作者假设Snd1促进了circHipk3和Ptbp1mRNA之间的相互作用,从而增强了Ptbp1的稳定性。在BMDM中敲低Snd1后进行的RNA下拉分析证实了circHipk3探针对Ptbp1mRNA的富集减少,突出了Snd1对circHipk3和Ptbp1-3'UTR结合能力的影响(图8N)。此外,在过表达circHipk3后,作者观察到自噬蛋白Beclin1水平下降。然而,当作者过表达Ptbp1时,这种影响被逆转了。总之,作者的研究结果表明Snd1可能通过调节circHipk3和Ptbp1RNA分子之间的相互作用来调节Ptbp1mRNA水平。
结论:
总之,研究结果表明,circHipk3在促进细胞因子分泌和MMP合成的协同作用中起着关键作用,从而加剧了巨噬细胞焦亡并有助于AAA的形成。从机制上讲,circHipk3通过与Stat3相互作用,增加主动脉中的NLRP 3水平,并通过结合Snd 1促进Ptbp1 mRNA降解以抑制自噬,从而促进巨噬细胞焦亡来增强这种协同效应。鉴于其在AAA发病机制中的中心参与,circHipk3成为减轻AAA形成和破裂的有希望的治疗靶点。旨在调节circHipk3水平或活性的努力有可能预防和管理这种使人衰弱的血管疾病。
实验方法:
qRT-PCR、WB、IF、RNA原位杂交、超声成像、ChIRP、碘化丙啶染色、TUNEL染色、ELISA、细胞培养、转染及处理、建立小鼠疾病模型
参考文献:
Cai D, Li C, Zhang Y, et al. CircHipk3 serves a dual role in macrophage pyroptosis by promoting NLRP3 transcription and inhibition of autophagy to induce abdominal aortic aneurysm formation. Clin Transl Med. 2024;14(12):e70102. doi:10.1002/ctm2.70102






