国自然热点-线粒体自噬文章精讲
尽管线粒体自噬在2型糖尿病(T2DM)引起的糖尿病心肌病(DCM)发病机制中的确切作用仍存在争议,但近期研究表明,线粒体自噬的抑制会加重DCM中的心脏损伤。已有报道指出,高糖环境下心肌细胞中的锌转运蛋白ZIP7表达上调,而在缺血/再灌注情况下,ZIP7的上调会导致小鼠心脏中线粒体自噬受到抑制。然而,关于ZIP7在T2DM引起的DCM中的作用及其与线粒体自噬的关系,目前了解甚少。在T2DM小鼠心脏中,ZIP7表达上调,而ZIP7条件性敲除(cKO)减少了T2DM小鼠心脏中的线粒体活性氧(ROS)生成。T2DM抑制了小鼠心脏中的线粒体自噬,而ZIP7 cKO则阻止了这种抑制。T2DM抑制了心脏线粒体中PINK1和Parkin的积累,而ZIP7 cKO则阻止了这种抑制作用,这表明ZIP7上调通过抑制PINK1/Parkin途径介导了T2DM诱导的线粒体自噬抑制。T2DM导致线粒体超极化并降低线粒体Zn²⁺含量,而ZIP7 cKO则阻止了这一现象,这表明ZIP7上调通过减少线粒体内的Zn²⁺导致线粒体超极化。最后,ZIP7 cKO阻止了T2DM引起的心脏功能障碍和纤维化。ZIP7上调通过抑制PINK1/Parkin途径,介导了T2DM对小鼠心脏中线粒体自噬的抑制。ZIP7上调导致的线粒体Zn²⁺减少,是PINK1/Parkin途径被抑制的原因。预防ZIP7上调对于治疗T2DM引起的心肌病至关重要。本文于2024年11月发表于“Cardiovascular Diabetology”(IF=8.5)上。
技术路线:

结果:
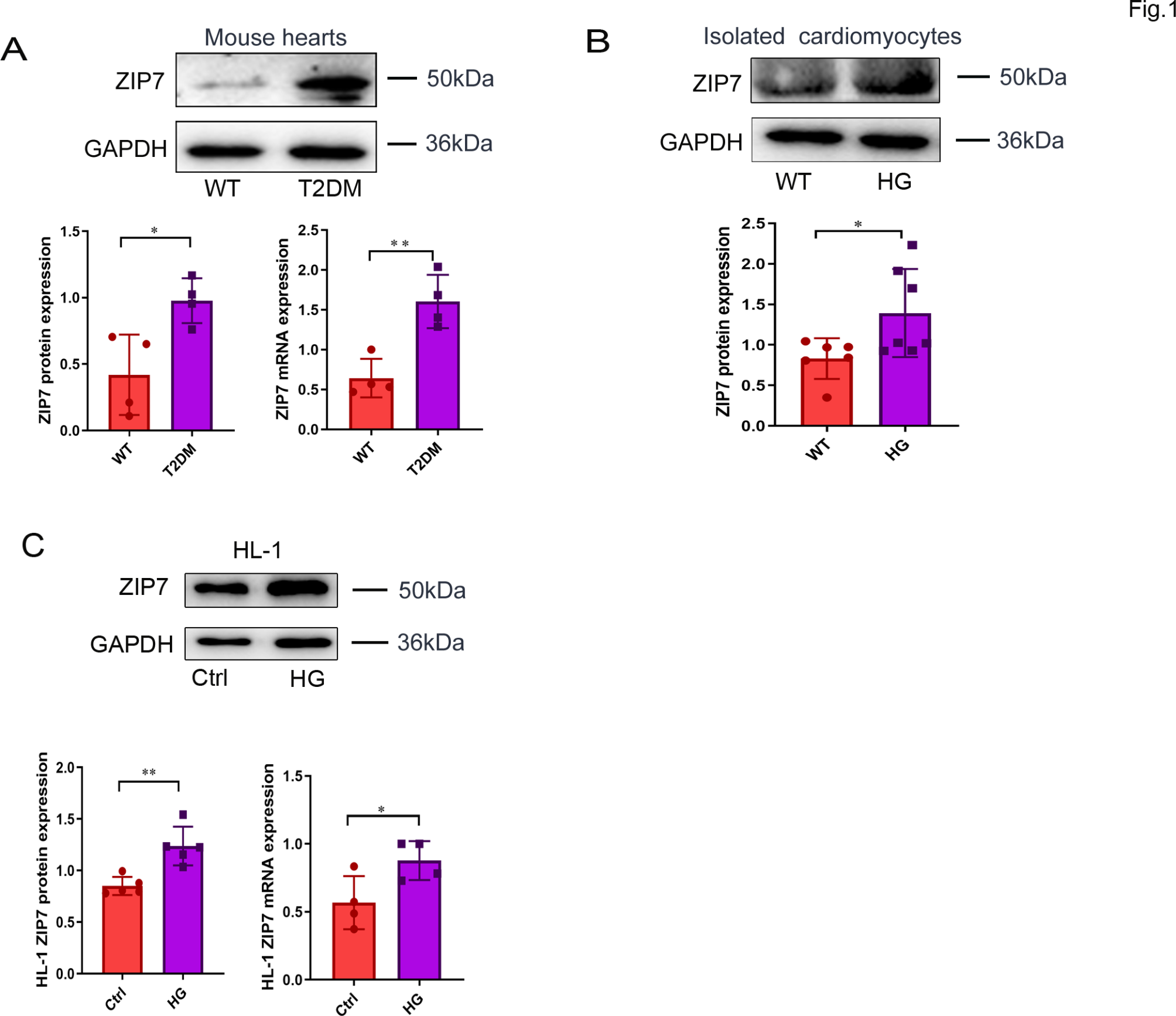
1)T2DM和高糖均上调ZIP7
为了测试ZIP7的表达是否会被T2DM改变,我们测量了其在小鼠心脏和心脏细胞中的蛋白表达。如图1A所示,ZIP7 mRNA和蛋白在T2DM小鼠心脏中的表达明显升高。同样,暴露于35 mM葡萄糖48小时的离体小鼠心肌细胞(图1B)、HL-1细胞(图1C)中ZIP7的表达也上调。这些结果表明ZIP7可能在T2DM诱导的心脏病中发挥作用。
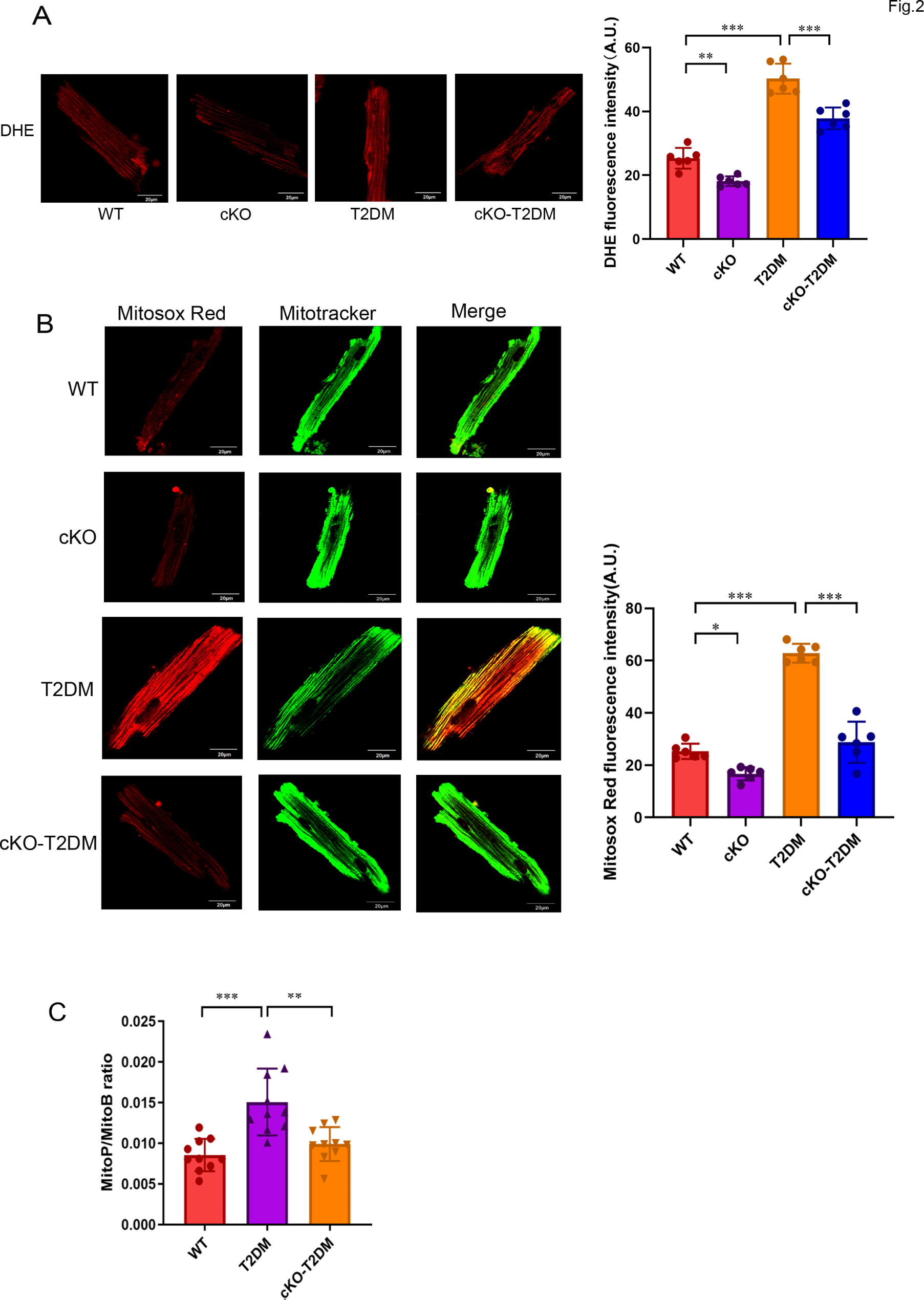
2)T2DM小鼠心脏线粒体ROS升高,ZIP7的缺失降低了线粒体ROS
已有研究提出,线粒体活性氧(ROS)生成增加导致的氧化应激有助于糖尿病心肌病(DCM)的发病。因此,我们检测了2型糖尿病(T2DM)是否能改变心脏中线粒体ROS的生成,并确定了ZIP7在线粒体ROS生成中的作用。图2A(左)显示,与从野生型(WT)小鼠中分离的心肌细胞相比,T2DM小鼠的心肌细胞显示出更高的DHE荧光强度,这表明T2DM增强了心肌细胞的ROS生成。然而,心脏特异性ZIP7敲除(cKO)阻止了T2DM诱导的ROS生成,如DHE荧光强度降低所示(图2A),这表明ZIP7可能在T2DM诱导的心肌病中介导ROS生成。进一步的实验使用了Mitosox Red(一种线粒体超氧化物指示剂),结果显示T2DM增加了线粒体ROS的生成,而ZIP7 cKO逆转了这一效应(图2B),这表明ZIP7可能有助于T2DM引起的心脏线粒体ROS生成。为了证实这一发现,我们使用MitoB(一种线粒体靶向的光谱H2O2探针)在体内检测了小鼠心脏中的线粒体H2O2水平。图2C显示,与WT相比,T2DM心脏中的MitoP/MitoB比率显著增加,而ZIP7 cKO逆转了这一变化,这表明ZIP7介导了T2DM在小鼠心脏中诱导的线粒体H2O2生成。
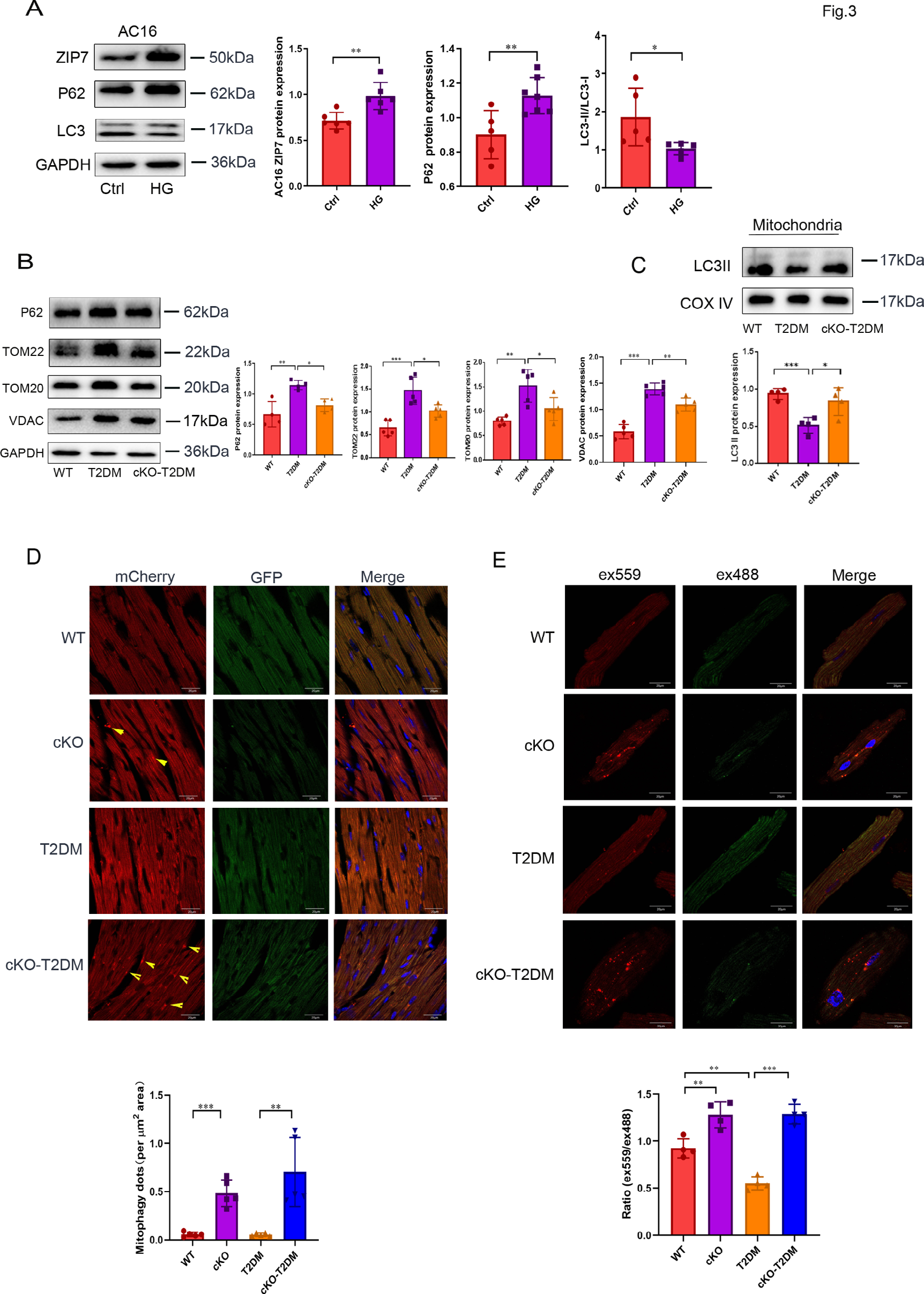
3)ZIP7参与T2DM对线粒体自噬的抑制
功能失调的线粒体会触发ROS生成和线粒体损伤的恶性循环。线粒体自噬可以选择性地清除受损或功能失调的线粒体,从而防止线粒体ROS生成。因此,抑制或失活线粒体自噬会导致线粒体ROS生成增加。据此,我们检测了ZIP7是否通过控制线粒体自噬来介导T2DM引起的线粒体ROS生成增加。用高剂量葡萄糖(35mM)处理AC16细胞,不仅增加了ZIP7蛋白表达,还下调了自噬作用,表现为P62表达增加,而LC3II/I比率降低(图3A)。在小鼠心脏中,T2DM增加了P62、TOM22、TOM20和VDAC的蛋白表达水平,而ZIP7 cKO抑制了这一效应,这表明T2DM在体内通过ZIP7抑制小鼠心脏的线粒体自噬(图3B)。在从小鼠心脏分离的线粒体中,ZIP7 cKO也阻止了T2DM引起的LC3II减少(图3C)。为了确认ZIP7在T2DM背景下线粒体自噬中的作用,我们向小鼠注射了mitoQC质粒,并在心脏组织中检测其荧光强度。图3D显示,ZIP7 cKO在生理条件下或在T2DM背景下均增加了线粒体自噬。进一步的实验使用了mKeima(一种线粒体自噬的定量探针),结果表明T2DM下调了线粒体自噬,而ZIP7 cKO逆转了这一变化(图3E)。所有这些数据都表明,T2DM通过ZIP7抑制小鼠心脏的线粒体自噬。
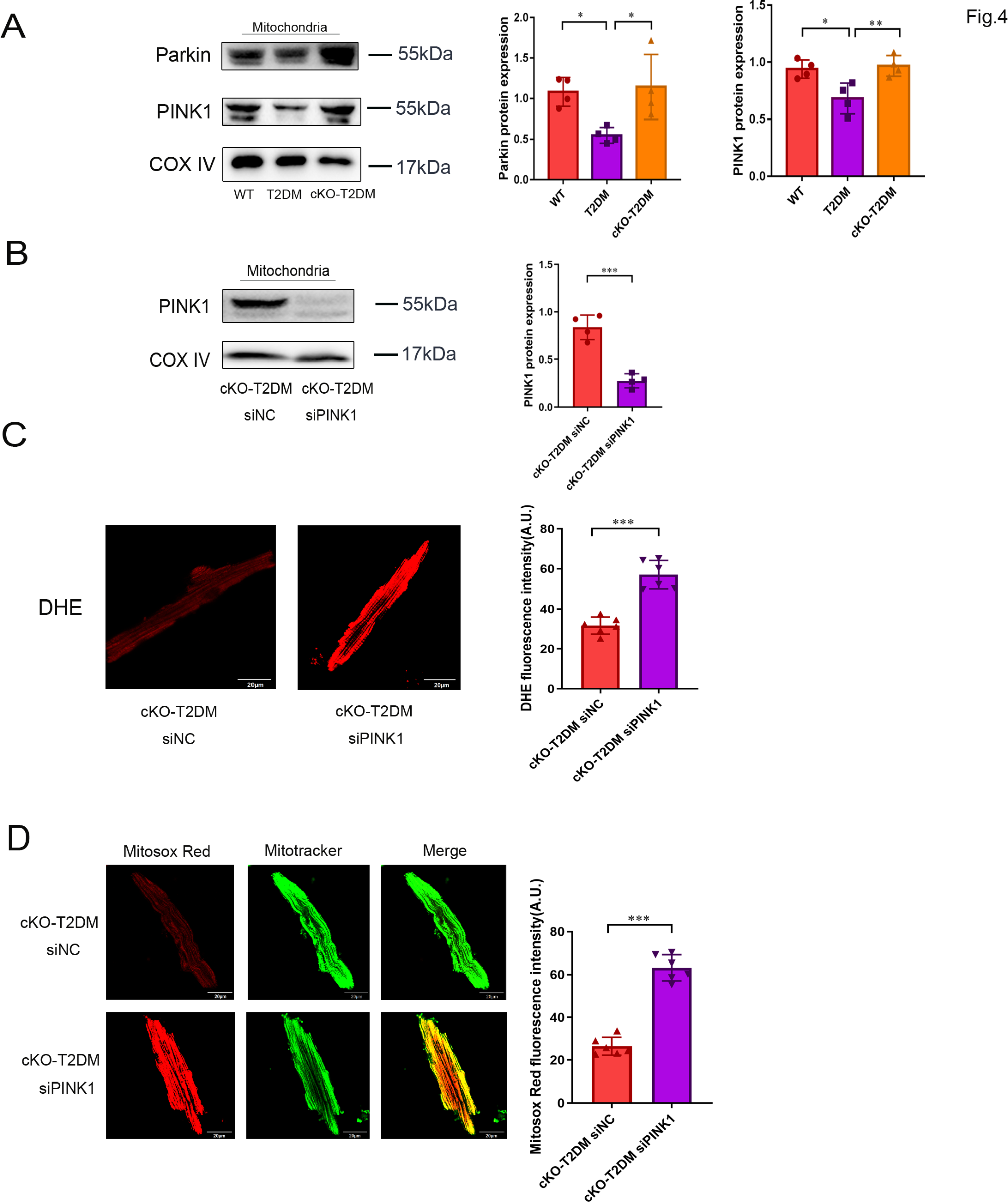
4)ZIP7介导T2DM对线粒体中PINK1和Parkin积累的抑制
PINK1-Parkin通路在调节线粒体自噬过程中发挥着关键作用。为了探究ZIP7是否通过PINK1-Parkin通路介导2型糖尿病(T2DM)背景下的线粒体自噬抑制,我们检测了从小鼠心脏分离的线粒体内Parkin和PINK1蛋白的水平。与野生型(WT)相比,T2DM显著降低了线粒体内Parkin和PINK1蛋白的水平,而ZIP7条件性敲除(cKO)则逆转了这一效应,这表明ZIP7可能通过PINK1-Parkin通路介导T2DM诱导的线粒体自噬抑制(图4A)。为了证实这一发现,我们随后检测了PINK1 siRNA对活性氧(ROS)生成的影响。在注射siRNA后48小时,我们从心肌细胞中测量了ROS的水平。通过Western blotting评估了siRNA的有效性(图4B)。如上所述,ZIP7 cKO能够阻止T2DM诱导的ROS生成。然而,PINK1 siRNA逆转了cKO的这一效应,如二氢乙啶(DHE)荧光增强所示(图4C)。进一步的实验揭示,在cKOT2DM小鼠心肌细胞中,PINK1 siRNA显著增强了Mitosox Red的荧光强度,这表明ZIP7敲低通过PINK1减轻了T2DM诱导的线粒体ROS生成。因此,这一结果支持了上述发现,即ZIP7通过PINK1-Parkin通路介导T2DM诱导的线粒体自噬抑制。
5)ZIP7 cKO通过增加线粒体Zn2+来阻止T2DM诱导的小鼠心肌细胞线粒体超极化
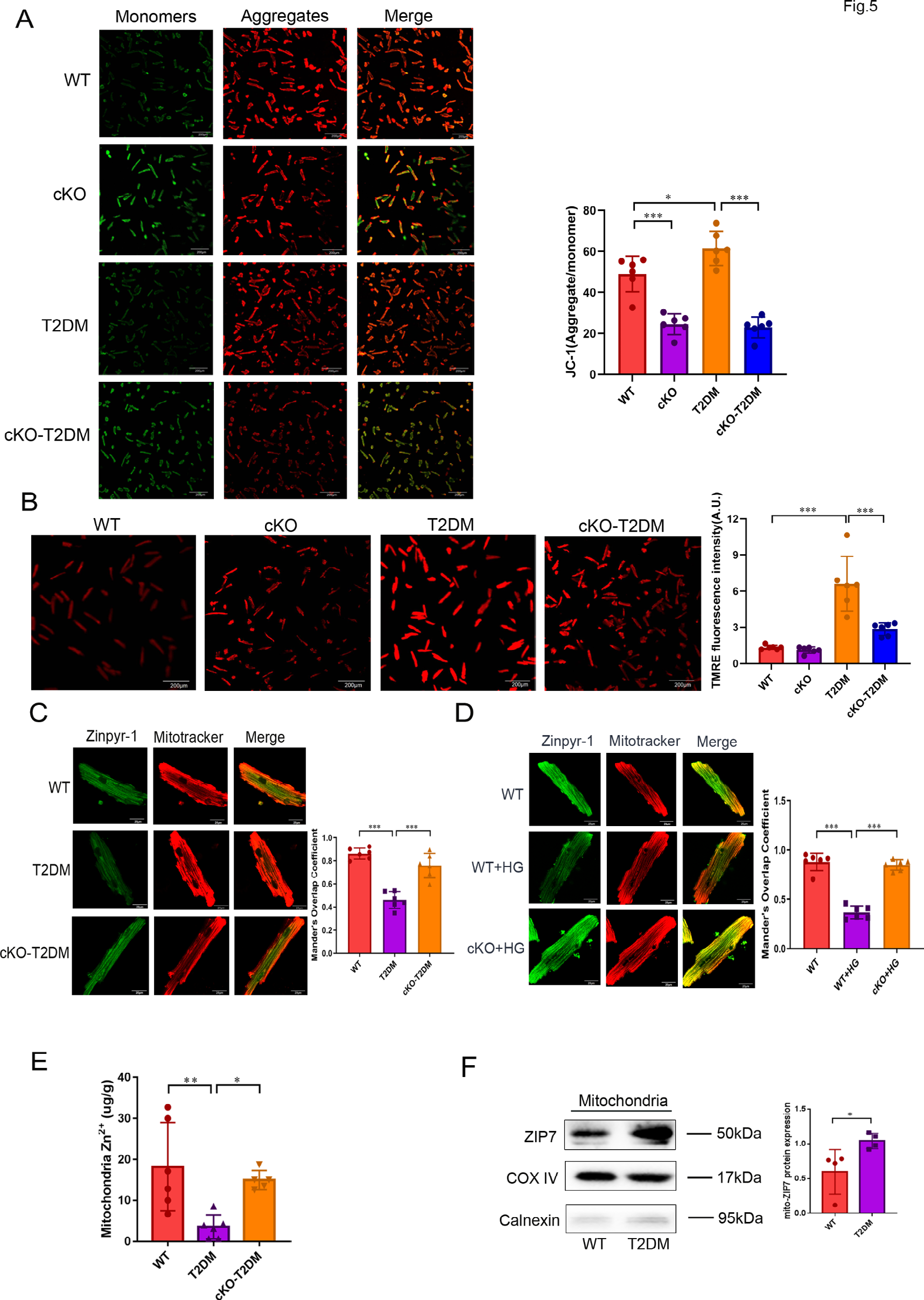
为了探究2型糖尿病(T2DM)抑制Parkin招募入线粒体的机制,我们使用JC-1标记分离的小鼠心肌细胞,测定了线粒体膜电位(MMP)。如图5A所示,T2DM增加了JC-1的聚集体/单体比例,表明T2DM诱导了线粒体超极化。然而,ZIP7条件性敲除(cKO)逆转了T2DM的这一效应,暗示ZIP7是导致T2DM诱导的线粒体超极化的原因。为了支持这一观点,使用TMRE的额外实验也显示,ZIP7 cKO消除了T2DM诱导的超极化(图5B)。ZIP7定位于线粒体,其在线粒体中的上调会导致线粒体内Zn²⁺水平降低。由于Zn²⁺是阳离子,ZIP7上调导致的线粒体内Zn²⁺减少可能会引起线粒体超极化。因此,我们使用Zinpyr-1和Mitotracker在分离的小鼠心肌细胞中检测了线粒体Zn²⁺水平。图5C显示,T2DM降低了线粒体Zn²⁺水平,而ZIP7 cKO阻止了这种降低,表明ZIP7是导致T2DM引起线粒体Zn²⁺减少的原因。体外研究也表明,用35mM葡萄糖处理小鼠心肌细胞会降低线粒体Zn²⁺水平,而ZIP7 cKO逆转了这一效应(图5D)。为了证实这些发现,我们使用ICPOES测定了线粒体Zn²⁺水平。与上述定量数据一致,T2DM显著降低了线粒体Zn²⁺含量,而ZIP7 cKO阻止了这种降低(图5E)。为了验证所有这些发现,我们测定了线粒体ZIP7蛋白水平,并发现从T2DM小鼠心脏分离的线粒体中ZIP7表达显著增加(图5F),这表明线粒体中的ZIP7增加会通过促进Zn²⁺从线粒体流向胞质溶胶来降低线粒体Zn²⁺水平。
6)ZIP7 cKO对T2DM引起的心功能障碍和纤维化有预防作用
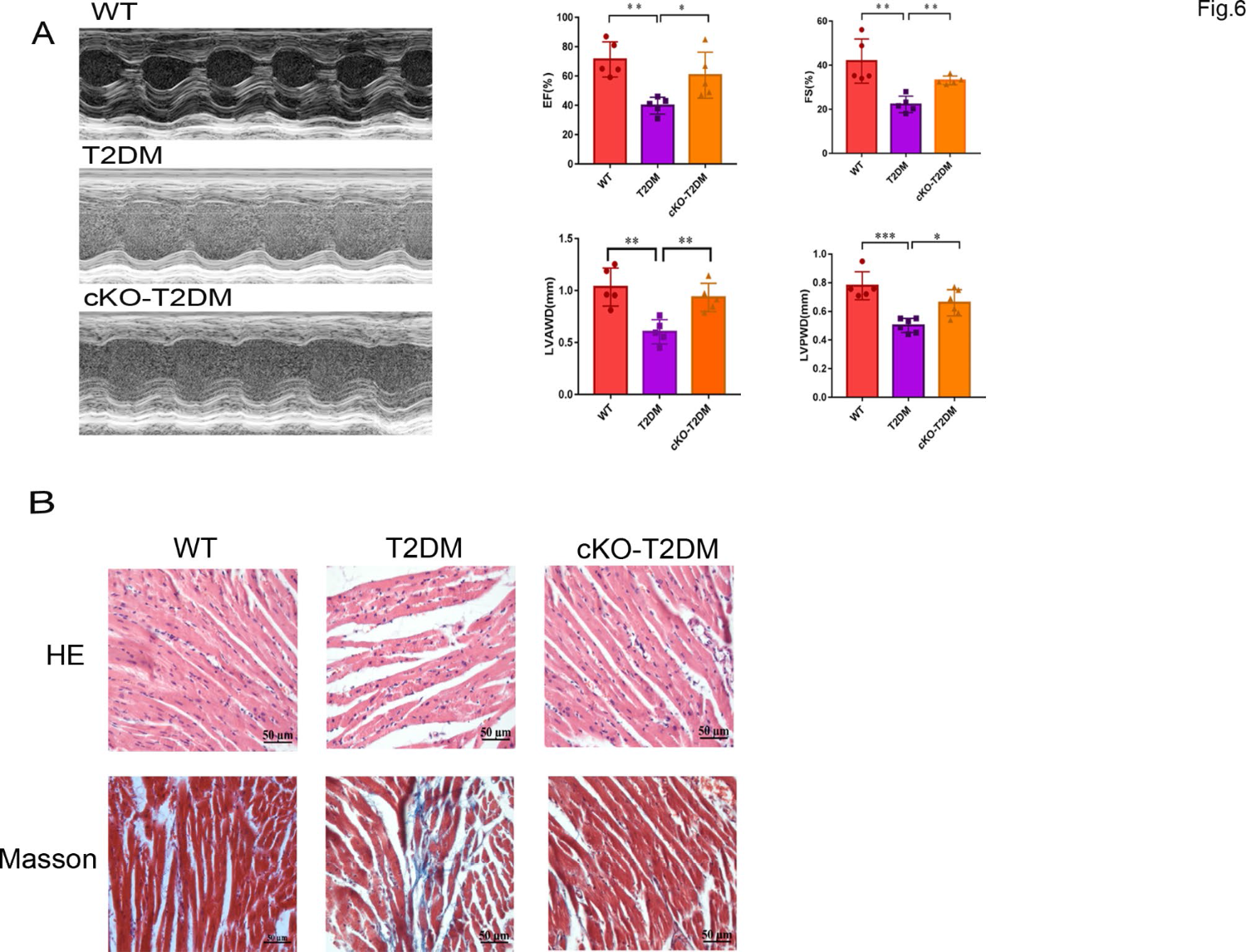
为了进一步证实ZIP7的作用,我们测试了ZIP7 cKO对T2DM条件下心功能、肥厚和纤维化的影响。超声心动图研究显示,T2DM可降低射血分数(EF)、分数缩短(FS)、左室舒张前壁厚度(LVAWD)和左室舒张后壁厚度(LVPWD),而ZIP7 cKO可抑制这一作用,提示ZIP7可解释T2DM诱导的心功能障碍(图6A)。HE染色的组织病理学研究显示,WT小鼠心肌细胞条纹清晰,排列规律(图6B,上面板)。相比之下,T2DM心肌细胞排列紊乱,细胞间隙增大,纤维断裂,ZIP7 cKO改善了这些,表明ZIP7与T2DM诱导的心肌损伤有关。Masson染色显示,与WT相比,T2DM心肌中胶原蛋白明显积累,ZIP7 cKO再次阻止了这种积累,提示ZIP7参与了T2DM诱导的纤维化。
结论:
ZIP7在糖尿病心肌病中发挥着关键作用,而抑制或失活ZIP7可能成为治疗T2DM所致糖尿病心肌病患者的有效治疗策略。
实验方法:
Western blotting,线粒体膜电位测定,DHE,线粒体自噬试验,HE染色,qPCR。
参考文献:
Yang N, Zhang R, Zhang H, Yu Y, Xu Z. ZIP7 contributes to the pathogenesis of diabetic cardiomyopathy by suppressing mitophagy in mouse hearts. Cardiovasc Diabetol. 2024 Nov 7;23(1):399. doi: 10.1186/s12933-024-02499-2.






