CAFs中NNMT的m6A去甲基化通过增强巨噬细胞M2极化促进胃癌进展
癌症相关成纤维细胞(CAFs)是胃癌(GC)肿瘤微环境中主要的间质细胞,它们与免疫细胞和肿瘤细胞相互作用,推动癌症进展。然而,这些相互作用与其作为治疗靶点的潜在价值之间的确切联系仍然不清楚。在这项研究中,我们首次发现来自CAFs的NNMT促进了M2巨噬细胞的极化,反过来又促进了GC细胞的增殖和迁移。此外,我们还发现CAFs中的NNMT表达是通过FTO m6A去甲基化来调控的。NNMT和FTO在肿瘤组织和CAFs中均高表达,临床样本中FTO与NNMT水平之间存在正相关。从机制上讲,FTO与NNMT mRNA结合,减少了m6A修饰并增强了NNMT表达。在CAFs中敲除NNMT或FTO有效地抑制了M2巨噬细胞的极化并抑制了GC的进展。这些发现已在患者来源的类器官模型和胃癌裸鼠模型中得到验证。总的来说,我们的数据揭示了FTO通过调节CAFs中NNMT的m6A去甲基化促进M2巨噬细胞极化,从而推动GC进展。这为胃癌的诊断和治疗提供了一个潜在的全新靶点。本文于2024年12月发表于“Cancer Letters”(IF=9.1)上。
技术路线:

结果:
1)CAFs促进巨噬细胞M2极化
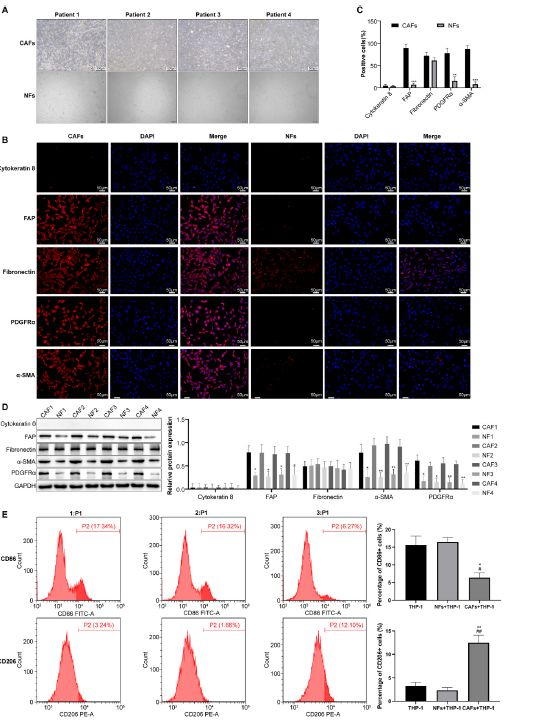
患者来源的CAFs和NFs(图1A)表达成纤维细胞标志物纤维连接蛋白。此外,作为肿瘤来源的成纤维细胞,CAFs与NFs相比,具有特异性表达PDGFRα、FAP和α-SMA的特性(图1B和C)。WB结果与免疫荧光结果一致(图1D)。为了研究CAFs与巨噬细胞极化之间的关系,我们建立了一个共培养系统。将CAFs和NFs与THP-1细胞共培养,并通过流式细胞术分析M1/M2巨噬细胞的表面标志物。结果显示,与NFs + THP-1组相比,CAFs + THP-1组中CD206+(M2巨噬细胞标志物)的比例显著增加,而CD86+(M1巨噬细胞标志物)的比例降低。这些发现表明CAFs在体外促进M2巨噬细胞极化(图1E)。
2)CAFs促进类器官模型和裸鼠GC增殖
我们成功构建了胃癌患者来源的类器官(PDOs)并通过病理学方法对其进行了验证(图2A)。当与CAFs共培养时,类器官显示出增强的生长,这可能是由于CAFs分泌的细胞因子促进了胃癌增殖(图2B)。为了验证这一假设,我们将类器官培养在CAFs上清液(条件培养基,CM)和类器官扩张培养基(GO)等比例混合的培养基中。EdU和Calcein-AM染色显示,在DMEM和CM组中的类器官出现了显著的细胞死亡,这可能是由于GO中缺少必要的生长因子。然而,GO + CM组与GO和GO + DMEM组相比,显示出显著增加的增殖。这些结果表明CAFs来源的上清液促进了PDOs中胃癌的增殖(图2C)。CAFs同样促进了多种胃癌细胞系的增殖,其中AGS细胞系的增殖最为显著。因此,将CAFs与AGS细胞以1:1的比例混合,在裸鼠中建立皮下肿瘤模型。测量肿瘤大小和重量,结果显示CAFs + AGS组的肿瘤体积和重量显著大于NFs + AGS组(图2E)。这表明CAFs能够在体内促进胃癌生长。对肿瘤中的M1/M2巨噬细胞表面标志物进行WB分析,结果显示与NFs + AGS组相比,CAFs + AGS组中M1标志物(CD86、TNF-α和iNOS)的水平降低,而M2标志物(CD206、Arg-1和IL-10)的水平增加(图2F)。综上所述,这些结果表明CAFs通过促进M2巨噬细胞极化来增强胃癌增殖。

3)NNMT在GC组织中高表达,尤其是在CAFs中
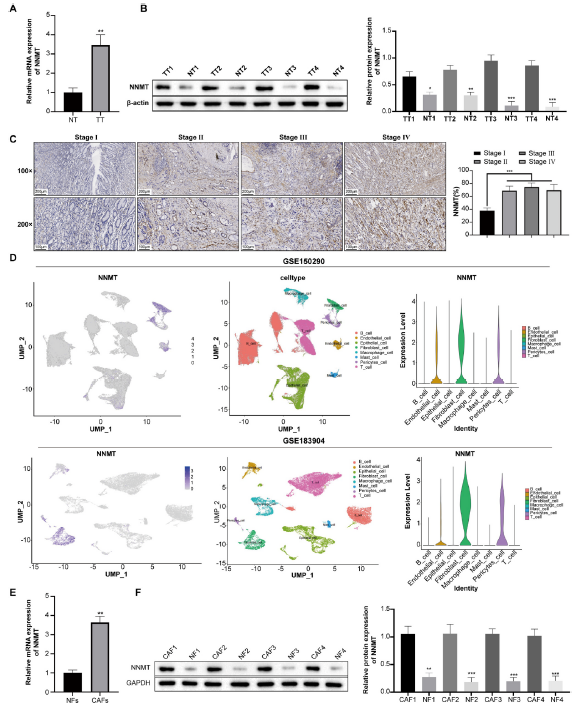
我们之前的研究将NNMT识别为构建"CAFS-score"预后模型中的四个关键基因之一。TCGA数据库分析显示NNMT在胃癌组织中的表达较高。这与我们对胃癌临床样本的RT-qPCR(图3A)和WB(图3B)实验结果一致,并且其表达随着病理分期的提高而增加(图3C)。紧接着,我们对两个胃癌单细胞数据集(GSE150290/GSE183904)进行了生物信息学分析,并发现NNMT在胃癌组织的CAFs中高表达(图3D)。同时在患者来源的CAFs和NFs中进行了验证(图3E和F)。以上结果表明,NNMT在GC组织中高表达,尤其是在CAFs中。
4)NNMT敲低抑制巨噬细胞M2极化和肿瘤生长
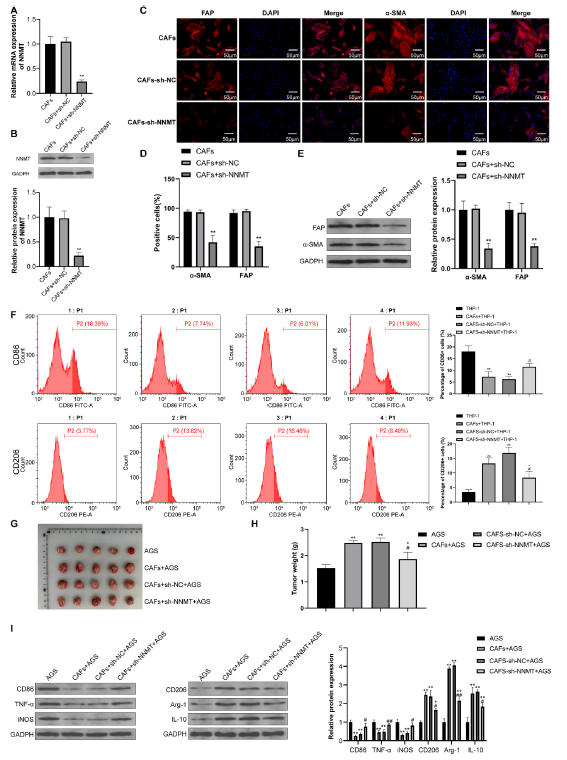
NNMT敲减载体成功构建并转染入CAFs中(图4A和B)。结果显示,与CAFs-sh-NC组相比,CAFs-sh-NNMT组中FAP和α-SMA阳性细胞的数量减少,FAP和α-SMA的表达也降低。这表明NNMT敲减减弱了CAFs的成纤维细胞特性(图4C–E)。同时,将CAFs-sh-NNMT与THP-1细胞共培养显示,与CAFs-sh-NC + THP-1组相比,CAFs-sh-NNMT + THP-1组中CD206+细胞的比例显著降低,而CD86+细胞的比例增加,表明在CAFs中敲减NNMT可以抑制M2巨噬细胞的极化(图4F)。进一步地,将CAFs-sh-NNMT与AGS细胞以1:1的比例混合后皮下注射到裸鼠中建立肿瘤模型。与CAFs-sh-NC + AGS组相比,CAFs-sh-NNMT + AGS组中的肿瘤在体积和重量上都更小,表明NNMT敲减抑制了胃癌肿瘤的生长(图4G和H)。对肿瘤中的M1/M2巨噬细胞标志物进行WB分析,结果显示与CAFs-sh-NC + AGS组相比,CAFs-sh-NNMT + AGS组中CD86、TNF-α和iNOS的表达增加,而CD206、Arg-1和IL-10的表达减少(图4I)。这些发现表明,NNMT敲减有效地抑制了CAFs介导的M2巨噬细胞极化,从而抑制了肿瘤的发展。
5)FTO在GC中高表达,与NNMT表达呈正相关
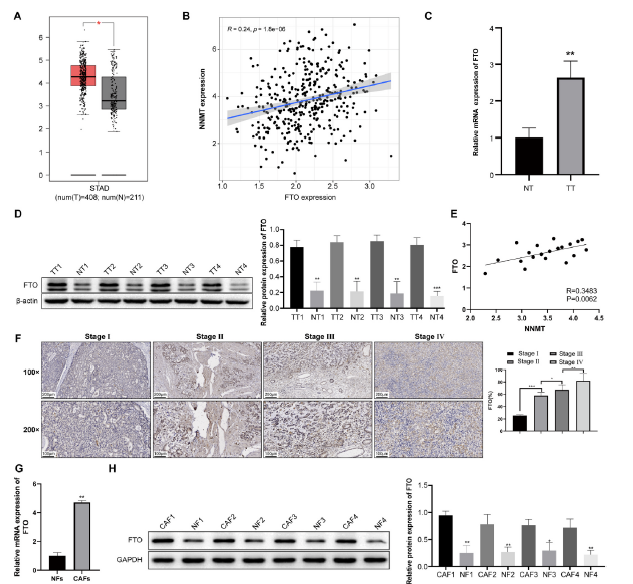
m6A去甲基化酶FTO可以在卵巢癌中调节NNMT的m6A去甲基化,但FTO是否在胃癌CAFs中调节NNMT表达尚未被研究。我们通过GEPIA数据库预测了FTO在胃癌中的表达趋势,结果显示FTO在胃癌患者中高表达(图5A)。进一步分析了FTO与NNMT在胃癌中的表达相关性,结果显示两者之间存在正相关关系(图5B)。通过RT-qPCR(图5C)和WB(图5D)进一步检测了收集的NT和TT组织中的FTO表达,结果显示TT组中的FTO表达显著高于NT组。结合对TT组织中NNMT表达的预检测,发现其与FTO的表达一一对应,并通过Pearson分析了两者的相关性,结果显示TT组织中FTO与NNMT表达之间存在正相关(图5E)。为了检测不同肿瘤分期患者中FTO的差异表达,选择了4个分期患者的TT组织进行IHC染色,并检测了每个组织中FTO阳性细胞的比例。结果显示,FTO阳性细胞数量与肿瘤疾病进展相关(图5F)。继续检测CAFs和NFs中的FTO表达,结果显示与NFs相比,CAFs中的FTO表达升高(图5G和H)。因此,FTO通过调节NNMT在GC进展中发挥调节作用。
6)FTO通过降低NNMT m6A修饰水平促进NNMT表达
为了检测FTO对NNMT的调控作用,我们在CAFs中同样转染了FTO相关载体,并通过RT-qPCR和WB检测载体转染效率。FTO表达结果表明载体转染成功(图6A-B)。与CAFs-OE-NC组相比,CAFs-OE-FTO组NNMT的表达明显升高,而CAFs-sh-FTO组NNMT的表达明显降低,说明FTO正向调节NNMT的表达(图6C-D)。然后用RIP检测FTO是否与NNMT mRNA结合,结果显示,与抗IgG对照组相比,抗FTO组的NNMT mRNA大量富集,表明FTO能够识别并结合NNMT mRNA(图6E)。为确定FTO对NNMT m6A修饰的调控作用,进一步用MeRIP-qPCR检测转染FTO载体后NNMT mRNA m6A修饰水平,结果显示,CAFs- OE-FTO组NNMT m6A水平降低,CAFs-sh-FTO组NNMT m6A水平升高(图6F)。总的来说,这些结果表明FTO通过降低GC CAFs中NNMT m6A修饰水平来促进NNMT的表达。
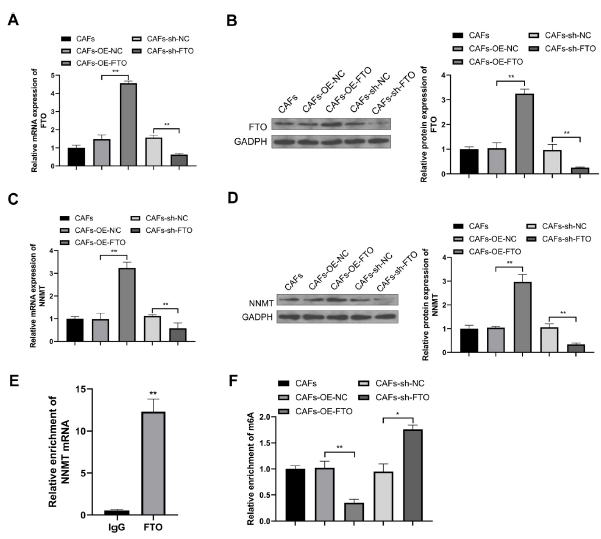
7)FTO通过上调CAFs中NNMT,促进M2型巨噬细胞极化,从而调控GC进程
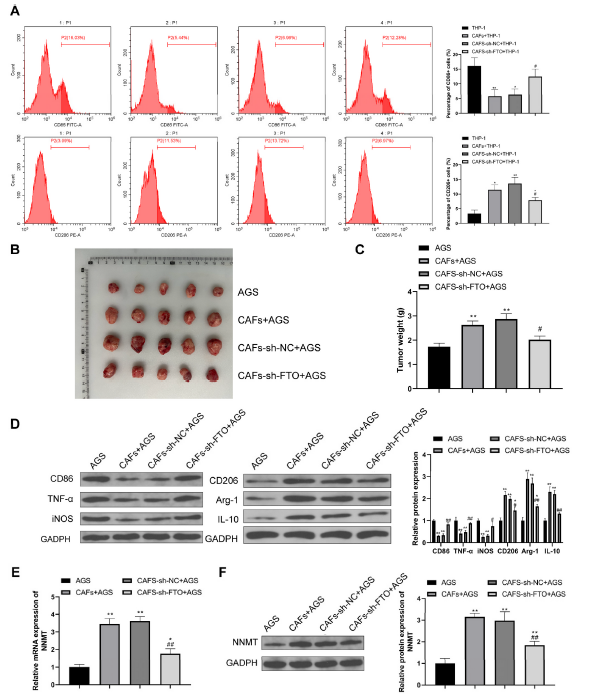
将CAFs-sh-FTO与THP-1细胞共培养,并通过流式细胞术检测M1/M2巨噬细胞标志物,结果显示与CAFs-sh-NC + THP-1组相比,CAFs-sh-FTO + THP-1组中CD206+细胞的比例降低,而CD86+细胞的比例升高,表明敲减FTO可以抑制M2巨噬细胞极化(图7A)。将转染了FTO载体的CAFs与AGS混合后皮下注射到裸鼠中。结果显示,与CAFs-sh-NC + AGS组相比,CAFs-sh-FTO + AGS组的肿瘤体积和重量均减小,表明敲减FTO可以在体内抑制胃癌肿瘤的生长(图7B和C)。通过WB检测肿瘤中M1/M2巨噬细胞表面标志物的表达,结果显示与CAFs-sh-NC + AGS组相比,CAFs-sh-FTO + AGS组中M1巨噬细胞标志物CD86、TNF-α和iNOS的表达升高,而M2巨噬细胞标志物CD206、Arg-1和IL-10的表达降低(图7D)。这表明敲减FTO可以抑制TME中的M2巨噬细胞极化。最后,通过RT-qPCR(图7E)和WB(图7F)检测肿瘤中NNMT mRNA和蛋白的表达,结果显示CAFs-sh-FTO + AGS组肿瘤中的NNMT表达显著低于CAFs-sh-NC + AGS组。综上所述,这些结果表明在CAFs中敲减FTO可以抑制NNMT的表达,并通过消除CAFs诱导的M2巨噬细胞极化来减缓胃癌的进展。
结论:
我们证明了FTO和NNMT在GC组织和CAFs中高表达,并且FTO通过m6A去甲基化上调NNMT,从而促进TAM的M2型极化并导致GC进展。这些发现为CAFs介导的TAM相互作用提供了新的视角,并为破坏CAFs介导的TME调节和改善患者预后提供了潜在的治疗靶点。
实验方法:
流式,CCK-8,Transwell,克隆形成,免疫荧光,EdU,western blot,qRT-PCR,免疫沉淀,免疫组化。
参考文献:
Mak TK, Li K, Zhao Z, Wang K, Zeng L, He Q, Lu W, Chen W, He Y, Li J, Zhang C. m6A demethylation of NNMT in CAFs promotes gastric cancer progression by enhancing macrophage M2 polarization. Cancer Lett. 2024 Dec 24;611:217422. doi: 10.1016/j.canlet.2024.217422.






