抑制EZH1/EZH2可增强针对多种癌症模型的接受性T细胞免疫疗法
改造T细胞表达嵌合抗原受体(CAR)或T细胞受体(TCR),使其能够特异性识别并攻击癌细胞的方法,已成为血液系统恶性肿瘤的重要治疗手段。EZH2是一种组蛋白甲基转移酶,通过催化H3K27me3来抑制基因表达,在多种癌症中发挥促癌作用,并与免疫逃逸相关。EZH2抑制剂(tazemetostat)和EZH1/2双重抑制剂(valemetostat)已在临床试验中显示出单药抗肿瘤活性。作者探讨了EZH1/2抑制剂在多种癌症模型中对CAR-T和TCR-T细胞免疫疗法的增强作用,发现EZH2抑制剂通过重编程肿瘤细胞的免疫原性,上调炎症相关基因和T细胞趋化因子,显著增强了CAR-T细胞的激活、增殖和肿瘤浸润能力,从而提高了抗肿瘤效果。此外,EZH1/2双重抑制剂在某些癌症模型中比单一EZH2抑制剂表现出更强的疗效,提示其在克服肿瘤耐药性方面具有潜在优势。总之,作者研究了EZH1/2抑制剂对多种癌症模型中CAR-T和TCR-T细胞免疫疗法的增强作用,揭示了EZH2抑制剂通过重编程肿瘤细胞的免疫原性,显著提高免疫疗法的疗效,并为克服肿瘤耐药性提供了新的策略。该研究于2025年2月发表在《Cancer Cell》,IF 48.8分。
技术路线:
主要研究结果:
1人类B细胞淋巴瘤模型中EZH2抑制改善了CAR-T细胞的抗肿瘤效果
作者首先探索了EZH2抑制剂tazemetostat增强CART19免疫疗法的潜力,因为这两种疗法均被批准用于依赖EZH2生存的GC B细胞淋巴瘤。为此,作者选择了四种GC来源的DLBCL淋巴瘤细胞系(OCI-Ly18和Toledo为野生型EZH2,SU-DHL-4和Karpas-422为突变型EZH2)。使用亚治疗剂量的tazemetostat(OCI-Ly18、Toledo、SU-DHL-4为500 nM;Karpas-422为50 nM),在不影响细胞短期(≤3天)活力和增殖的情况下耗竭了H3K27ME3,从而能够评估其与CART19疗法的潜在联合效果。为了确定最有效的给药序列,作者测试了五种tazemetostat和CAR-T的不同给药顺序(图1B)。最有效的方案(方案#1)包括预先用tazemetostat处理肿瘤细胞,并在CART19给药后继续暴露于tazemetostat(图1C)。在该方案下,tazemetostat增强了CART19介导的对GC来源DLBCL细胞系的杀伤效果,并且这种增强作用与细胞的EZH2突变状态无关。值得注意的是,tazemetostat还改善了对单药CART19耐药的Karpas-422细胞系的杀伤效果(图1C)。这一发现强调了在CAR-T抗肿瘤效应期间,需要对肿瘤细胞进行预处理并维持EZH2抑制。单独使用tazemetostat可降低H3K27me3水平(图S2A),但在这些剂量下对短期淋巴瘤生长无显著影响(图S2B)。除非另有说明,后续所有体外实验均采用方案#1作为标准给药方案。为了从遗传学角度确认这些发现,作者通过短发夹RNA在SU-DHL-4细胞(突变型EZH2)中建立了EZH2敲低(KD)模型(图1D)。与小分子抑制结果一致,EZH2 KD增强了CART19介导的杀伤效果(图1D)。随后,作者利用对CART19高度耐药的EZH2野生型DLBCL细胞系OCI-Ly18建立了异种移植模型来验证这些结果(图1E)。将OCI-Ly18细胞皮下植入免疫缺陷的NSG小鼠后,随机分为接受tazemetostat(200 mg/kg/天,持续约7周,口服)或对照溶剂处理的组,随后给予亚治疗剂量的CART19(3.5×10⁶细胞/只小鼠,静脉注射)或未转导(UTD)细胞。与单独使用CART19或tazemetostat相比,tazemetostat联合CART19显著改善了肿瘤控制(图1F和S2C),并延长了小鼠的生存时间(图1G)。Tazemetostat对T细胞无毒性,并且未观察到显著的治疗相关毒性(体重减轻或移植物抗宿主病[GVHD];图S2D)。相反,在第20天,接受tazemetostat治疗的小鼠血液中CART19细胞水平显著增加(图1H)。
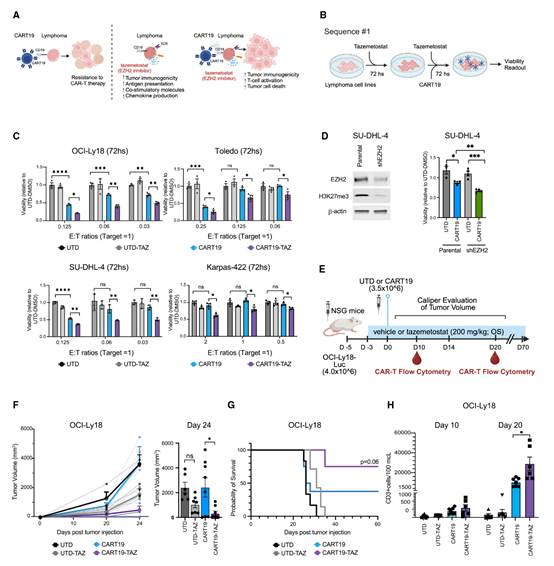
图1:EZH2抑制使淋巴瘤细胞对CART19疗法敏感
2 EZH2抑制增强淋巴瘤的免疫原性
为了探究EZH2抑制如何增强CAR-T细胞的疗效,作者首先关注其对癌细胞的影响。作者对经过tazemetostat或对照溶剂预处理3天的GFP⁺ OCI-Ly18和SU-DHL-4细胞(分别为野生型和突变型EZH2)进行了RNA测序,随后将这些细胞暴露于tazemetostat和未转导(UTD)或CART19细胞共培养48小时(方案#1)。差异表达基因(DEGs)分析显示,单独使用tazemetostat诱导的DEGs数量最多,且主要为上调基因,这与EZH2的抑制性作用一致(图S3B和S3C)。对仅暴露于CART19的肿瘤细胞进行基因集富集分析(GSEA)确认了CART19介导杀伤的关键机制,包括干扰素-γ/α、通过核因子κB(NF-κB)的肿瘤坏死因子(TNF)、白细胞介素(IL)-2-STAT5信号通路以及凋亡(图S3D)。接受tazemetostat处理的组(Taz-UTD和Taz-CART19)表现出细胞周期和增殖相关基因(例如MYC靶基因、G2M检查点和E2F靶基因)的下调。暴露于Taz-CART19的肿瘤细胞特异性上调了与炎症(IL2RA)、B细胞激活/分化(例如KDM5B和BACH2)、黏附(例如OX40L/TNFSF4和CD80)、T细胞趋化(例如CXCL9、CXCL10和CXCL16)以及运动性(例如LMNA、CEACAM1、NRCAM和EPHB2;图2A)相关的基因。
为了进一步探索EZH2抑制在体内的效应,作者采用了对CART19耐药的OCI-Ly18异种移植淋巴瘤模型(图2B)。在该模型中,OCI-Ly18细胞在第-18天皮下植入NSG小鼠,从第-15天开始给予tazemetostat(150 mg/kg/天,口服)或对照溶剂处理;在第0天给予CART19(4.0×10⁶ CAR-T⁺细胞/只小鼠,静脉注射)或未转导(UTD)细胞。这一时间表允许tazemetostat对肿瘤进行更长时间的预处理和重编程。在CART输注后第11天,在CART19组之间尚未出现显著肿瘤大小差异之前,将肿瘤取出并进行分析(图2C)。在显微镜下评估时,与对照组相比,接受CART19和tazemetostat治疗的小鼠肿瘤更小、坏死更多,并且T细胞浸润增加(图2D)。对分选的肿瘤细胞进行差异基因表达分析显示,EZH2抑制增加了MHC-I/II抗原(HLA-A、HLA-DOA和HLA-DOB)、共刺激分子(CXCL9、CXCL10和CD40)、黏附(ICAM1)、B细胞激活(FOS和JUN)、干扰素(IFN)反应(STAT1-3和IRF2/7/9)以及p53介导的凋亡(FAS、ATF3、CASP3/4/7、MCL1和MDM2;图2E)相关基因的表达。这些发现表明,EZH2抑制重塑了肿瘤的免疫原性,并调节了炎症和凋亡通路,可能增强了肿瘤细胞与CAR-T细胞之间的相互作用,最终有助于提高CAR-T的疗效。
为了评估EZH2抑制在染色质水平上的效应,作者对经过tazemetostat或对照溶剂预处理3天的突变型EZH2 SU-DHL-4细胞进行了ATAC测序,随后将这些细胞暴露于tazemetostat和UTD或CART19细胞共培养48小时(方案#1)。
最后,作者通过流式细胞术定量检测了经72小时处理后肿瘤细胞表面的CD19水平,以探究tazemetostat暴露后的蛋白变化。结果显示,EZH2抑制并未改变CD19的表达(图S3G)。然而,已知的EZH2靶基因CD58在经tazemetostat处理的淋巴瘤细胞中上调,这一结果通过流式细胞术得到了验证(图S3H)。最后,为了功能验证EZH2抑制主要通过增强肿瘤细胞与CAR-T细胞之间的相互作用来提高杀伤效果的假设,作者利用z-Movi平台(LUMICKS)检测了CART19细胞与肿瘤细胞之间的亲和力(avidity)。亲和力受多种因素影响,包括CAR的亲和力、黏附分子和共刺激蛋白,它决定了T细胞与靶细胞界面的相互作用强度,影响CAR信号传导、细胞因子分泌、增殖和持久性。事实上,tazemetostat预处理提高了CART19细胞对OCI-Ly18和SU-DHL-4细胞的亲和力,表明结合效率增强(图2F)。这一结果进一步在通过shRNA敲低EZH2的SU-DHL-4细胞中得到验证,从而强化了EZH2抑制在增强肿瘤细胞与CAR-T细胞相互作用中的作用(图2F)。
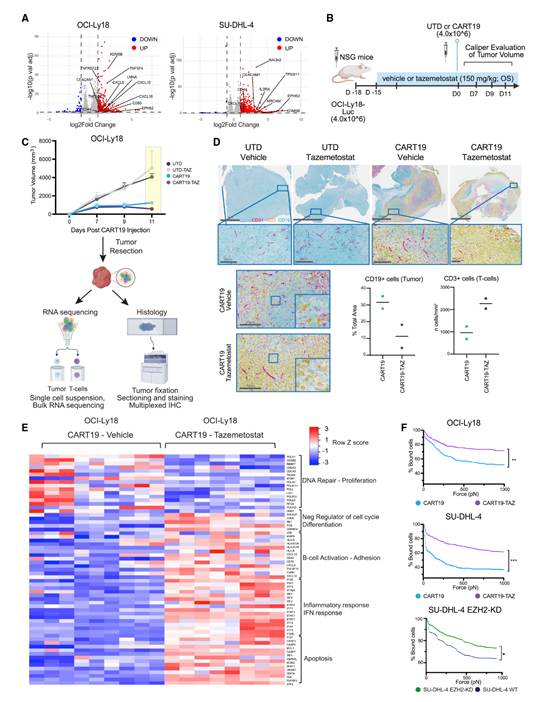
图2:EZH2抑制调节淋巴瘤的免疫原性
3 EZH2抑制改善CAR-T细胞在遇到肿瘤时的扩增和激活
EZH2也在T细胞中表达,它调节T细胞的激活、增殖和分化,同时抑制促炎细胞因子。因此,作者研究了EZH2抑制对CAR-T细胞的影响。在持续信号传导的CAR-T模型中,EZH2抑制可以防止CAR-T细胞耗竭后的恢复。还有研究表明,在小鼠(GC)淋巴瘤和黑色素瘤模型中,预先用tazemetostat处理的过继转移T细胞显示出更强的抗肿瘤活性。
作者首先研究了在肿瘤细胞预先用tazemetostat处理后,CAR-T细胞和肿瘤细胞在杀伤实验中同时暴露于药物(方案#1)时,tazemetostat对CAR-T细胞的影响。首先,作者评估了tazemetostat对CART19激活、长期肿瘤控制、扩增和记忆形成的影响。体外实验中,tazemetostat显著增加了CAR-T细胞的细胞因子分泌(IFN-γ、TNF和IL-2),增强了长期杀伤能力,并促进了与预先用tazemetostat处理的肿瘤细胞共培养时的扩增。此外,流式细胞术分析显示,经tazemetostat处理的CART19细胞中效应记忆亚群的比例增加。相反,仅将CAR-T细胞暴露于tazemetostat并未导致功能增强,如之前所示。为了评估CAR-T细胞随时间的功能变化,作者进行了再挑战实验。在此实验中,CART19细胞与SU-DHL-4细胞共培养,后者要么未处理,要么预先用tazemetostat处理。未处理的肿瘤细胞在第4天、第7天和第11天重新引入,以触发CAR-T细胞功能障碍。值得注意的是,在此模型中,与单独使用CART19相比,联合使用tazemetostat的CART19在维持长期细胞毒性活性和扩增方面表现出更高的能力,而单独的CART19则显示出杀伤能力减弱和增殖能力较差。
基于tazemetostat通过肿瘤重编程增强CART19疗效的发现,作者进一步研究了体内肿瘤浸润性CART19细胞的特征。在CART19输注前15天,用亚治疗剂量的tazemetostat或对照溶剂预处理肿瘤,以实现通过EZH2抑制对肿瘤细胞的重编程,并在CART19输注后第11天对肿瘤浸润性T细胞进行单细胞RNA测序(scRNA-seq)。tazemetostat处理的肿瘤表现出更高的T细胞浸润,并且基于转录特征的UMAP分析揭示了七个不同的T细胞亚群,包括富含细胞毒性(例如IFNG和GZMB)和细胞周期(TOP2A和PCNA)标记物的簇。在两组中,肿瘤浸润性T细胞均表现出高水平的CD8A表达,表明细胞毒性T细胞在肿瘤微环境(TME)中占主导地位。对tazemetostat处理的肿瘤中的CART19细胞进行基因集富集分析(GSEA)显示,激活和细胞毒性基因(例如GZMB、PRF1、IFNG和CD69)上调,而耗竭标记物(例如LAIR2)下调,与对照组相比(图3F)。这些发现表明,EZH2抑制增强了T细胞的浸润,并促进了肿瘤内CART19细胞的肿瘤反应性和细胞毒性表型。
为了进一步研究EZH2抑制对血液中CART19细胞的影响,作者使用最初的模型分析了外周血中的循环CART19细胞,在该模型中,tazemetostat和CART19的联合使用改善了肿瘤控制并延长了生存期。在接受tazemetostat治疗的小鼠中观察到CART19细胞的扩增增加。在单细胞RNA测序中,UMAP分析显示了七个具有不同特征的簇。CD8A表达在簇3中占主导地位,而其他簇则以CD4表达为特征。簇1和簇2在tazemetostat处理的小鼠中更为丰富,富含与激活的幼稚/早期记忆状态、效应功能、抗凋亡和糖酵解相关的基因。相比之下,簇0和簇4在对照溶剂处理的小鼠中更为常见,表达与终末效应表型和转化生长因子β(TGF-β)/Smad3通路相关的基因,该通路抑制CD4 T细胞的增殖和共刺激(图3G)。这些发现表明,在tazemetostat存在的情况下,肿瘤部位的CART19细胞表现出效应表型,而循环的CD4⁺ T细胞则保持更幼稚/早期记忆的状态,这与增加的持久性一致。
最后,作者直接且单独研究了tazemetostat对CAR-T细胞的影响。首先,作者测量了在照射的OCI-Ly18细胞层上培养的CAR-T细胞在不同浓度tazemetostat下的增殖情况。在这种情况下,EZH2抑制并未影响CART19细胞的增殖。此外,如之前所示,包括CAR-T细胞预先暴露于tazemetostat的治疗方案#4和#5并未显著改善CAR-T细胞的功能。进一步地,在CART19制造过程中加入tazemetostat并未影响CART19细胞的活性、扩增或杀伤能力。然后,作者使用CRISPR-Cas9技术生成了EZH2敲除(EZH2-KO)的CART19细胞。值得注意的是,与野生型CART19细胞相比,EZH2-KO的CART19细胞在体外显示出相当的杀伤能力。此外,当SU-DHL-4细胞预先用tazemetostat处理后,暴露于野生型或EZH2-KO的CART19细胞(方案#1)时,tazemetostat仍然以类似的方式增强了两组的细胞毒性活性。
综上所述,这些发现表明,tazemetostat通过EZH2抑制对肿瘤细胞的主要益处是重塑它们的免疫原性,从而促进CART19细胞的更好激活。然而,EZH2抑制并未削弱CAR-T细胞的抗肿瘤效果。
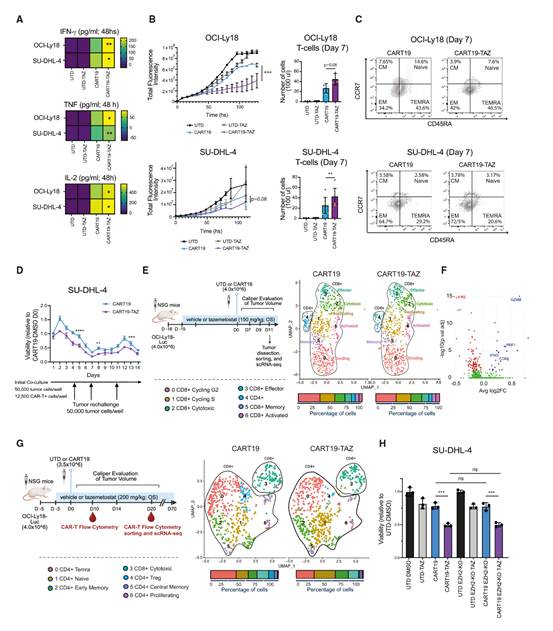
图3:EZH2抑制增强了CART19的细胞毒性并诱导更幼稚/早期记忆表型
4 EZH2和EZH1/EZH2抑制剂增强CAR-T细胞和TCR T细胞疗法对多种液体和实体肿瘤的抗肿瘤效果
鉴于EZH2失调在液体和实体癌症中均有明确的作用,作者试图探索EZH2抑制是否能够广泛增强多种CAR-T产品的CAR-T免疫疗法的效果。令人惊讶的是,EZH2抑制显著改善了模型中的CAR-T介导的杀伤效果(序列#1,图4A)。在血液恶性肿瘤中,EZH2是多发性骨髓瘤(MM)进展的关键驱动因素,导致细胞周期失控、抗凋亡以及MM细胞的侵袭性行为。为了评估EZH2抑制是否能够增强针对MM的CAR-T疗法的效果,作者测试了tazemetatost与抗BCMA CAR-T细胞的联合应用。值得注意的是,EZH2抑制显著增强了抗BCMA CAR-T细胞的长期杀伤能力(序列#1,图4B)。
由于EZH2在急性髓系白血病(AML)细胞分化中发挥作用,并且能够增强对其他疗法的敏感性,作者还在AML(KG-1和THP-1)中评估了抗CD33 CAR-T细胞与EZH2抑制剂的联合应用。在这一模型中,EZH2抑制也导致了CAR-T细胞体外杀伤能力的增强(序列#1,图4C)。这些发现共同强调了EZH2抑制在广泛增强多种血液恶性肿瘤CAR-T疗法中的潜力。
为了评估EZH2抑制在血液癌症CAR-T免疫疗法之外的潜在影响,作者研究了在已知依赖EZH2的实体肿瘤中EZH2抑制的效果,例如HER2+卵巢癌、前列腺癌和肉瘤。癌细胞(SKOV-3和PC3)预先用tazemetostat处理,并在HER2靶向CAR-T细胞介导的杀伤过程中继续使用该药物(序列#1),作者观察到CAR-T细胞杀伤能力在长期显著增强(图4D)。此外,鉴于tazemetostat已获得FDA批准用于上皮样肉瘤,作者将研究扩展到A673肉瘤细胞系,并构建了带有抗HLA-A*02:01-LOXHD1 TCR抗原的TCR T细胞。在这一模型中,tazemetostat显著增强了TCR T细胞对癌细胞的杀伤效果(图4E)。因此,EZH2抑制在多种实体肿瘤和多样化的过继T细胞免疫疗法中显示出广阔的前景。
作者假设,由于EZH1在EZH2被抑制时的代偿作用以及EZH1在非增殖细胞中的表达,将EZH1与EZH2抑制相结合可以进一步增强CAR-T疗法的效果。作者选择了valemetostat的次优剂量,并观察到它显著增强了CART19对肿瘤的杀伤效果(图4F)。在各种valemetostat和CART19给药方案(序列#1-#5;图4F)中,预先孵育肿瘤细胞并持续药物存在是最有效的方案(图4F,序列#1)。与单一抑制剂tazemetostat不同,同时将CART19/Val给予肿瘤细胞显示出增加杀伤,的趋势而预先用valemetostat孵育CART19细胞,随后在杀伤过程中持续治疗(序列#5)增强了抗肿瘤效果,表明双重EZH1/EZH2抑制比单独抑制EZH2对肿瘤和T细胞具有更大和更快的效果。作者评估了valemetostat对CART19连续杀伤效率和抗耗竭能力的影响。在再挑战实验中,CART19细胞与SUDHL-4细胞共同培养,后者要么未处理,要么预先用valemetostat处理。在4、7和11天的间隔后重新引入未处理的肿瘤细胞,以评估CART19细胞随时间的细胞毒性。在存在valemetostat的情况下,CART19细胞的杀伤效果在初始和持续肿瘤杀伤方面均优于对照组,显示出增强的细胞毒性,且未损害持续细胞毒性潜力(图4G)。
为了评估双重EZH1/EZH2抑制对其他CAR-T产品和疾病的影响,作者测试了valemetostat与抗BCMA CAR-T细胞联合应用于多发性骨髓瘤细胞系RPMI-8226。次优剂量的valemetostat能够显著增强CARTBCMA细胞的长期杀伤效率(图4H)。作者建立了一个RPMI-8226的骨内原位异种移植模型。在骨内肿瘤植入后3天,小鼠开始接受valemetostat(100 mg/kg,口服,每天一次,持续5周)或载体。在RPMI-8226植入后1周,小鼠被随机分配接受CARTBCMA(0.8×10^6/只小鼠,静脉注射)。在这个模型中,持续给予valemetostat改善了CARTBCMA对肿瘤的控制,促进了血液中T细胞的扩增,并且没有显著的治疗相关毒性(体重减轻或GVHD)(图4I、4J)。此外,接受CARTBCMA/valemetostat联合治疗的动物显示出细胞毒性细胞因子IFN-γ的血清水平升高,表明T细胞的激活和细胞毒性反应增强(图4K)。
总之,作者研究了EZH2/EZH1抑制在多种人类癌症的临床前模型中的作用,这些模型接受了过继细胞疗法。在所有测试的模型中,EZH2/EZH1抑制均增强了CAR和TCR-T的抗肿瘤效果。在淋巴瘤模型中,EZH2抑制调节了淋巴瘤细胞的免疫原性,使其更具免疫原性,并更有效地激活CAR-T细胞。
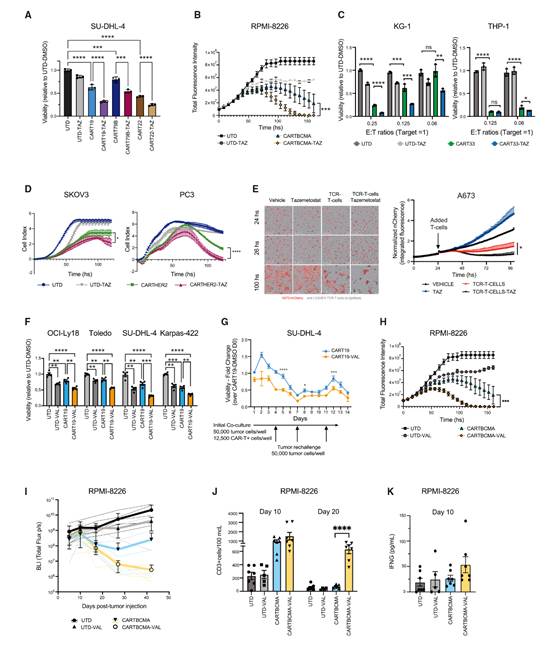
图4:EZH2及EZH1/EZH2抑制使血液肿瘤和实体肿瘤模型对免疫疗法产生敏感性
结论:
综上所述,在这项研究中,作者证明了抑制EZH2或同时抑制EZH1/EZH2能够显著增强CAR-T和TCR-T细胞过继免疫疗法在多种癌症模型中的抗肿瘤效果,这些模型包括液体肿瘤和实体肿瘤。作者的研究揭示了一种通过使用EZH1/EZH2抑制剂来增强过继T细胞疗法的方法。此外,该研究还为EZH2以及EZH1/EZH2在免疫治疗过程中调节肿瘤细胞和T细胞的作用机制提供了见解。
实验方法:
皮下或原位移植瘤模型,RNA-seq,scRNA-seq,ATAC-seq,细胞培养,WB,ELISA,免疫荧光,流式
参考文献:
Porazzi P, Nason S, Yang Z, Carturan A, Ghilardi G, Guruprasad P, Patel RP, Tan M, Padmanabhan AA, Lemoine J, Fardella E, Zhang Y, Pajarillo R, Chen L, Ugwuanyi O, Markowitz K, Delman D, Angelos MG, Shestova O, Isshiki Y, Blanchard T, Béguelin W, Melnick AM, Linette GP, Beatty GL, Carreno BM, Cohen I, Paruzzo L, Schuster SJ, Ruella M. EZH1/EZH2 inhibition enhances adoptive T cell immunotherapy against multiple cancer models. Cancer Cell. 2025 Feb 20:S1535-6108(25)00031-5. doi: 10.1016/j.ccell.2025.01.013IF: 48.8 Q1 . Epub ahead of print. PMID: 39983725.






