间充质干细胞外泌体应用于骨质疏松治疗
骨质疏松症是一种以骨量减少和骨密度降低为特征的全身性代谢性疾病,严重影响患者的生活质量。间充质干细胞(MSCs)的外泌体是其分泌组的重要组成部分,包含多种细胞因子、趋化因子、生长因子和细胞外囊泡(EVs)。这些外泌体通过调节骨髓微环境中的细胞活动,促进骨形成和维持骨稳态。外泌体的生物活性使其在组织再生中具有重要潜力。该研究发现,MSCs的外泌体能够增强成骨活性,减少骨吸收,在骨质疏松症治疗中具有潜在的应用价值。这种外泌体介导的骨再生机制为开发新型非细胞疗法提供了理论基础。该研究于2025年2月发表在《Stem Cell Research & Therapy》,IF=7.1。
技术路线

研究结果
1. 体外和体内MSCs的成骨作用增强,由Smurf1缺失的大鼠间充质干细胞的条件培养基介导
为了测试Smurf1沉默MSCs的分泌组是否具有显著的成骨潜力,研究者研究了Smurf1沉默的大鼠MSCs的条件培养基(rCM-Smurf1)是否能够增强体外和体内的成骨分化。Smurf1沉默MSCs的分泌组可能通过旁分泌机制影响其他MSC群体的成骨分化。为此,研究者用rCM-Smurf1和转染对照GapmeR的rMSCs的条件培养基(rCM-Ctrl)处理rMSCs 48小时,然后诱导成骨分化12天。研究者关注了,如Runx2和Alpl,以评估分化过程的初始阶段。结果显示,在用rCM-Smurf1处理的细胞中,成骨早期标志物Runx2的表达在分化第8天略有增加,尽管这一增加并不具有统计学意义。然而,研究者观察到,在第8天和第12天,用rCM-Smurf1处理的细胞中Alpl的表达水平显著增加,表明在这种条件下成骨分化得到增强(图1A)。用rCM-Smurf1预处理的细胞中ALPL活性显著增加以及通过Alizarin Red染色测量的矿化水平也显著更高(图1A和B)。此外,为了分析rCM-Smurf1在体内的成骨能力,研究者将rMSCs接种在藻酸盐支架上,并用rCM-Smurf1和rCM-Ctrl预处理16小时,然后将其异位植入Sprague-Dawley大鼠的皮下位置(图1B)。使用空支架(无细胞)和未处理的MSCs接种的支架作为对照。植入物在8周后被手术移除,并通过组织学技术分析新骨形成的程度。在用rCM-Smurf1预处理的细胞的支架中,骨基质特别丰富,通过Masson-Goldner技术染色的胶原蛋白呈深蓝色区域广泛存在(图1C)。在更高倍率下观察,rCM-Smurf1样本中嵌入基质内的细胞被空区域包围,类似于骨细胞在骨细胞陷窝内的形态。新骨形成的定量分析清楚地表明,在rCM-Smurf1支架中骨基质的存在显著更高。此外,使用抗碱性磷酸酶(ALPL)和抗骨钙素(OCN)抗体的免疫组化分析表明,与用rCM-Ctrl预处理的细胞接种的支架相比,用rCM-Smurf1预处理的细胞接种的支架中这些成骨蛋白的水平显著更高。
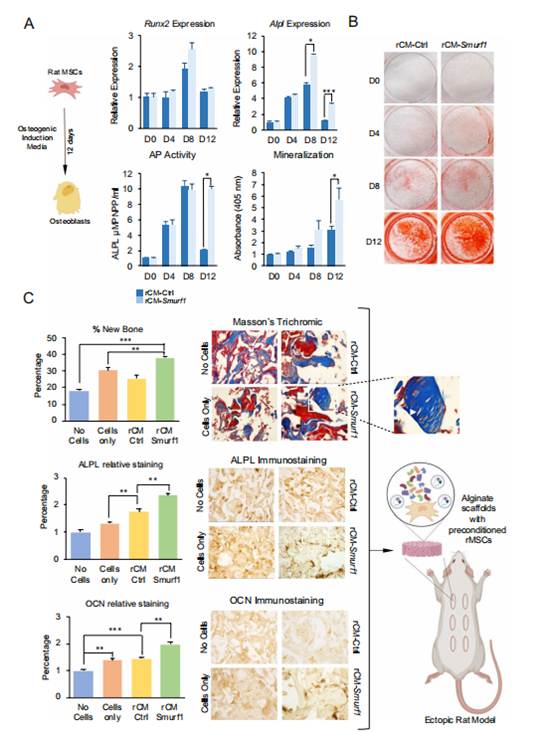
图1 体外和体内MSCs的成骨作用增强,由Smurf1缺失的大鼠间充质干细胞的条件培养基介导
2. Smurf1沉默的人类MSC条件培养基作为人类骨质疏松症MSC成骨分化的诱导剂
利用人类细胞系生成促成骨条件培养基(CM)将显著简化基于分泌组的生物医学产品的工业规模生产过程。鉴于该项目的长期目标是开发用于人类应用的此类产品,研究者研究了在原代rMSCs中观察到的效果是否能够在人类MSC细胞系中复制。研究者通过使用20 nM的GapmeR浓度,在建立了SMURF1沉默条件。研究者评估了来自SMURF1沉默的ASC52telo的条件培养基(hCM-SMURF1)和在ASC52telo细胞系中产生的对照CM(hCM-Ctrl)的成骨潜力。研究者发现在用hCM-SMURF1预处理的ASC52telo细胞中,ALPL的表达有增加的趋势。然而,与用hCM-Ctrl孵育的细胞相比,用hCM-SMURF1孵育的ASC52telo细胞的矿化水平显著更高,这表明hCM-SMURF1对这一过程有积极作用。
在之前的研究中,研究者证明了骨质疏松症患者的骨髓MSCs(hMSCs-OP)与健康供体来源的MSCs相比,表现出显著降低的成骨潜力。为了在体外评估CM-SMURF1作为潜在的促成骨治疗剂的适用性,必须确定其在增强hMSCs-OP的成骨分化中的有效性。因此,研究者在人类MSC细胞系ASC52telo中转染SMURF1或Ctrl GapmeRs,使用与之前相同的程序制备CM。然后评估这两种CM(hCM-SMURF1和hCM-Ctrl)的促成骨能力,通过用这些CM预处理从骨质疏松症患者的股骨头中分离的hMSCs-OP 48小时,然后开始成骨分化(图2)。在23名符合研究者严格纳入标准的骨质疏松症女性患者的原代细胞培养中,分别进行分析。在成骨分化第20天的分析显示,主要成骨基因RUNX2和ALPL的表达水平在两组间没有显著差异。然而,在用hCM-SMURF1预处理的hMSCs-OP中观察到ALPL表达有增加的趋势(图2A,上图)。重要的是,在所有实验中,用hCM-SMURF1预处理的hMSCs-OP的碱性磷酸酶活性和矿化程度的显著差异被清晰地观察到(图2A和B)。此外,与用hCM-SMURF1处理的原代细胞相比,用hCM-SMURF1处理的ALPL活性和矿化水平与用BMP2处理的水平高度相似(图2A)。为了深入了解hCM-SMURF1如何影响骨形成,研究者使用了来自三名骨质疏松症患者的股骨头的体外人骨培养。在适当培养基中与hCM-SMURF1或hCM-Ctrl共培养。骨样本在培养中维持4天,50%的CM。在此之后,骨样本被分离,总mRNA被提取以定量关键骨稳态标志物的基因表达。有趣的是,来自转染SMURF1 GapmeR的MSCs的CM显示出RANKL表达水平显著降低,RANKL是促进破骨细胞分化和激活的关键分子,导致骨吸收(图2C,上图)。作为RANKL的诱饵受体,OPG的表达水平保持不变,从而导致RANKL/OPG比率降低(图2B,下图)。这一比率反映了骨吸收和形成的平衡,较高的比率表明破骨细胞活性增加,可能导致骨丢失,而较低的比率表明骨吸收减少,可能有助于骨保护。然而,在M-CSF和BGLAP的水平上没有观察到显著变化(图2C,下图)。
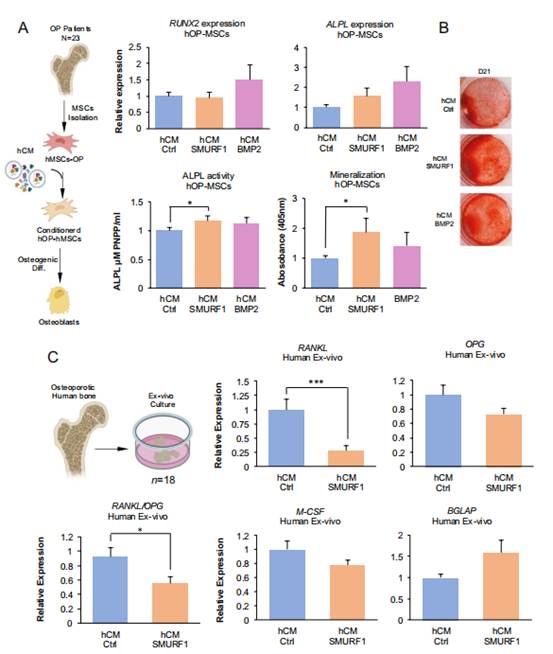
图2 Smurf1沉默的人类MSC条件培养基作为人类骨质疏松症MSC成骨分化的诱导剂
3. CM-SMURF1的生物安全性及其对基本细胞功能的影响
研究者使用ASC52telo细胞系进行了一系列实验,以深入了解CM产生的生物安全性,并研究其对基本细胞功能的可能影响。最初,研究者通过在9天内进行MTT实验,评估了hMSCs中SMURF1沉默的CM对细胞增殖的影响。研究者的发现在用hCM-SMURF1处理的细胞中,在第7天观察到细胞增殖有适度但具有统计学意义的增加,然而这种增殖效应在后续时间点并未持续(图3A)。细胞增殖数据以连续两天的MTT吸光度比值表示(例如,第5天/第3天,第7天/第5天),提供相对生长动态的分析,而不是绝对细胞数量。随后,研究者试图通过划痕实验确定hCM-SMURF1在机械损伤后促进细胞修复的能力(图3B)。在用不同CM处理的单层细胞中引入缺陷后,在0、12、24和36小时监测恢复情况,直到平板表面被完全覆盖。研究者观察到用CM处理的细胞的迁移能力总体上有所改善,然而,研究者的结果表明用对照CM和hMSCs中SMURF1沉默的CM之间没有显著差异。为了研究不同CM对MSCs基本特性的影响,研究者研究了用CM-SMURF1孵育是否会影响MSCs的趋化反应。为此,研究者使用基质细胞衍生因子1-α(SDF1-α)作为基准趋化因子来评估MSCs的趋化反应。与未加CM的对照细胞相比,CM-Ctrl和CM-SMURF1均显示出比未处理的CM更强的吸引hMSCs的能力(图3C)。研究者还注意到,与对照CM相比,向hCM-SMURF1的细胞迁移率显著更高。
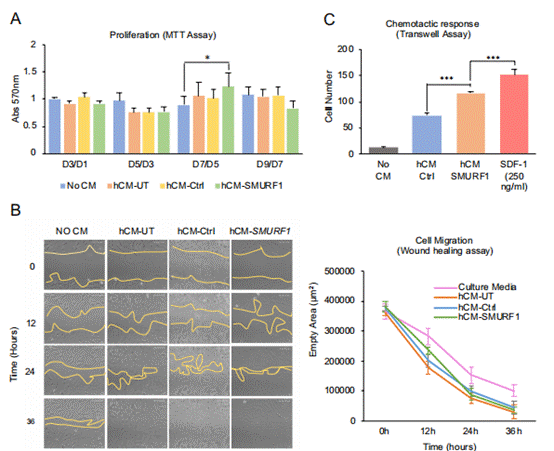
图3 CM-SMURF1的生物安全性及其对基本细胞功能的影响
4. 从CMs中分离并鉴定囊泡分数
接下来,研究者分离了hCM-SMURF1和hCM-Ctrl样本中的细胞外囊泡(EVs)。通过纳米粒子跟踪分析(NTA)确定分离的EVs的总颗粒数和平均大小。分离的EVs的平均颗粒直径为131.3 ± 3.7 nm(CM-Ctrl)和114.3 ± 6 nm(CM-SMURF1)(图4A)。这表明两种制备物中均存在纳米级囊泡。主要峰值在50-150 nm范围内表明存在外泌体,外泌体的典型大小范围为30-50 nm。透射电子显微镜(TEM)进一步证实了两种样本中EVs的存在,显示出分泌组非可溶性部分的典型囊泡结构(图4B)。为了进一步鉴定分离的外泌体,研究者使用免疫珠子测定法,采用珠子结合捕获抗体和荧光标记的检测抗体。流式细胞仪分析证实,来自CM-Ctrl和CM-SMURF1的外泌体在其表面均表达特定标记物CD63和CD9(图4C)。用Vybrant CM-Dil对外泌体染色,证实了MSCs成功摄取了分离的外泌体。使用活细胞共聚焦显微镜记录了与标记外泌体孵育2小时的ASC57telo细胞的高分辨率3D图像(图4D)。
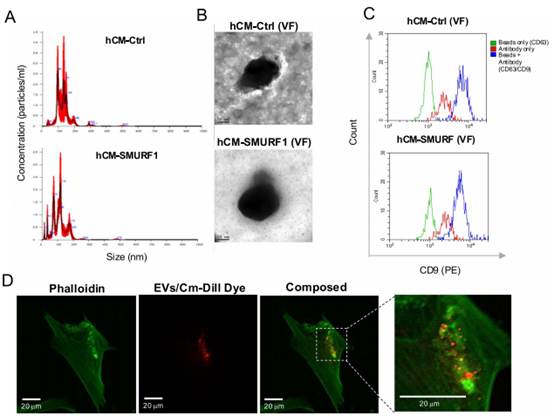
图4 从CMs中分离并鉴定囊泡分数
5. 分析CM-SMURF1的可溶性和囊泡分数的成骨活性
在建立了从hCM-Ctrl和hCM-SMURF1中分离可溶性(SF)和囊泡分数(VF)的方法后,研究者研究了它们单独诱导成骨分化的潜力。在诱导成骨之前,ASC52telo细胞用来自CM-Ctrl或CM-SMURF1的可溶性或囊泡分数孵育48小时,按照已建立的未分离CM的相同方法进行。随后,替换培养基,并按照标准方法进行成骨分化。在诱导后第16天分析成骨标志物,结果显示与CM-Ctrl相比,CM-SMURF1的可溶性分数中RUNX2表达显著增加。同样,ALPL表达也增加,这通过与CM-Ctrl相比CM-SMURF1的可溶性分数中增强的碱性磷酸酶活性得到证实(图5A)。尽管在比较CM-Ctrl和CM-SMURF1的囊泡分数时,上述参数未观察到显著变化,但在CM-Ctrl和CM-SMURF1的可溶性和囊泡分数中,通过Alizarin Red染色定量的矿化程度显著更高,这可能反映了两种分数在体外矿化过程中都有一定的贡献(图5A和B)。接下来,研究者试图鉴定hCM-SMURF1和hCM-Ctrl的可溶性和囊泡分数中差异调节的蛋白质。为此,研究者通过质谱分析比较了来自四次独立沉默实验的CM-Ctrl和hCM-SMURF1的可溶性和囊泡分数的蛋白质组。该研究鉴定了两种分数中的一些受影响蛋白质(图5C)。在这些蛋白质中,研究者鉴定了在CM-SMURF1的可溶性分数中过表达的关键骨形成调节因子PREPL和FMOD,而在CM-SMURF1的囊泡分数中,SPARC和CCN2过表达。在所有情况下,通过qPCR验证的MS结果与MS分析中发现的这些蛋白质的相对丰度一致(图5D)。GO分析显示,与CM-SMURF1外泌体分数中显著富集的蛋白质相关的GO功能注释生物学过程为“细胞外基质组织”和“骨化”。
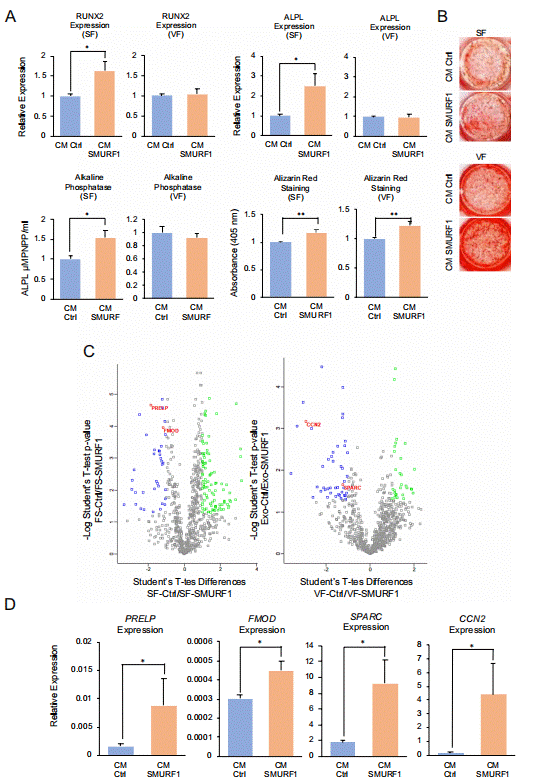
图5 分析CM-SMURF1的可溶性和囊泡分数的成骨活性
6. Smurf1沉默的细胞条件培养基减少OVX诱导的骨丢失
研究者使用了去卵巢(OVX)小鼠模型来模拟绝经后女性的骨质疏松症,旨在评估转染细胞的条件培养基(CM)对骨再生的影响。为了进行这项分析,研究者首先在小鼠MSC系C3H10t1/2中生成了实验性CM,研究者能够在这个细胞系中高效沉默Smurf1基因。在去卵巢手术后一周,研究者在小鼠股骨髓腔内进行了一次性注射(图6A)。建立了三组OVX小鼠:一组注射NaCl(NaCl组),一组注射转染对照GapmeR的小鼠MSCs的条件培养基(CM-Ctrl组),一组注射转染Smurf1靶向GapmeR的小鼠MSCs的条件培养基(CM-Smurf1组)。还包含一个未进行去卵巢手术的对照组(No-OVX组)(图6B)。在注射后一个月,使用微计算机断层扫描(micro-CT)分析股骨远端的骨小梁变化(图6A)。与未去卵巢的No-OVX小鼠相比,NaCl处理组的骨小梁显著减少,骨骼几乎耗尽了骨小梁结构。重要的是,与OVX小鼠和CM-Ctrl组相比,注射CM-Smurf1的小鼠显示出更高的骨小梁比例(图6B)。进一步的微CT参数分析显示,与OVX和CM-Ctrl组相比,CM-Smurf1组的骨体积/总体积(BV/TV)比值显著增加,表明Smurf1沉默的促成骨活性对CM的积极影响。CM-Smurf1的积极效应也反映在骨小梁数量(Tb.N)和骨小梁间距(Tb.sp)的值上,尽管在CM-Ctrl和CM-Smurf1组之间未观察到显著差异(图6C)。
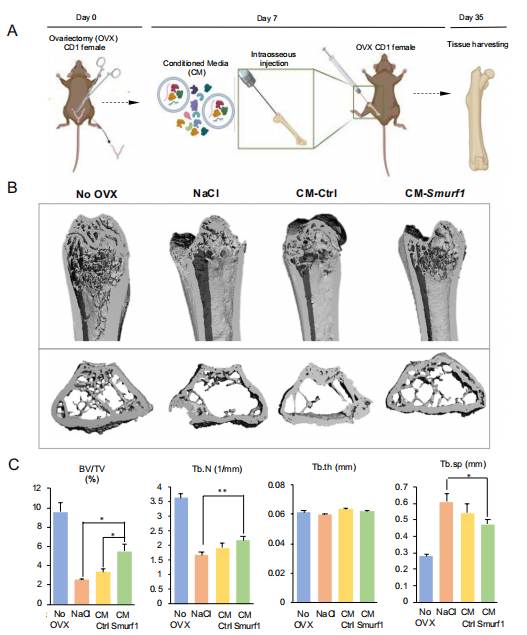
图6 Smurf1沉默的细胞条件培养基减少OVX诱导的骨丢失
结论
研究发现Smurf1沉默后的外泌体中富集的蛋白质与“细胞外基质组织”和“骨化”相关,这表明这些蛋白质可能在骨形成过程中发挥重要作用。体内外实验结果表明,Smurf1沉默的细胞条件培养基(CM-Smurf1)显著增加了骨小梁的骨量,减少了骨丢失。这表明CM-Smurf1具有促进骨形成的潜力,可能成为治疗骨质疏松症的有效手段。
实验方法
细胞培养、GapmeR 技术沉默基因表达、条件培养基制备、体外成骨分化实验、卵巢切除(OVX)小鼠模型、体内异位骨形成模型、体外人骨组织培养、外泌体分离、纳米粒子跟踪分析(NTA)、透射电子显微镜(TEM)和流式细胞术、蛋白质组学分析、micro CT 扫描。
参考文献
González-González A, Álvarez-Iglesias I, García-Sánchez D, Dotta M, Reyes R, Alfonso-Fernández A, Bolado-Carrancio A, Díaz-Rodríguez P, Pérez-Núñez MI, Rodríguez-Rey JC, Delgado-Calle J, Pérez-Campo FM. Paracrine activity of Smurf1-silenced mesenchymal stem cells enhances bone regeneration and reduces bone loss in postmenopausal osteoporosis. Stem Cell Res Ther. 2025 Feb 7;16(1):50. doi: 10.1186/s13287-025-04165-0. PMID: 39920824; PMCID: PMC11806587.






