三阴性乳腺癌化疗和PD-L1阻断剂联合疗法的细胞机制各不相同
三阴性乳腺癌(TNBC)是一种侵袭性强、预后差的乳腺癌亚型,传统治疗对其作用有限。近年来,化疗药物(如紫杉醇和白蛋白结合型紫杉醇)与PD-L1阻断剂(如正反应)的联合疗法显示出治疗潜力,但其具体机制尚不完全清楚。为了深入理解不同化疗药物与免疫疗法联合时的细胞机制差异,作者通过单细胞RNA测序(scRNA-seq)和T细胞受体测序(TCR-seq),分析了TNBC患者在接受不同联合治疗方案后的免疫细胞动态变化。作者发现,白蛋白结合型紫杉醇(Nab-PTX)与阿特珠单抗(ATZ)联合治疗能够显著重塑肿瘤免疫微环境,特别是通过增加肥大细胞和促炎性巨噬细胞的比例,促进T细胞和B细胞的招募和激活。与PTX联合ATZ相比,Nab-PTX联合ATZ能够将CD8+ T细胞从耗竭状态转变为具有干细胞特征的记忆效应T细胞(Tsem),同时减少调节性T细胞(Treg)的比例,从而增强抗肿瘤免疫反应。此外,肥大细胞的激活在Nab-PTX联合治疗中发挥了关键作用,可能通过促进T细胞和B细胞的招募来增强PD-L1阻断剂的疗效。小鼠模型实验进一步证实了肥大细胞激活对肿瘤生长的抑制作用。总之,作者的研究揭示了不同化疗药物与PD-L1阻断剂联合时多种免疫细胞的动态和肥大细胞在联合治疗中的关键作用与具体机制,并为开发新的联合治疗策略提供了理论依据。该研究于2025年1月发表在《Cancer cell》,IF 48.8分。
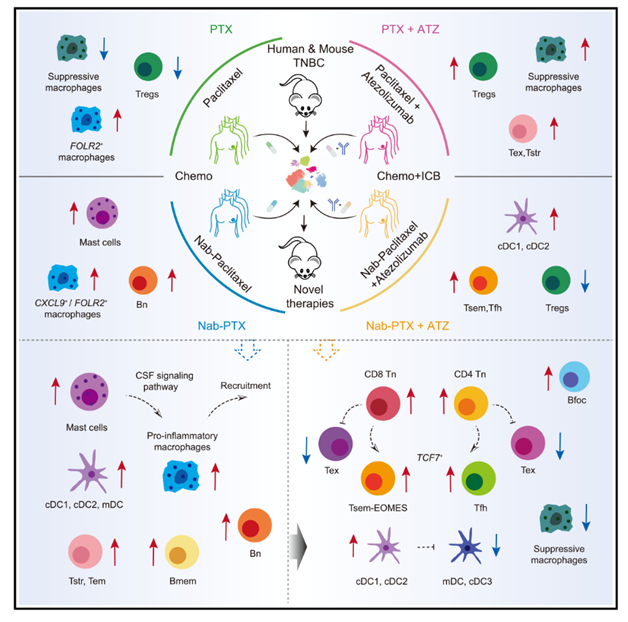
技术路线:
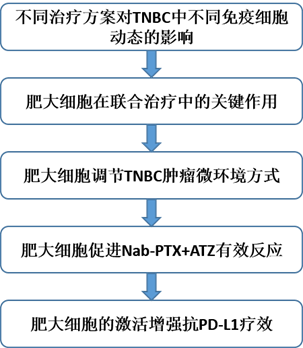
主要研究结果:
1 三阴性乳腺癌(TNBC)中的免疫细胞图谱及动态变化
作者从44例TNBC患者中获得了78份肿瘤活检样本。其中,16例接受了Nab-PTX联合ATZ治疗,12例接受了Nab-PTX治疗,9例接受了PTX联合ATZ治疗,7例接受了紫杉醇治疗。根据可获得性,收集了包括原发性乳腺肿瘤和转移性病灶在内的肿瘤样本,并将其分为应答者(R)和非应答者(NR)(图1A)。
利用scRNA-seq对TNBC中的免疫浸润进行分析,经过严格的质量筛选后,作者共鉴定出285,001个T细胞、87,595个B细胞、18,718个自然杀伤(NK)细胞和56,180个髓系细胞(图1B)。作者进一步比较了匹配部位的治疗前后样本,分析免疫细胞的动态变化,帮助减少基线差异的影响。尽管样本量限制了统计学意义,但作者仍观察到不同治疗方案之间存在不同的动态模式(图1C)。具体而言,PTX治疗后T细胞和NK细胞增加,而Nab-PTX+ATZ治疗后髓系细胞减少。此外,化疗后应答者的T细胞增加(图1D),而接受Nab-PTX+ATZ治疗的应答者中B细胞呈上升趋势,而在PTX治疗后则下降。相比之下,接受Nab-PTX+ATZ治疗的应答者中髓系细胞减少,而PTX治疗后NK细胞增加。值得注意的是,B细胞在联合治疗的应答者中占主导地位(图1E)。预测指数(Pi)和治疗指数(Ti)分析一致显示,基线B细胞水平较高与对联合治疗和PTX的正反应相关,而T细胞则是Nab-PTX的有利预测因子(图1E)。
通过提高聚类分辨率,作者鉴定出CD4+ T细胞、CD8+ T细胞、CD20+ B细胞、滤泡B(Bfoc)细胞、浆细胞(Pc)、CD56+ NK细胞、CD16+ NK细胞、浆细胞样树突状细胞(pDC)、肥大细胞(Mc)以及其他髓系细胞(图1F)。B细胞亚群表现出较高的Pi,并与对Nab-PTX+ATZ的正反应相关(图1G和图1H),而Bfoc和CD4+ T细胞表现出较高的治疗指数,表明它们在应答者中增加。根据预测能力和在应答者中的增加趋势,作者发现CD8+ T细胞和CD16+ NK细胞倾向于在PTX治疗后的应答者中增加,而CD4+ T细胞和CD56+ NK细胞与对Nab-PTX的正反应相关。
鉴于样本量有限,作者采用多色免疫组化(IHC)染色法对16份肿瘤样本中的CD8+ T细胞、CD4+ T细胞和CD20+ B细胞进行评估,结果与作者的scRNA-seq数据一致(图1I)。作者还注意到,在Nab-PTX+ATZ治疗后,这些细胞在应答性肿瘤中的水平增加,与scRNA-seq观察到的趋势一致(图1J和图1K)。
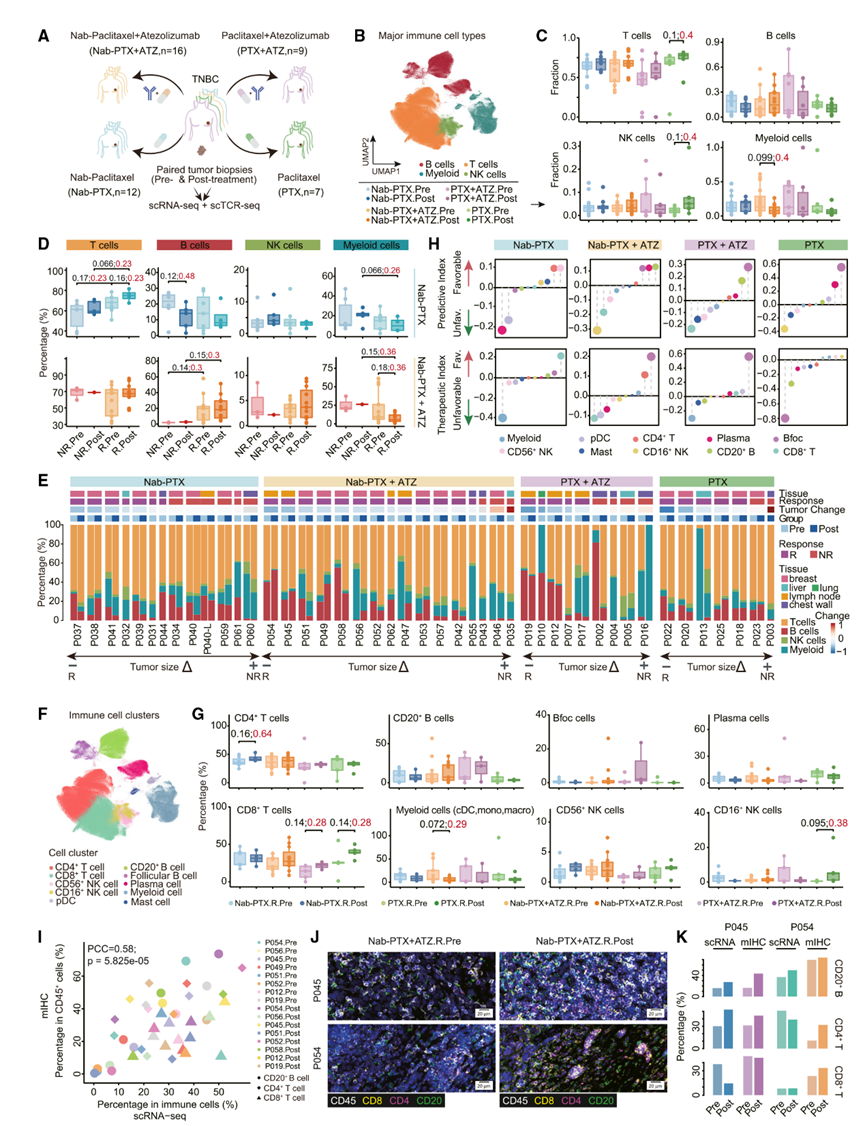
图1:TNBC中的免疫细胞图谱及动态变化
2 CD8+ T细胞在不同治疗后的差异动态变化
作者在每个主要免疫细胞群内构建了高分辨率图谱,鉴定出4个以CXCL13和LAG3表达为标志的Tex亚群(图2A),每个亚群的耗竭标志物、效应标志物和记忆标志物表达水平各有不同。具体而言,Tex-PDCD1和Tex-GZMB表现出较高的HAVCR2和TIGIT水平,以及更高的耗竭评分(图2A和图2B)。Tex-GZMB主要富集于与Nab-PTX相关的治疗组。对Nab-PTX+ATZ治疗有应答的患者Tex-GZMB水平降低,而NR在接受治疗后Tex-GZMB水平增加(图2C、2D)。相比之下,Tex-PDCD1主要富集于与PTX相关的治疗组,对PTX+ATZ治疗有应答的患者表现出Tex-PDCD1水平上升的趋势,而对PTX治疗有应答的患者在接受治疗后Tex-PDCD1水平则呈下降趋势(图2C和2D)。对于Tex-ISG15和Tex-MKI67,这两个亚群均富集于与Nab-PTX相关的治疗组,且在接受治疗后,应答者的这两个亚群水平均呈下降趋势。这些发现表明,Nab-PTX+ATZ治疗能够降低Tex水平,而PTX+ATZ治疗与其他治疗方案相比,似乎会增加Tex水平。
Tsem在接受联合治疗(尤其是Nab-PTX+ATZ治疗)后应答者的水平增加(图2C、2D)。相比之下,Tisg和Tstr在接受Nab-PTX+ATZ治疗后应答者的水平降低,而Tstr在接受PTX或其与ATZ联合治疗后应答者的水平则呈上升趋势。Tstr以热休克基因的表达为标志,与对免疫检查点阻断(ICB)治疗的耐药性相关。这说明,Nab-PTX+ATZ治疗能够促进一种有益的T细胞状态,这可能有助于其与其他治疗方案相比在临床中有更好的疗效。
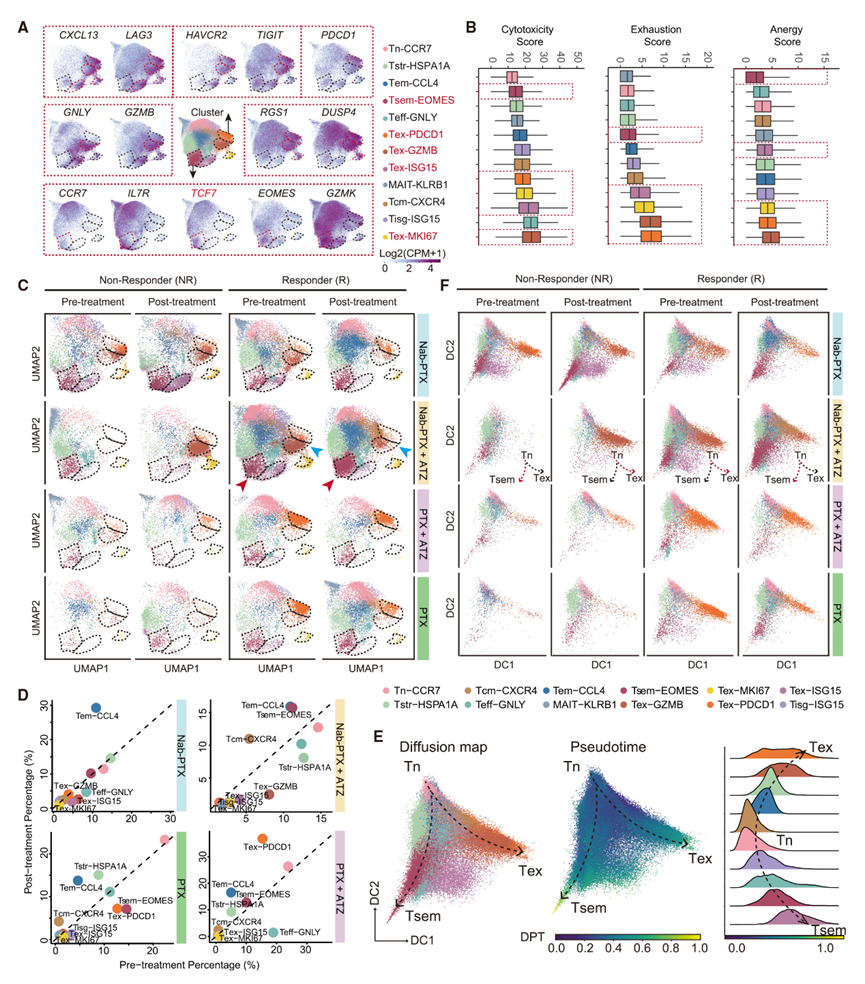
图2:CD8+ T细胞的组成及动态变化
3 解码CD8+ T细胞的过渡动态
作者接下来研究了CD8+ T细胞之间的谱系联系,揭示了两个分支均源自幼稚T细胞(Tn),分别以耗竭T细胞(Tex)或效应记忆T细胞(Tem)为终端状态,基于扩散图分析(图2E)。在Tex谱系中,Tex-PDCD1和Tex-GZMB位于终端且相互重合,而在Tem谱系中,Tsem伴随Teff和Tex-ISG15作为终端状态。谱系的分化可能受到不同治疗方案和临床结果的影响。具体而言,在对Nab-PTX联合ATZ治疗有应答的患者中,治疗前肿瘤中Tex谱系占主导地位,而治疗后肿瘤则向Tem谱系显著转变(图2F)。而NR在接受治疗后则表现出向Tex谱系的富集。这些结果表明,Nab-PTX+ATZ在应答者中有效地阻止了T细胞的耗竭,而在非应答者中,治疗对TIME的影响有限,反映了T细胞耗竭的自然进展。
TCR对T细胞的功能至关重要,克隆扩增可以暗示肿瘤抗原的反应性。与先前的研究一致,Tn包含大量的独特克隆,而Tex和效应T细胞(Teff)表现出高度的克隆扩增(图3A)。作者还观察到,有效的Nab-PTX+ATZ治疗减少了Tex亚群之间的转换,同时增强了Tsem的转换。具体而言,在对Nab-PTX+ATZ治疗有应答的治疗前肿瘤中,观察到Tex细胞之间以及Tem与Tn、Tcm和Tstr之间的显著转换,而在治疗后,观察到Tsem、Tcm和Tem之间的大量转换(图3B和图3C)。通过定义转换枢纽性(STAR方法),作者发现这种联合治疗将转换枢纽从Tn和Tex-GZMB转移到Tsem和Tem(图3D)。相比之下,在有效的PTX+ATZ治疗后,CD8+ T细胞的转换动态变化较小。对于化疗而言,Tn、Tem和Tsem的转换枢纽性在有效治疗后持续增加(图3D)。值得注意的是,PTX治疗后Tex-PDCD1的枢纽性显著降低。
综上所述,作者的研究结果表明,Nab-PTX+ATZ不仅能抑制Tex群体的转换,而且通过重新配置干细胞样Tem细胞来实现增强的疗效。相比之下,PTX+ATZ似乎只能实现部分效果,导致Tex转换适度减少,但未能重新配置Tem群体。两种化疗方案对Tem和Tex细胞的影响有限,但倾向于促进Tn细胞的扩增。
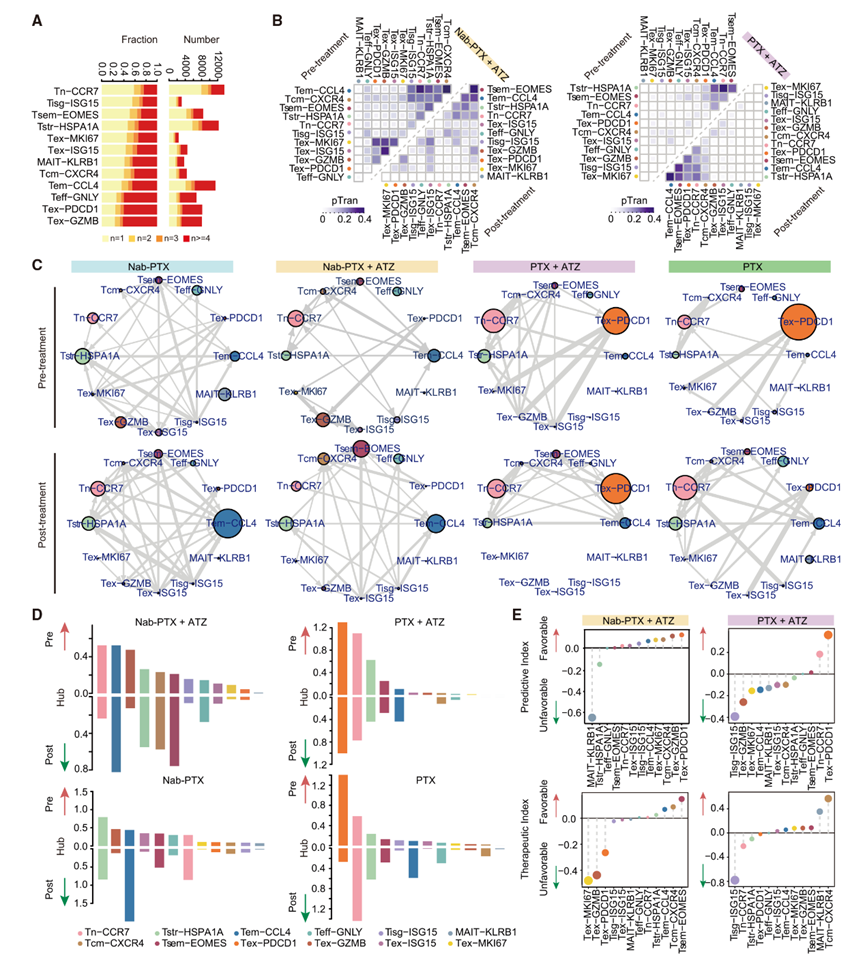
图3:CD8+ T细胞的过渡动态
4 CD8+ T细胞与临床反应的关联
与Pi分析显示一致,Nab-PTX联合ATZ治疗后,耗竭型CD8+ T细胞(Tex)与临床正向反应相关,而Tstr与不利的临床反应相关(图3E)。与Ti分析结果一致,干细胞样效应记忆型CD8+ T细胞(Tsem)在应答者中的比例增加,而Tex-GZMB在非应答者中更为常见(图3E)。这些观察结果进一步强调了在有效的Nab-PTX+ATZ治疗后,效应记忆型CD8+ T细胞(Tem)的扩增以及耗竭型CD8+ T细胞(Tex)的收缩。对于其他治疗方案,作者注意到对PTX联合ATZ治疗有应答的患者表现出较高的耗竭型PDCD1+ CD8+ T细胞(Tex-PDCD1)比例,而非应答者在治疗前和治疗后的样本中均显示出较高的干扰素应答型CD8+ T细胞(Tisg)和Tstr比例(图3E)。
5 鉴定响应性肿瘤浸润性CD4+ T细胞
随后,作者将研究重点转向CD4+ T细胞,发现它们在协调CD8+ T细胞反应中发挥的关键作用。作者鉴定出三个Tfh亚群,每个亚群均表达经典的Tfh标记物,如IL6ST、CXCR5和BCL6,但表达水平存在差异(图4A)。其中Tfh-CXCR5亚群的高表达TCF7与CD4+ T细胞的自我更新相关。CD4+ T细胞的耗竭亚群(Tex)以LAG3、HAVCR2和CTLA4等耗竭标记物为特征,同时表达效应分子,类似于Th1样细胞。Tex和Tfh亚群均高表达CXCL13和PDCD1(图4A),表明它们是作者在先前研究中鉴定的CXCL13+ T细胞的组成部分。在Tex、Treg和Tfh亚群中观察到显著的克隆扩增(图4B),这表明它们对肿瘤抗原有反应性。根据STARTRAC分析,这些亚群还表现出较高的转换指数,并且在Tex-LAG3与Tex-MKI67、Treg-FOXP3与Treg-MKI67之间以及Tex与Tfh之间观察到活跃的转换(图4B)。
Tfh和Tex亚群在应答者中富集,并与联合治疗的正反应相关,而Tstr和Teff在NR中富集,并指示不利结果(图4C)。Treg在非应答者中富集,与对PTX+ATZ的负反应相关。对Nab-PTX+ATZ有应答的患者表现出Treg、Tex和Tisg水平的降低,以及Tn-IL7R和Tfh水平的增加(图4D–4F)。相比之下,非应答者表现出Tex水平的增加,以及Tn-IL7R的降低(图4F)。这些发现表明,Nab-PTX+ATZ降低了Treg和Tex,同时促进了Tfh的扩增。PTX+ATZ增加了Treg和Tstr,另外,Tfh也表现出上升趋势(图4D、4E)。两种化疗药物均与Tfh-DUSP4的增加趋势和Tex的减少趋势相关。此外,PTX降低了Treg,而Nab-PTX增加了Tstr水平。
综上所述,这些发现表明,Tfh的增加以及Treg和Tstr的同步减少对于有效的TNBC治疗至关重要。Treg和Tstr可能是影响PTX+ATZ疗效的原因。
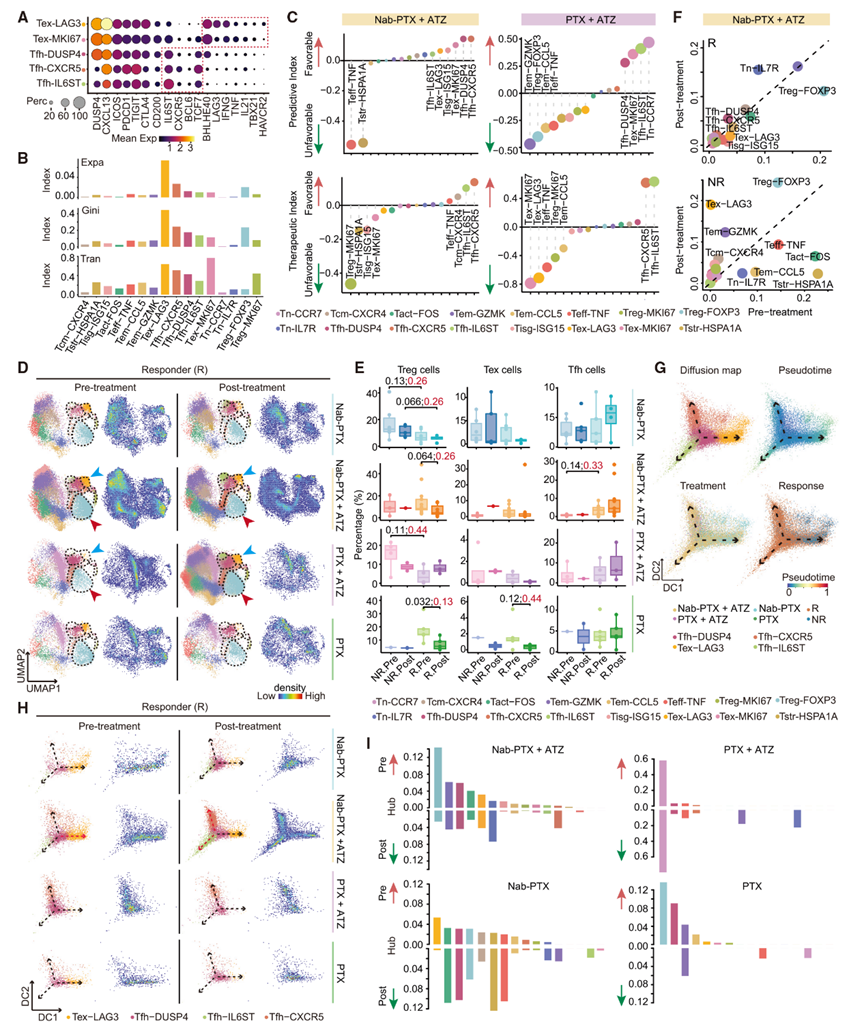
图4:CD4+ T细胞的组成及动态变化
6 Tfh/Tex的谱系动态及其与临床反应的关联
鉴于Tfh/Tex在有效治疗中的重要性,作者重建了它们的谱系层次,以阐明潜在的细胞命运可塑性。Tfh-DUSP4被鉴定为过渡态,分化出三个分支,分别以Tex-LAG3、Tfh-CXCR5和Tfh-IL6ST为终端状态(图4G)。值得注意的是,对Nab-PTX+ATZ有应答的患者在治疗前表现出Tfh-DUSP4和Tex-LAG3的富集,而在治疗后则转变为Tfh-CXCR5和Tfh-IL6ST的富集,而NR在治疗后表现出Tex-LAG3的增加(图4H)。这些观察结果表明,Nab-PTX+ATZ阻碍了Tfh-DUSP4向Tex的分化,而是将其偏向Tfh方向。相比之下,有效的PTX+ATZ治疗仅显示出从Tfh-DUSP4到Tfh-CXCR5的轻微转变。对于化疗药物,有效的治疗一致地将Tex-LAG3推向Tfh-DUSP4方向。
Ti分析一致显示,在联合治疗后,Tfh增加,而Tex和增殖亚群减少,而对化疗药物有应答的患者表现出Tfh-DUSP4和Tem-GZMK的增加(图4C)。这些结果表明,化疗药物减少了Tex,同时维持Tfh/Tex谱系处于中间状态。然而,当与ATZ联合使用时,特别是Nab-PTX+ATZ,能推动细胞状态向Tfh方向发展,表明其对CD4+ T细胞亚群有显著影响。
在接受Nab-PTX+ATZ有效治疗后,观察到从Treg到Tn-IL7R和Tfh-CXCR5的显著枢纽转移,而非应答者则表现出Tex和Treg的枢纽性增加(图4I)。对于化疗药物,接受Nab-PTX治疗的应答者表现出Tex的枢纽性降低,但Tfh-DUSP4、Treg、Tact、Tstr和Teff的枢纽性增加。相比之下,接受PTX治疗的应答者表现出Treg和Tfh-DUSP4的枢纽性降低,同时Tn-CCR7和Teff的枢纽性增加(图4I)。这些结果进一步证实了增强Tfh和Tn-IL7R,同时减少Treg和Tstr对于更好的治疗反应的重要性。
7 肥大细胞对Nab-PTX相关治疗的响应性扩增
肥大细胞在多种生理和病理过程中发挥复杂的作用,包括在肿瘤中,其传统上被认为与免疫调节和促肿瘤效应有关。在TNBC中,肥大细胞是TME的关键介质,影响免疫反应和肿瘤生长。值得注意的是,作者在接受Nab-PTX治疗的应答者中观察到肥大细胞浸润呈增加趋势(图5A、5B),但p值不显著。
作者随后利用小鼠4T1乳腺肿瘤模型来验证Nab-PTX和抗PD-L1治疗的效果。通过RNA-seq和scRNA-seq联合分析,发现尽管这些治疗之间的肿瘤大小没有显著差异,Nab-PTX治疗后肥大细胞浸润仍呈增加趋势(图5C)。Nab-PTX提高了Tn、Tcm、Tem和Treg的水平,同时Tex和Tfh呈上升趋势,而抗PD-L1治疗似乎提高了Tsem(图5D)。这说明肥大细胞可能与T细胞的招募有关,特别是增强了Tn,随后Tn转变为Tem和功能失调的表型,而抗PD-L1治疗则保留了Tsem并防止了T细胞功能障碍。
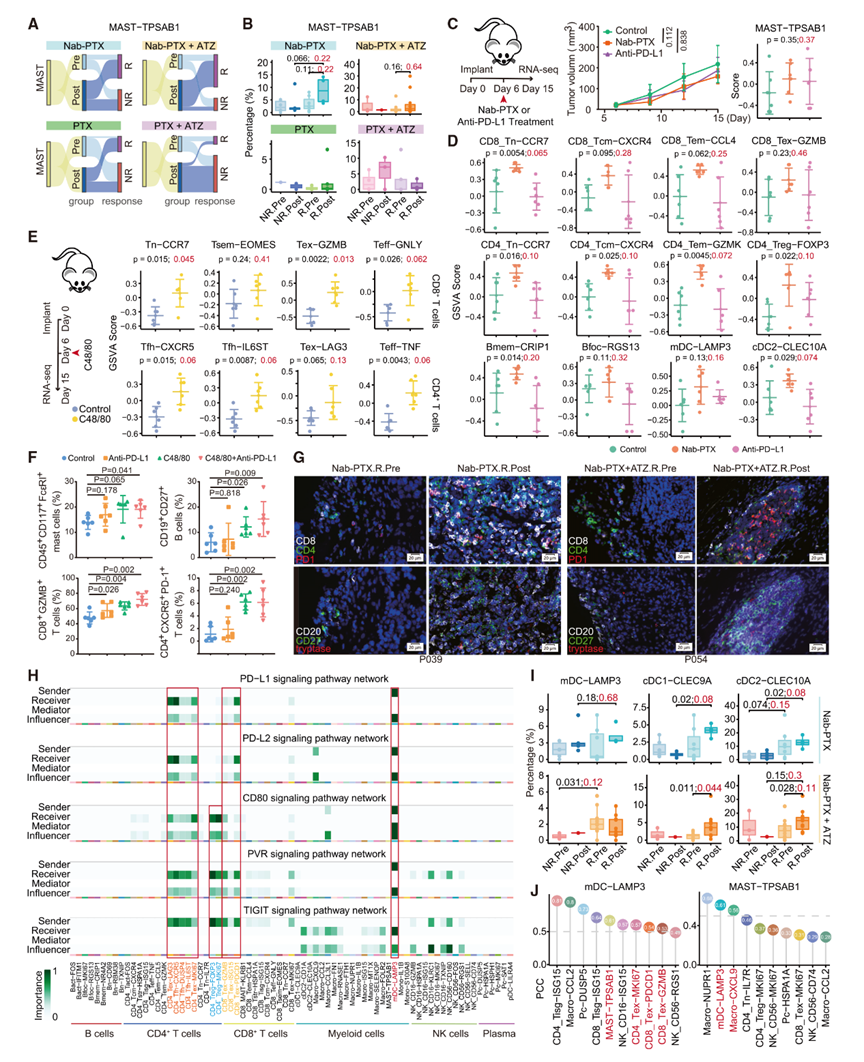
图5:肥大细胞及其相关免疫细胞的动态变化
8 肥大细胞激活与T细胞反应及其关键调节因子的联系
为了进一步揭示肥大细胞对TNBC肿瘤微环境的调节作用,作者用促进肥大细胞脱颗粒的阳离子激动剂48/80三盐酸盐(C48/80)处理同种异体小鼠肿瘤模型。在C48/80给药对肿瘤生长影响有限的情况下,但作者仍观察到肥大细胞水平升高,同时幼稚T细胞(Tn)、效应T细胞(Teff)、滤泡辅助T细胞(Tfh)和耗竭T细胞(Tex)也有所增加(图5E),这进一步表明肥大细胞激活与TNBC肿瘤微环境中的T细胞反应密切相关。Tex的高比例可能解释了对肿瘤生长影响有限的原因。为了在体内验证肥大细胞与T细胞反应之间的联系,作者进一步用抗PD-L1抗体、C48/80及其联合治疗小鼠。流式细胞分选(FACS)分析显示,C48/80治疗显著增加了肥大细胞、CD8+ GZMB+ T细胞和CD4+ CXCR5+ PD-1+ T细胞(图5F),从而巩固了作者的结果。
CD27+ B细胞持续增加(图5F)。作者还在对Nab-PTX和Nab-PTX+ ATZ有反应的临床样本上进行了多色免疫组化(IHC)染色,观察到治疗后肥大细胞和活化的T细胞及B细胞增加(图5G)。值得注意的是,联合治疗还在TNBC中扩大了Bfoc(图1G),突出了它们在Bfoc诱导中的作用。这些发现进一步强调了肥大细胞激活在塑造TNBC肿瘤微环境中免疫反应的作用。作者进一步分析了mDC与其他免疫细胞之间的配体-受体相互作用,揭示了其与Tex、Tfh和Treg通过CD274-PDCD1、CD80-CTLA4、NECTIN2-TIGIT和PVR-TIGIT等配对相互作用(图5H)。这些发现突出了mDC在TNBC免疫景观中的复杂作用。
9 肥大细胞在优化Nab-PTX联合正反应治疗中的重要性
为了进一步确认肥大细胞在促进对Nab-PTX+ATZ有效反应中的关键作用,作者用Nab-PTX联合抗PD-L1抗体、肥大细胞脱颗粒稳定剂色甘酸钠二钠盐(DSCG)以及Nab-PTX联合抗PD-L1抗体和DSCG的组合治疗小鼠4T1乳腺肿瘤模型(图6E)。Nab-PTX联合抗PD-L1治疗显著抑制了肿瘤生长。然而,当加入DSCG时,对肿瘤的疗效变差,这进一步强调了肥大细胞在增强这种联合治疗有效性中的关键作用。
作者进一步进行了RNA-seq,以研究小鼠肿瘤微环境(TME)的动态变化,发现与DSCG联合的治疗增加了调节性或抑制性树突状细胞亚群,特别是成熟的树突状细胞(mDC)和表达CD1A的树突状细胞(cDC2-CD1A)(图6F)。这些结果表明肥大细胞在调节抑制性树突状细胞亚群中具有双重作用。此外,肥大细胞的抑制降低了Tn、中央记忆T细胞(Tcm)、干细胞样效应记忆T细胞(Tsem)、滤泡辅助T细胞(Tfh)、B细胞前体(Bn)和浆细胞(Pc),同时增加了干扰素应答T细胞(Tisg)(图6F)。总体而言,这些发现进一步强化了肥大细胞在调节对有效Nab-PTX和抗PD-L1治疗至关重要的免疫群体中的关键作用。
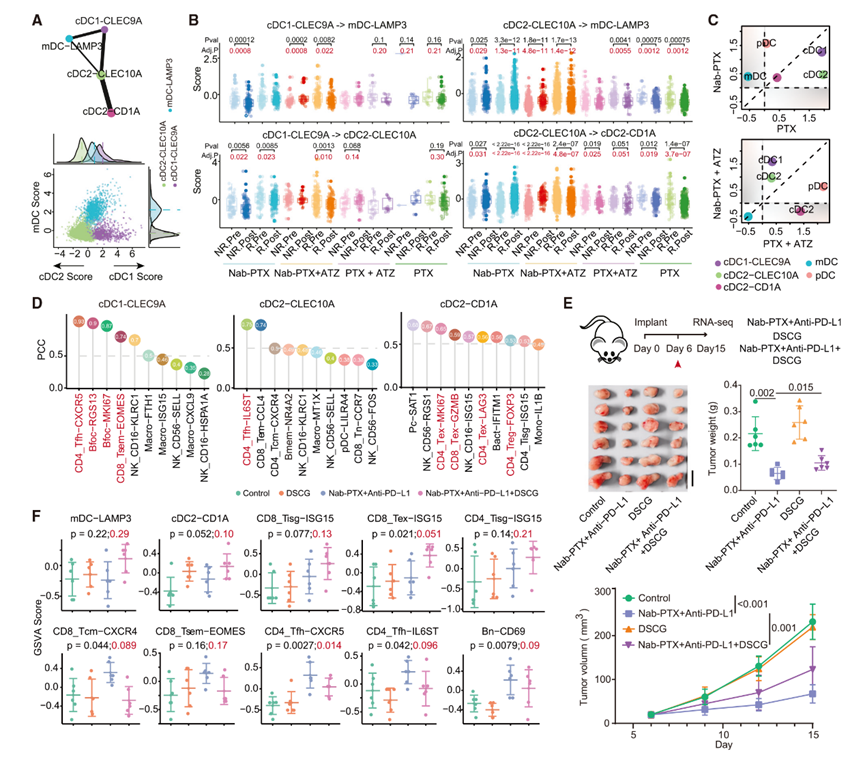
图6:树突状细胞亚群的谱系联系及动态变化
10 绘制TNBC中单核细胞/巨噬细胞的特征图谱
SPP1是一种标记血管生成性巨噬细胞的标志物,由多个亚群表达,包括macro-CCL2、macro-MT1X、macro-RNASE1、macro-FN1和macro-ISG15。这些亚群通过分泌各种分子发挥调节功能,并参与SPP1、FN1和MIF等通路。具体来说,macro-CCL2表达SPP1和IL1RN,连接单核细胞和巨噬细胞,而macro-FN1和macro-MT1X在转录组上与macro-CCL2相似。Macro-MT1X和macro-RNASE1倾向于M2特征,而macro-CCL2和macro-ISG15表现出M1和M2的双重特征(图7A)。
基于细胞组成,作者构建了相关性网络,并揭示了对Nab-PTX+ATZ有反应的肿瘤中共调控的模块(图7B)。作者根据特征亚群对这些模块进行了分类,并在基线时识别出六个模块,包括与Tex相关的模块、与Tfh/Bfoc相关的模块、干细胞样相关的模块、与Tn/Bn相关的模块、增殖相关的模块和应激相关的模块。Macro-CXCL9位于与Tfh/Bfoc相关的模块中,该模块包含Tfh和Bfoc。Macro-CCL3L1在转录组上与macro-CXCL9相似,并与Tn-IL7R、Tfh和Tsem一起位于干细胞样相关的模块中(图7B)。位于与Tex相关的模块中的Macro-CCL2与Tex、Tisg和mDC一起,表现出具有促炎和抗炎双重功能的特性。Macro-FOLR2、macro-NUPR1和macro-ISG15位于与Tn/Bn相关的模块中,而macro-RNASE1与Treg和cDC2-CD1A相关。Macro-FN1和mono-S100A8位于包含增殖性Treg和Tex的增殖相关模块中。这些相关性进一步突出了macro-CXCL9的促炎作用以及macro-RNASE1、macro-FN1和mono-S100A8的免疫抑制功能。
治疗后,作者观察到相关性景观的显著变化,树突状细胞在支持T细胞和B细胞反应方面的作用得到增强(图7B)。作者识别出一个干细胞样和与Tfh/Bfoc相关的模块,包括Tfh、Tn-IL7R、Tsem、Bfoc、Bmem、cDC1、macro-FOLR2和macro-FTH1,以及一个包含Tfh-IL6ST、Bn和cDC2-CLEC10A的与Tfh/Bn相关的模块。Macro-MT1X、macro-ISG15、mono-IL1B和cDC2-CD1A与Tex和Treg聚集在一起,而macro-FN1和mono-S100A8是应激相关模块的一部分,突出了它们的免疫抑制作用。Macro-CCL2位于由IFN应答相关亚群组成的IFN相关模块中,而macro-CCL3L1被发现在与Tn/Teff相关的模块中,进一步强化了其促炎功能。
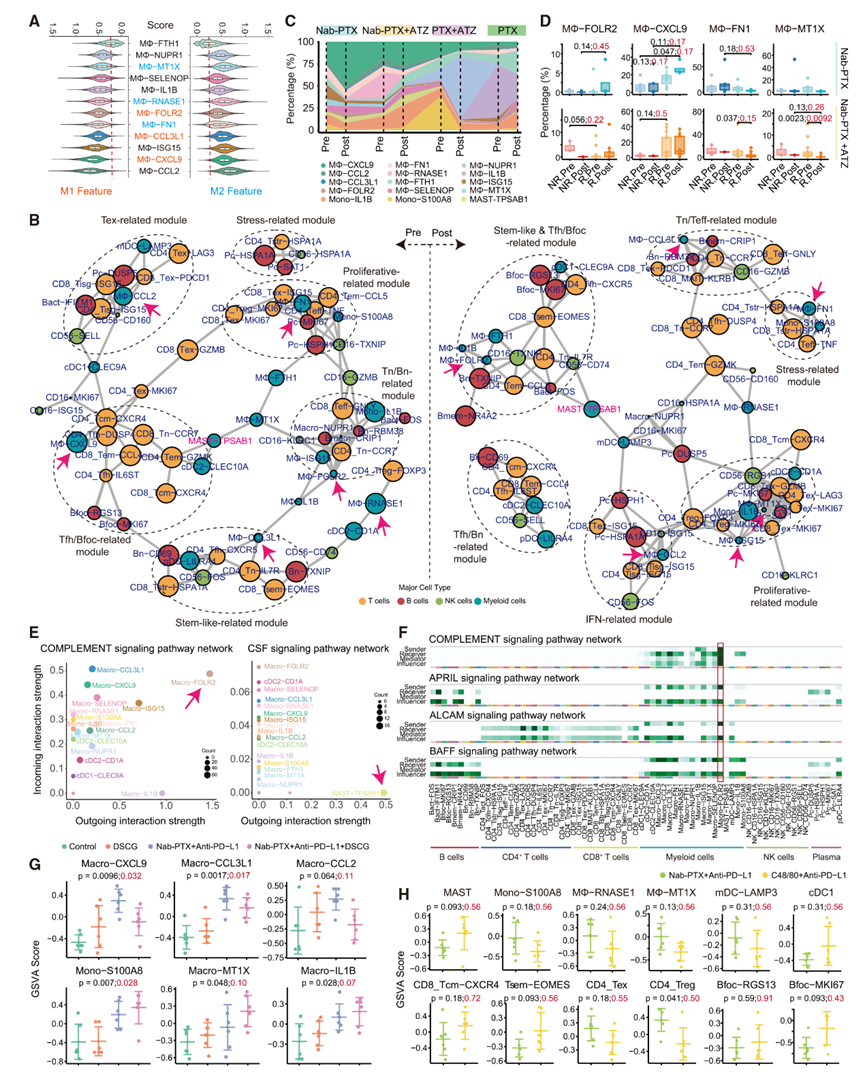
图7:单核细胞/巨噬细胞的特征及其与肥大细胞的联系
11 单核细胞/巨噬细胞对不同治疗的动态反应
在对Nab-PTX+ATZ有反应的肿瘤中,作者观察到免疫抑制性巨噬细胞水平下降,例如macro-FN1、macro-MT1X和macro-RNASE1,同时促炎性亚群如macro-CXCL9、macro-FOLR2和mono-IL1B水平上升(图7C和图7D)。Macro-FOLR2与人类乳腺癌中CD8+ T细胞浸润相关的FOLR2+组织驻留巨噬细胞相似,与治疗前和治疗后的应答性肿瘤中的Tn和Bn聚集在一起(图7B)。此外,macro-FOLR2可能通过补体系统促进其他巨噬细胞,特别是macro-CXCL9和macro-CCL3L1(图7E和图7F)。这些巨噬细胞共同影响T细胞和B细胞的招募和激活,可能通过CXC、主要组织相容性复合体II类(MHC-II)、增殖诱导配体(APRIL)、B细胞激活因子(BAFF)和活化白细胞细胞黏附分子(ALCAM)信号通路。
在应答者中,作者观察到macro-FOLR2和macro-CXCL9水平上升,而mono-IL1B和免疫抑制性巨噬细胞如macro-FN1、macro-MT1X和macro-ISG15在Nab-PTX治疗后下降(图7C和图7D),尽管p值未达到显著性。类似地,PTX也提高了促炎性亚群如macro-FOLR2和macro-CCL3L1的水平,同时减少了包括macro-FN1、macro-MT1X、macro-ISG15和macro-RNASE1在内的免疫抑制性亚群(图7C)。相比之下,PTX+ATZ倾向于减少macro-CXCL9和mono-S100A8,同时增加macro-NUPR1。这些发现表明,化疗和Nab-PTX+ATZ均促进了促炎性巨噬细胞,同时减少了免疫抑制性亚群,营造了有利的免疫环境。
12 肥大细胞通过髓系细胞塑造TNBC的免疫景观
肥大细胞在Nab-PTX+ATZ治疗前后均与Tfh/Bfoc相关模块表现出接近性(图7B)。作者进一步分析了细胞间通信网络,发现肥大细胞对髓系细胞产生了广泛的影响(图7E)。具体而言,肥大细胞主要向巨噬细胞和单核细胞发出信号,可能通过集落刺激因子(CSF)信号通路,以macro-FOLR2为主要受体。肥大细胞还与macro-CXCL9表现出共动态,并与macro-NUPR1和mDC呈正相关,但与macro-RNASE1、macro-MT1X和mono-IL1B呈负相关(图5J),这表明它们在免疫调节中具有多面性作用,尤其是在协调巨噬细胞功能方面。
作者进一步分析了来自小鼠4T1乳腺肿瘤模型的RNA-seq数据,发现与单独使用Nab-PTX和抗PD-L1治疗相比,用DSCG抑制肥大细胞会减少促炎性巨噬细胞,如macro-CXCL9、macro-CCL3L1和macro-CCL2,同时增加免疫抑制性巨噬细胞,如macro-MT1X、macro-IL1B和mono-S100A8(图7G)。这些发现表明肥大细胞参与免疫调节,可能通过增强促炎性巨噬细胞来发挥作用。
13 肥大细胞作为增强免疫检查点阻断(ICB)反应的新兴治疗靶点
基于这些发现,作者进一步探讨了肥大细胞作为一种协同伙伴的潜力,旨在确定其激活是否能够增强免疫检查点阻断(ICB)疗法,特别是PD-L1阻断的疗效。鉴于Nab-PTX联合抗PD-L1抗体的疗效(图6E),作者比较了C48/80或Nab-PTX与抗PD-L1抗体联合在小鼠4T1乳腺肿瘤模型中的效果,发现两种治疗均显著减少了肿瘤体积,其中C48/80联合抗PD-L1抗体治疗的肿瘤体积比Nab-PTX联合抗PD-L1抗体治疗更小,这表明通过激活肥大细胞增强抗PD-L1疗法是一种有前景的治疗策略。
此外,RNA-seq分析显示,在C48/80联合抗PD-L1治疗后,包括Tsem、Tn-IL7R、Tcm、Bfoc和cDC1在内的几种关键免疫细胞亚群水平增加(图7H)。这些有益免疫细胞群体的增加伴随着免疫抑制亚群的减少,如Tex、Treg、mDC、macro-MT1X和mono-S100A8。此外,FACS分析显示,与单独使用C48/80相比,C48/80联合抗PD-L1治疗后CD8+ GZMB+ T细胞和CD19+ CD27+ B细胞水平升高(图5F)。总体而言,这些发现表明,肥大细胞的激活不仅增强了主要抗肿瘤免疫细胞,还重塑了肿瘤微环境,为有效的抗肿瘤治疗创打下基础。
结论:
综上所述,作者揭示了人类TNBC和小鼠模型中肥大细胞通过促进T细胞和B细胞的招募和激活实现的在协调抗肿瘤免疫反应中的关键作用,发现与PD-L1阻断联合激活肥大细胞可减轻TNBC的进展。作者的研究结果提示肥大细胞是增强免疫检查点阻断(ICB)疗法疗效的有前景的辅助手段,这将为未来联合疗法的研究提供新的治疗策略。
实验方法:
小鼠肿瘤模型,scRNA-seq,TCR-seq,细胞培养,WB,免疫荧光,IHC
参考文献:
Zhang Y, Chen H, Mo H, Zhao N, Sun X, Liu B, Gao R, Xu B, Zhang Z, Liu Z, Ma F. Distinct cellular mechanisms underlie chemotherapies and PD-L1 blockade combinations in triple-negative breast cancer. Cancer Cell. 2025 Jan 30:S1535-6108(25)00025-X. doi: 10.1016/j.ccell.2025.01.007. Epub ahead of print. PMID: 39919737.






