工程化间充质干细胞激活血管生成素-1 信号促进糖尿病伤口愈合中的血管生成
血管功能不全与糖尿病足溃疡(DFU)的发病机制和治疗效果有关。虽然间充质干细胞(MSCs)具有治疗糖尿病足溃疡的潜力,但进一步增强促进糖尿病足溃疡伤口血管生成的能力势在必行。本研究发现在糖尿病伤口愈合的整个过程中,血管生成素-1(ANG1)的表达始终处于受损状态。工程化 MSC(MSCANG1)在80%的细胞中表现出强大的绿色荧光蛋白(EGFP)表达,并过表达和分泌ANG1蛋白。MSCANG1显著提高内皮细胞的存活率和小管生成能力,促进功能性血管的建立,改善血管渗漏。在 MSCANG1处理的糖尿病伤口中,蛋白激酶 B(Akt)通路的激活和原癌基因酪氨酸激酶 Src(Src)活性的抑制证实了高效的血管生成过程。MSCANG1处理的糖尿病伤口与间充质干细胞处理的伤口相比,表皮和真皮重建以及皮肤附属物再生的速度明显加快。单纯使用间充质干细胞治疗可促进血管生成和DFU愈合,而使用ANG1对间充质干细胞进行工程改造可为这一治疗过程带来实质性的额外益处。含有 ANG1 的间充质干细胞工程为开发治疗 DFU 的创新策略提供了一条前景广阔的途径。该研究于2025年2月发表在《Stem Cell Research & Therapy》,IF:7.1。
技术路线:
1. 糖尿病伤口愈合过程中的血管生成和 ANG1 水平降低
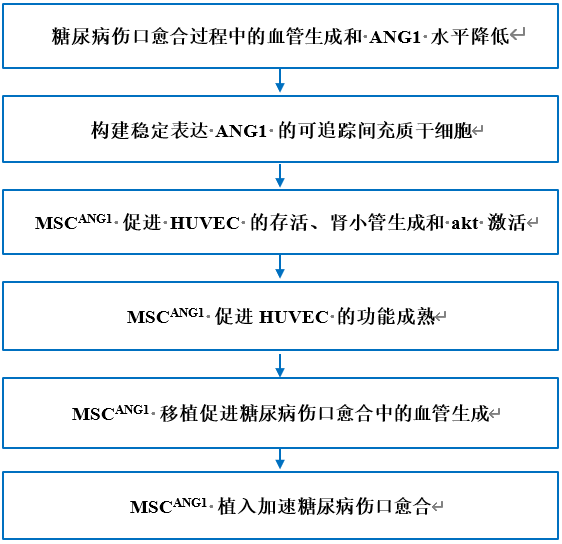
与正常小鼠相比,糖尿病小鼠的伤口愈合速度明显较慢,从相同的初始伤口面积开始,在损伤后 7 天、14 天和 21 天观察到的伤口面积较大就是证明(图 1A 和 B)。与血管生成在 DFU 的发展和结局中起关键作用的认识一致,在损伤后 14 天和 28 天,与正常伤口相比,糖尿病伤口再生组织中含有 CD34 阳性造血细胞和内皮细胞的血管样结构明显较少(图 1C 和 D)。这些观察结果表明,与正常伤口相比,糖尿病伤口的血管生成不足,愈合延迟。
研究人员检测了正常和糖尿病伤口愈合过程中促血管生成因子和抗血管生成因子的时间表达,以确定构建工程化MSC的合适候选因子。与糖尿病伤口愈合过程中血管生成减少的现象相一致的是,成纤维细胞生长因子 2(FGF2)、ANG1、表皮生长因子(EGF)等促血管生成因子的表达水平普遍呈下降趋势、 和转录因子低氧诱导因子-1(HIF1)等促血管生成因子的表达水平降低,而芽胞 RTK 信号转导拮抗剂 2(SPRY2)、凝血酶原蛋白 1(TSP1)、kisspeptin-1(KISS1)和 IV 型胶原 a1 链(COL4A1)等抗血管生成因子的表达水平同时升高。这些血管生成因子在糖尿病伤口愈合中的相互作用非常复杂,因为与正常愈合相比,一些促血管生成因子如基质金属肽酶 9(MMP9)被上调,而抗血管生成因子如基质金属蛋白酶 1 的组织抑制剂(TIMP1)和血小板因子 4(PF4)在糖尿病伤口愈合的后期被下调(图 1E)。鉴于血管生成过程中促血管生成因子和抗血管生成因子之间错综复杂的相互作用,这些因子的表达水平在整个愈合过程中显示出动态和不同的变化。值得注意的是,在整个糖尿病伤口愈合过程中,促血管生成因子ANG1的表达持续减少(图1E),这表明ANG1可能是促进血管生成不足的关键治疗靶点,是构建用于糖尿病伤口愈合的工程化MSC的最佳候选者。
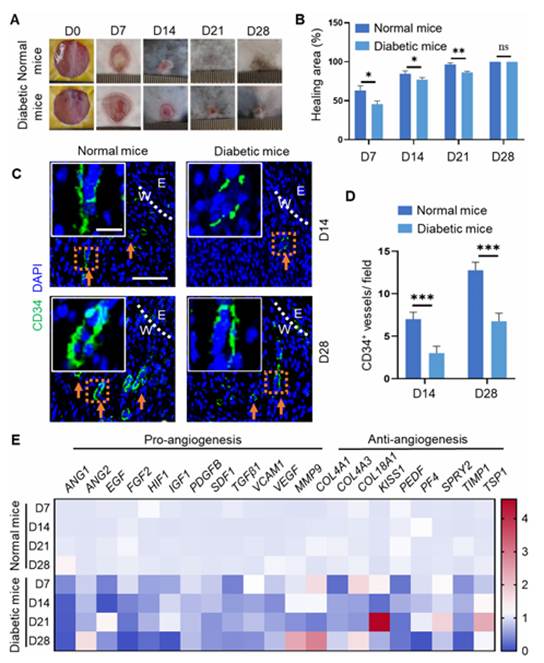
图1. 糖尿病伤口愈合过程中 ANG1 信号传导和血管生成受阻
2. 构建稳定表达 ANG1 的可追踪间充质干细胞
设计并构建一种慢病毒质粒,其中含有通过 t2A 连接子连接的 ANG1 和 GFP 基因(图 2A),并对慢病毒感染的间充质干细胞(MSCANG1)进行这两种外源蛋白稳定表达的评估。GFP 免疫染色表明,MSCANG1 的 GFP 荧光水平与感染了 GFP 慢病毒(MSCGFP)的间充质细胞相当(图 2B 和 C)。在 MSCANG1 和 MSCGFP 群体中,表达 GFP 的细胞平均比例约为 80%(图 2B 和 C),这表明工程化MSC能强有力地表达外源基因,适合进行后续实验。WB 分析显示,与 MSCGFP 细胞相比,MSCANG1 细胞裂解物和 条件培养基(CM) 中 ANG1 的表达水平大幅提高(图 2F),证实了血管生成因子 ANG1 的成功表达和分泌。工程MSCs 的CM中 ANG1 的含量呈时间性增加,进一步证实 ANG1 蛋白是从 MSCANG1 细胞中释放出来并逐渐在 CM 中积累(图 2G)。
随后研究了ANG1对糖尿病伤口移植工程化MSC存活的影响。通过使用 GFP 免疫染色追踪移植细胞观察到 MSCANG1 在移植到糖尿病伤口 7 天后表现出与 MSCGFP 细胞相似的存活模式(图 2D 和 E)。这表明间充质干细胞中 ANG1 的产生不会影响间充质干细胞的体内存活。
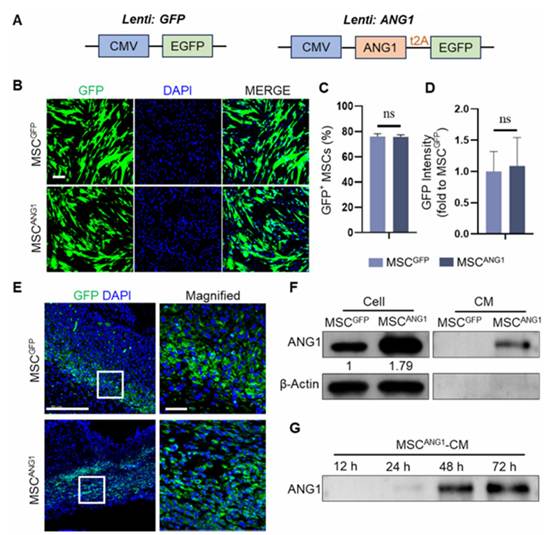
图2. 构建稳定表达 ANG1(MSCANG1)的工程化MSC并确定其特征
3. MSCANG1 促进 HUVEC 的存活、肾小管生成和 akt 激活
考虑到间充质干细胞主要通过旁分泌机制发挥治疗作用,作者用工程化MSC的CM处理HUVEC,评估MSCANG1对内皮细胞的影响。与对照组相比,用 MSCGFP-CM 处理的 HUVEC 的细胞数明显增加(图 3A),Annexin V 和 PI 阳性的凋亡细胞减少(图 3B 和 C),这表明 MSCGFP 对 HUVEC 的存活有适度的保护作用。此外,与 MSCGFP-CM 相比,MSCANG1-CM 进一步提高HUVECs 的存活率,强调了 ANG1 和间充质干细胞对内皮细胞存活的协同作用(图 3A-C)。这种效应通过钙黄绿素-AM和PI染色得到证实。与 Ctrl 或 MSCGFP-CM 处理的 HUVECs 相比,MSCANG1-CM 处理的 HUVECs 表现出明显更多的钙素-AM 染色活细胞和更少的 PI 染色死细胞(图 3D-F)。ANG1 蛋白的应用对 HUVECs 的存活产生类似的保护作用(图 S2),进一步突出 ANG1 的保护作用。内皮细胞具有在体外形成毛细血管样结构的能力,这反映了它们在体内的血管生成潜能。同样,用 MSCGFP-CM 处理可增强 HUVECs 中毛细血管样结构的形成,而用 MSCANG1-CM 处理可进一步显著增强这种效应(图 3G 和 H)。
Akt 通路与内皮细胞的存活和血管生成能力密切相关。通过 WB 分析观察到与 Ctrl 和 MSCGFP-CM 处理的 HUVEC 相比,MSCANG1-CM 处理的 HUVEC 中内皮细胞上 ANG1 的特异性受体 Tie2 的磷酸化和活化增加(图 3I 和 J)。此外,在 MSCANG1-CM 处理的 HUVEC 中观察到 Akt 磷酸化水平升高,这证明 MSCANG1 通过 Tie2 显著增强 Akt 的活化(图 3I 和 J)。值得注意的是,用 MSCGFP-CM 处理的 HUVEC 也表现出 Tie2 和 Akt 蛋白的轻微活化,这与 MSCGFP-CM 适度改善内皮细胞存活和血管生成能力的观察结果一致。
图3. MSCANG1促进 HUVECs 的存活、肾小管生成和 Akt 活化
4. MSCANG1 促进 HUVEC 的功能成熟
ANG1在血管生成过程中对血管稳定和结构完整性起着关键作用。为评估工程化MSC对内皮细胞完整性的影响,用工程化MSC的CM培养HUVECs,并通过量化穿透细胞的荧光染料Dextran-FITC来评估HUVECs单层的通透性(图4A)。值得注意的是,与 Ctrl 和 MSCGFP-CM 培养的 HUVECs 相比,与 MSCANG1-CM 培养的 HUVECs 的 Dextran-FITC 穿透性明显降低(图 4B),这表明 ANG1 能有效减少内皮屏障渗漏,从而促进血管完整性。
VE-Cadherin是内皮细胞间粘附连接的关键成分,负责钙依赖性细胞粘附,在维持血管完整性方面起着关键作用。观察结果表明,与 Ctrl 和 MSCGFP-CM 处理的 HUVECs 相比,MSCANG1-CM 培养后 HUVECs 细胞边界的 VE-cadherin 表达上调(图 4C 和 D)。WB 分析还表明,在这些经 MSCANG-CM 处理的 HUVEC 中,VE-cadherin 的表达明显增加(图 4E 和 F)。此外,Src的磷酸化与细胞连接处 VE-cadherin稳定性降低有关。与 Ctrl 和 MSCGFP-CM 处理相比,MSCANG1-CM 处理导致 HUVECs 中磷酸化 Src 水平降低(图 4E 和 F)。
先前的研究结果表明,naive 间充质干细胞具有一定的血管生成潜能,与此相一致,MSCGFP-CM 处理也适度改善 HUVECs 的通透性、增加 VE-cadherin表达并降低了 Src 磷酸化(图 4A-F)。总之,间充质干细胞中外源性 ANG1 的表达可通过促进内皮细胞的功能性成熟进一步提高其血管生成能力。
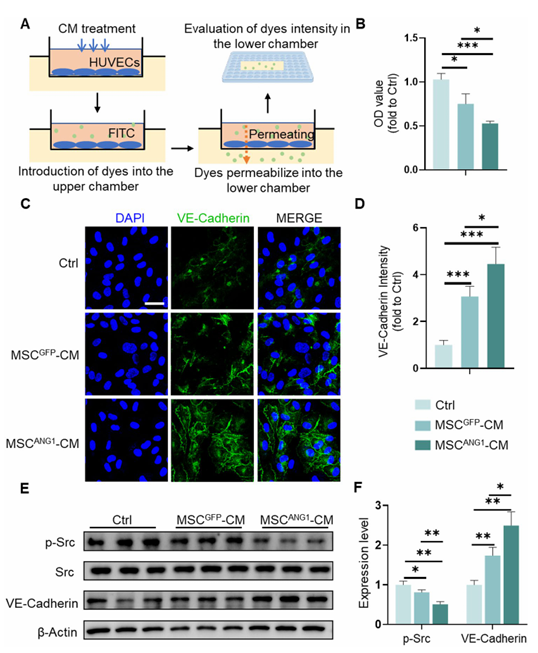
图4. MSCANG1促进血管粘连蛋白的表达和血管完整性,并抑制 Src的激活
5. MSCANG1 移植促进糖尿病伤口愈合中的血管生成
移植各种工程化MSC 14天后,通过检测血管的存在和成熟情况,评估糖尿病伤口愈合过程中的血管生成情况。CD34和α-SMA(一种周细胞标记物)的双重免疫染色显示,与对照组和移植MSCGFP的伤口组织相比,移植MSCANG1的伤口组织内层的CD34+细胞和外层的α-SMA+细胞的血管样结构明显增加(图5A和B)。WB 分析进一步证实,在 MSCANG1 移植的糖尿病伤口再生组织中,CD34 表达升高(图 5C 和 D)。
伤口愈合过程中涉及的多种分子信号通路最终都汇聚到 Akt 的激活上,在糖尿病伤口愈合中普遍观察到 Akt 激活受损。在本研究中,WB 分析显示,在 MSCANG1 移植的糖尿病伤口中,Tie2 受体和下游 Akt 通路显著磷酸化(图 5E 和 F),表明 ANG1/Tie2/Akt 通路的激活是 MSCANG1 促进糖尿病伤口愈合的血管生成机制的基础。
为评估再生伤口组织中血管的完整性和成熟度,研究人员检测了内皮间连接蛋白 VE-Cadherin 的表达。CD34 和 VE-Cadherin 免疫染色显示,与对照组和 MSCGFP 处理的伤口相比,MSCANG1 处理的伤口显示出更多的 CD34 和 VE-Cadherin 阳性血管样结构(图 6A 和 B)。WB 分析进一步验证了 MSCANG1 处理的伤口中 VE-Cadherin 表达的升高(图 6C 和 D)。此外,WB 分析显示,与对照组和 MSCGFP 处理的伤口相比,MSCANG1 处理的伤口中 Src 表达减少(图 6C 和 D)。这些发现表明,MSCANG1 能有效抑制 Src 活性,从而促进其下游效应物 VE-Cadherin 的表达。
综上所述,这些结果表明,MSCANG1 可通过与 Tie2 受体结合,显著激活 Akt 通路并抑制 Src 活性,从而在糖尿病伤口愈合过程中促进血管生成并改善血管完整性。
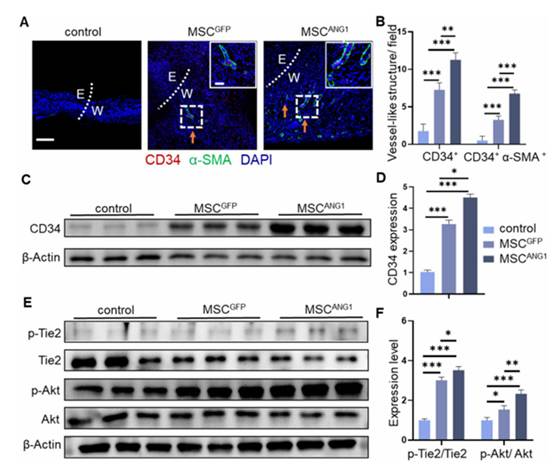
图5. MSCANG1促进血管生成并激活糖尿病伤口愈合中的 Tie2/Akt 通路
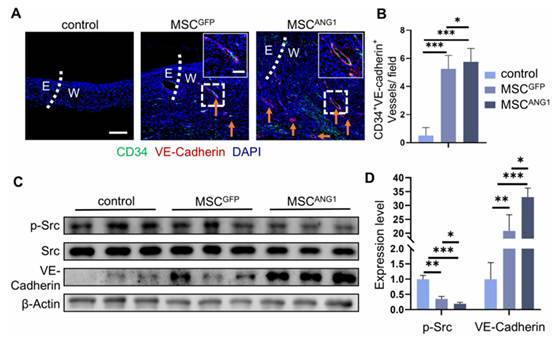
图6. MSCANG1促进糖尿病伤口愈合中 VE-Cadherin 的表达并抑制 Src 的激活
6. MSCANG1 植入加速糖尿病伤口愈合
作者接着研究 MSCANG1 接种是否能促进糖尿病伤口愈合的过程。与观察到的 MSCANG1 促进伤口组织血管生成的情况一致,在移植后 7、14 和 21 天,与对照组或 MSCGFP 相比,移植 MSCANG1 的伤口面积明显较小(图 7A 和 B)。这些发现表明,工程化的 MSCANG1 能明显加快伤口愈合。
上皮恢复对重建伤口屏障至关重要,这是伤口愈合过程中的一个关键环节。利用血色素和伊红(HE)染色以及上皮标记物 K14 的免疫染色观察到,与对照组和 MSCGFP 移植的伤口相比,移植 MSCANG1 的糖尿病伤口在移植后 14 天显示出最窄的上皮间隙(EG)(图 7C、D 和 F)。移植后第 28 天,所有伤口都被上皮覆盖,与对照组相比,移植 MSCGFP 和 MSCANG1 的伤口真皮厚度(THK)显著增加(图 7C、D 和 G)。值得注意的是,接种 MSCGFP 和 MSCANG1 的伤口真皮厚度没有明显差异(图 7C 和 G),这表明 MSCANG1 处理不会诱导真皮成纤维细胞过度增殖。
血管生成在皮肤附属物的功能再生中起着关键作用。通过对再生毛囊的标记物 K14 和 K17 进行双重免疫染色观察到,在 MSCANG1 移植后 14 天和 28 天,糖尿病伤口过渡区的 K14 和 K17 定位于毛囊(图 7E 和 H)。总之,这些研究结果表明,MSCANG1 可通过促进表皮和真皮重建以及促进皮肤附属物再生来加速糖尿病伤口愈合。
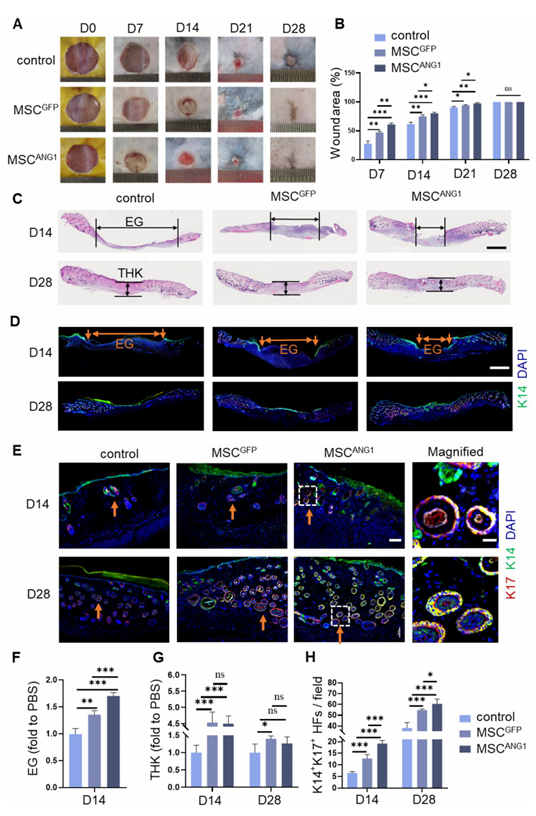
图7. MSCANG1治疗促进糖尿病伤口愈合过程
结论
综上所述,本研究表明,在糖尿病伤口愈合过程中,ANG1明显缺乏。MSCANG1 对内皮细胞的存活、迁移和功能性紧密连接的形成有显著影响。此外, MSCANG1 促进血管生成,其间Akt 的激活和 Src 活性的抑制起着关键作用。间充质干细胞与 ANG1 的工程设计为治疗结果提供实质性的协同优势,并为开发治疗 DFU 的创新策略提供一条前景广阔的途径。
实验方法
细胞培养,细胞转染,细胞活力评估,管形成实验,体外渗透性试验,正常和糖尿病创面模型的制备,动物处理和伤口面积评估,免疫组化,qRT-PCR,Western blot
参考文献
Deng Q, Du F, Pan S, Xia Y, Zhu Y, Zhang J, Li C, Yu S. Activation of angiopoietin-1 signaling with engineering mesenchymal stem cells promoted efficient angiogenesis in diabetic wound healing. Stem Cell Res Ther. 2025 Feb 21;16(1):75. doi: 10.1186/s13287-025-04207-7. PMID: 39985096; PMCID: PMC11846275.






