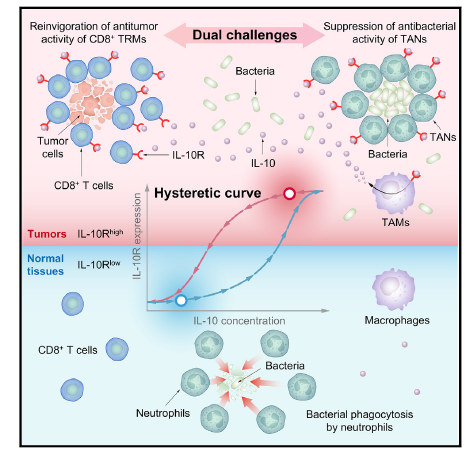
利用IL-10R滞后性进行吞噬逃避和肿瘤免疫恢复的细菌免疫疗法
细菌能够穿透肿瘤组织,并在肿瘤微环境中引发免疫反应。IL-10是一种免疫调节细胞因子,能够抑制免疫反应,而IL-10R是其受体。在肿瘤微环境中,IL-10的水平通常较高,可能与抗肿瘤免疫反应的抑制有关。作者的研究聚焦于细菌免疫疗法在癌症治疗中的潜力,特别是针对实体瘤微环境中细菌如何逃避免疫系统吞噬并激活抗肿瘤免疫反应的机制。通过构建一种工程化沙门氏菌(DB1),利用其在肿瘤组织中的选择性增殖特性,揭示了IL-10R表达的滞后性在其中的关键作用。实验中,DB1在小鼠模型中显著抑制了多种肿瘤的生长,提高了生存率,并且激活了肿瘤内CD8+ T细胞,尤其是肿瘤驻留记忆(TRM)CD8+ T细胞的扩增和活性。研究发现,IL-10能够诱导IL-10R的表达,并形成正反馈环路,使得肿瘤微环境中的免疫细胞维持高水平的IL-10R表达,从而对IL-10产生持续响应。此外,IL-10还能够抑制肿瘤相关中性粒细胞(TANs)的吞噬作用,保护细菌免受免疫系统清除。总之,作者的这一发现不仅为理解细菌免疫疗法的双重挑战提供了新的视角,还为开发新型癌症治疗策略提供了理论基础,有望通过调节IL-10R的表达来增强抗肿瘤免疫反应。该研究于2025年2月发表在《Cell》,IF 45.6分。
技术路线:
主要研究结果:
1 工程菌在实体瘤中选择性增殖,以防止肿瘤生长、复发和转移
作者构建了一株鼠伤寒沙门氏菌(Salmonella enterica serovar Typhimurium)菌株,命名为设计菌株1(简称DB1),其包含一个基因回路,用于在有氧条件下抑制其生长,从而确保其在正常器官中的增殖受到限制。该菌的一个必需基因asd被置于氧抑制型启动子Phypo后。为了增强其穿透肿瘤的能力,作者将单核细胞增生李斯特菌(Listeria monocytogenes)的溶血素O(LLO)基因置于由细胞内信号诱导的启动子PsseA后(图1A)。作为对照,作者构建了DB2,它与DB1相同,只是将DB1中的Phypo启动子替换为天然的asd启动子。与预期结果相符,这种基因回路导致DB1在有氧条件下出现显著的细胞裂解(图1B)。
通过静脉注射,作者将107个DB1细胞注入携带MB49膀胱肿瘤的C57BL/6小鼠体内,当肿瘤体积达到约100 mm³时进行注射。作者观察到,在注射后24小时内,DB1细胞在实体瘤的内部区域形成了许多菌落(图1C,红色)。随后,肿瘤内的DB1数量在最初的12小时内以大约0.4 h-1的速率呈指数增长,并在24小时达到饱和(图1D)。
接下来,作者在同种异体肿瘤小鼠模型中评估了DB1的治疗效果。静脉注射DB1显著抑制了皮下MB49和B16-F10肿瘤的生长,以及由葡聚糖硫酸钠(DSS)/偶氮甲烷(AOM)诱导的原位结肠肿瘤的生长,而用PBS处理的小鼠肿瘤则稳定发展。值得注意的是,所有接受DB1治疗的小鼠在整个观察期内都存活了下来(图1E和1G)。
有趣的是,当通过皮下注射再次用B16-F10细胞挑战时,接受DB1治疗的B16-F10黑色素瘤小鼠表现出对肿瘤生长的抵抗力(图1H),而与之年龄和性别相匹配的未接受治疗的小鼠在1周内就发展出黑色素瘤。相比之下,当通过皮下注射MB49时,接受DB1治疗的小鼠和未接受治疗的小鼠以相似的速度发展出肿瘤,生长没有显著差异(图1I)。此外,接受DB1治疗的B16-F10黑色素瘤小鼠对B16-F10细胞通过静脉注射进行的实验性肺转移也表现出抵抗力(图1J)。然而,在未接受治疗的小鼠中,肺转移导致肺重量增加(图1J)。这些发现表明,DB1在治疗的小鼠中诱导了抗原特异性的免疫记忆,从而防止了肿瘤的复发和转移。
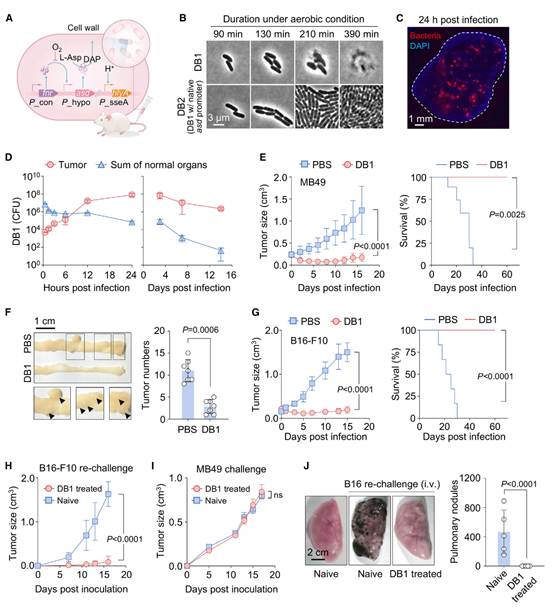
图1:DB1在实体瘤中选择性增殖并抑制其生长和复发
2 DB1治疗通过IL-10信号通路诱导肿瘤内预先存在的CD8+ T细胞的局部再激活和扩增
为了剖析治疗性免疫反应,作者生成了减毒的DB7(ΔmsbB)和DB8(ΔlppAB)突变株,作为DB1治疗效果的阴性对照。msbB基因编码脂质A乙酰转移酶,而lppA和lppB基因分别编码Braun脂蛋白,在DB7和DB8中分别被敲除。随后,作者对MB49肿瘤中的免疫特征进行了表征,重点关注CD4+和CD8+ T细胞、B细胞、巨噬细胞、中性粒细胞和树突状细胞(DCs)。
作者观察到,通过抗CD8抗体耗竭CD8+ T细胞会消除DB1的抗肿瘤效果,表现为肿瘤生长增加,而CD4+ T细胞的耗竭则无此影响,这证实了CD8+ T细胞在DB1介导的肿瘤治疗中的关键作用(图2A)。进一步在DB1治疗前后进行了单细胞RNA测序(scRNA-seq),以检查肿瘤浸润性CD8+ T细胞的激活和细胞毒性潜力。DB1治疗增强了CD8+ T细胞的激活,表现为与对照组相比更高的激活评分(图2B和2C),与CD8+ T细胞激活和细胞毒性相关的差异表达基因在图2D中突出显示。这些结果表明,DB1的治疗效果依赖于增强肿瘤浸润性CD8+ T细胞的细胞毒性。
经典的适应性免疫激活过程通常需要4-7天才能达到效应功能的起始阶段。作者使用鞘氨醇-1-磷酸受体激动剂FTY720抑制T细胞从淋巴器官中逸出。结果显示,FTY720治疗有效地诱导了血液中T细胞的耗竭,但并未影响DB1的抗肿瘤效果(图2E)。这些结果表明,DB1的效果并不依赖于外周和淋巴器官中循环T细胞的补充,而TME中预先存在的CD8+ T细胞提供了主要的再激活能力。
肿瘤驻留记忆(TRM)CD8+ T细胞已被鉴定为CD8+肿瘤浸润性淋巴细胞(TILs)的一个独特亚群,它们驻留在TME中,能够对其特异性抗原产生快速免疫反应。作者假设DB1治疗主要增强TRM CD8+ T细胞,使其成为实体瘤中强大的癌细胞杀手。(本研究中提到的类似TRM的CD8+ T细胞是CD62L⁻CD69+ CD8+ T细胞)。作者发现,在皮下MB49肿瘤发展过程中,肿瘤内CD8+ T细胞群体中类似TRM的CD8+ T细胞的比例逐渐增加,并在肿瘤接种后第14天达到约70%(图2F)。在接受DB1治疗后,类似TRM的CD8+ T细胞的比例在接下来的2周内持续上升,接近100%,并且与PBS处理相比,产生IFN-γ的类似TRM的CD8+ T细胞的频率增加了约3.5倍(图2G)。此外,作者还证明了DB1治疗特异性地激活了B16-OVA肿瘤中肿瘤内卵清蛋白(OVA)特异性的类似TRM的CD8+ T细胞(图2H)。这些数据共同表明,DB1持续促进类似TRM的CD8+ T细胞的扩增和激活,这是限制它们所驻留肿瘤生长的主要因素。
作者观察到,DB1治疗诱导了PD-1+TIM-3+或PD-1hi类似TRM的CD8+ T细胞的显著扩增,这些细胞在感染后第3天达到峰值。随后,这些细胞的比例在接下来的几天内逐渐下降,形成了一个独特的钟形动态模式(图2I和S2I)。这些发现表明,DB1治疗不仅维持了激活,还诱导了PD-1+TIM-3+或PD-1hi类似TRM的CD8+ T细胞的扩增。中和IL-10完全消除了DB1在MB49和B16-F10肿瘤中诱导的抗肿瘤效果(图3A和3B)。与之相符的是,肿瘤内IFN-γ+ CD8+ T细胞的数量大幅减少(图3C)。
此外,对于PD-1+TIM-3+或PD-1hi类似TRM的CD8+ T细胞,IL-10中和完全消除了DB1诱导的扩增、细胞毒性效应功能以及在感染后第3天增强的Ki67表达(图3D-3G)。作者进一步将从MB49肿瘤携带小鼠中分离的类似TRM的CD8+ T细胞在体外与IL-10刺激或不刺激进行培养(图3H)。结果显示,IL-10直接扩增了类似TRM的CD8+ T细胞(图3I,左侧),包括PD-1+TIM-3+类似TRM的CD8+ T细胞(图3I,右侧)。这种IL-10诱导的扩增效应可以通过抗IL-10R单克隆抗体逆转(图3I)。对于类似TRM的CD8+ T细胞,这种扩增效应仅在体外刺激的最初3天内持续,之后无论是否存在IL-10,细胞数量均下降(图3I)。这可能是由于它们在体外的存活能力较低。这些结果表明,DB1的再激活和扩增效应主要涉及IL-10信号通路。
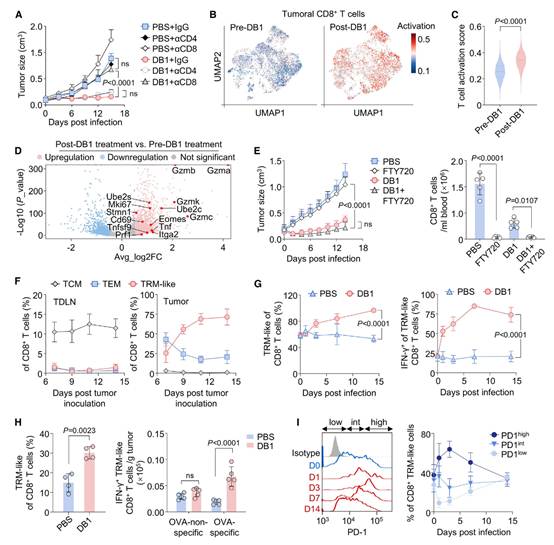
图2:DB1激活类似TRM的CD8+ T细胞并扩增PD-1+TIM-3+类似TRM细胞
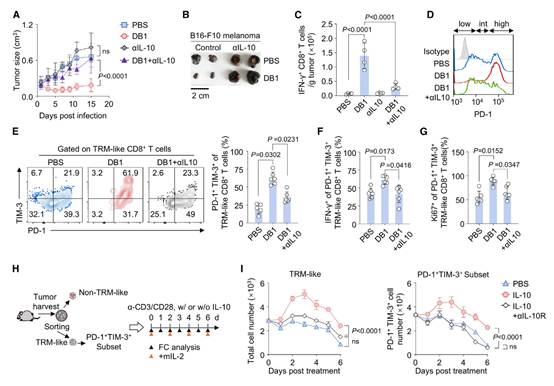
图3:DB1通过IL-10重新激活CD8+肿瘤浸润性淋巴细胞以抑制肿瘤生长
3 肿瘤内CD8+ T细胞上的IL-10R表达表现出滞后环
在DB1治疗之前,肿瘤中的IL-10水平比血液中的高10倍,而脾脏中的IL-10几乎无法检测到(图4A)。在DB1给药后,肿瘤内的IL-10水平大约增加了10倍,在24小时内达到3 ng/g,然后逐渐下降,并在3天后稳定在1.5 ng/g(图4B)。相比之下,血液中的IL-10浓度始终比肿瘤中的低10倍以上(图4B),这意味着IL-10是在肿瘤局部产生的。此外,作者观察到IL-10选择性地增加了肿瘤中IFN-γ+ CD8+ T细胞的百分比,但在脾脏中没有这种效果(图4C)。
IL-10受体(IL-10R)是IL-10的唯一受体,对于细胞毒性T淋巴细胞(CTLs)的激活至关重要。作者接下来评估了从肿瘤携带小鼠的肿瘤和各种内脏器官中分离的CD8+ T细胞上的IL-10R表达。代表性流式细胞术数据显示,在DB1治疗之前,肿瘤中的CD8+ T细胞高度表达IL-10Rα亚单位(IL-10RA),而其他器官中的CD8+ T细胞则不表达(图4D和4E)。
鉴于肿瘤中IL-10水平的升高以及肿瘤浸润性CD8+ T细胞上IL-10R的高表达,这种模式在脾脏中并未观察到(图4A和4D),作者假设IL-10可能有助于TME内CD8+ T细胞上IL-10R表达的上调(图4F)。为了验证这一假设,作者将原代CD8+ T细胞与不同浓度的IL-10一起孵育。IL-10以剂量依赖的方式诱导Il10ra和Il10rb的表达,阈值浓度约为3 ng/ml(图4G)。染色质免疫沉淀(ChIP)分析显示,IL-10激活的STAT3直接结合到CD8+ T细胞中这两个基因的启动子上(图4H)。这些结果表明,IL-10/IL-10R/STAT3信号轴形成了一个正反馈环,以增强Il10ra和Il10rb的表达。
然而,在DB1治疗之前,肿瘤中的基础IL-10浓度仅为约0.3 ng/g(图4A),即比体外观察到的阈值低10倍以上(图4G),而大多数肿瘤内CD8+ T细胞却表达了高水平的IL-10RA(图4E)和IL-10RB。作者想知道如此低水平的IL-10是否足以诱导IL-10RA和IL-10RB的表达,尽管体内和体外的阈值不一定相同。为了解释在肿瘤中低水平IL-10刺激下IL-10R的高表达,另一种可能是IL-10R表达的正反馈介导的滞后现象。在这种情况下,滞后意味着细胞群体的活性不仅取决于当前的信号水平,还取决于细胞之前经历过的信号水平。作者发现如果IL-10R和STAT3之间的正反馈足够强,细胞群体的平均IL-10R mRNA表达水平将随着IL-10浓度的变化呈现出滞后环(图4I,左)。与模型模拟一致(图4I,左),重新刺激的原代CD8+ T细胞中Il10ra的平均表达(红色线条和圆形;图4I,右)显著高于直接用相同浓度IL-10刺激的细胞(蓝色线条和菱形;图4I,右)。对于Il10rb的表达也观察到了类似的滞后效应(图S4H)。这些结果表明,短暂暴露于高浓度IL-10可以诱导持续的细胞反应。重要的是,高IL-10RA和低IL-10RA表达的细胞呈现双峰分布(图4J),表现出滞后行为,其中一部分细胞在暴露于一定阈值的IL-10后可以显著上调IL-10RA,并在此后保持这种高表达。
这些结果表明,TME中的IL-10水平可能在肿瘤进展过程中上升。事实上,在B16-F10黑色素瘤模型中,IL-10水平在肿瘤形成早期(约5天)增加,达到峰值后下降,并在之后稳定在一个相对较低的水平(图4K)。这些发现有助于解释肿瘤中CD8+ T细胞与其他器官中CD8+ T细胞上观察到的不同IL-10R表达特征(图4D、4E)。
为了将小鼠模型中肿瘤浸润性CD8+ T细胞上高IL-10R表达的发现扩展到人类肿瘤,作者使用组织芯片分析了多种人类肿瘤类型的CD8+ T细胞。作者发现,在27种肿瘤类型中,有22种在肿瘤组织中IL-10Rhi CD8+ T细胞的频率高于正常组织(图5A)。图5B展示了一个代表性图像,显示了CD8+ T细胞上的IL-10RA表达,并清晰标注了相应的细胞。为了进一步证实这一点,作者从肝癌或膀胱癌患者中分离出CD8+ T细胞,并发现肿瘤内CD8+ T细胞中IL10RA的表达水平显著高于从正常邻近组织或外周血中分离的CD8+ T细胞(图5C)。正如预期的那样,人类IL-10能够高效诱导这些癌症患者肿瘤内CD8+ T细胞中细胞毒性基因的表达,但它未能激活从外周血或正常邻近组织中分离的CD8+ T细胞(图5D)。显然,预先存在的IL-10R可能是人类肿瘤内CTLs的一个普遍特征,而研究中发现的滞后介导的IL-10R维持可能是其潜在机制。
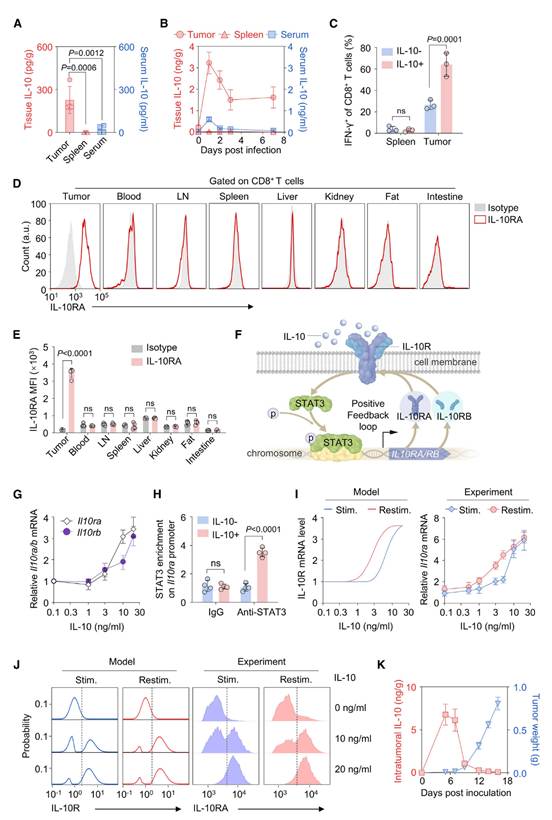
图4:CD8+ T细胞中IL-10R表达的滞后现象
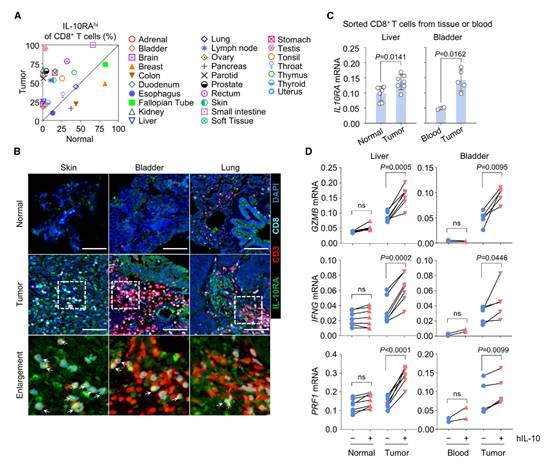
图5:各种人类肿瘤中CD8+ T细胞上高IL-10R表达表明内在IL-10R滞后的普遍机制
4 细菌增强IL-10Rhi肿瘤相关巨噬细胞产生IL-10
接下来,作者试图分析DB1给药后TME中IL-10的细胞来源。为了进一步验证TAMs和TANs的作用,作者分别使用抗CSF1R(CD115)和抗Gr-1抗体在小鼠中耗竭巨噬细胞和中性粒细胞。使用抗CSF1R抗体耗竭巨噬细胞显著削弱了DB1在MB49肿瘤模型(图6A)和B16黑色素瘤模型中的抗肿瘤效果。通过使用Toll样受体4(Tlr4)缺陷的骨髓(BM)嵌合小鼠模型(其中髓系细胞被Tlr4⁻/⁻细胞替代),作者发现DB1无法刺激TAMs产生IL-10(图6B),并且在缺乏TLR4的情况下失去了抗肿瘤效果(图6C)。相比之下,DB1在Tlr2⁻/⁻ BM嵌合肿瘤模型小鼠中保留了其抗肿瘤效果(图6D)。此前有报道称,IL-10R部分参与了巨噬细胞中IL-10的产生。作者随后通过体外IL-10RA阻断分析了巨噬细胞的IL-10分泌情况。作者发现,如果阻断它们的IL-10R,DB1诱导的巨噬细胞产生IL-10的能力将显著受损(图6E),这表明DB1诱导的IL-10分泌不仅依赖于TLR4的接触,还依赖于IL-10R的存在。其潜在机制需要进一步研究。因此,推测IL-10R的滞后现象也适用于TAMs,以确保TME中IL-10R的预先存在,从而使TAMs在DB1穿透实体瘤时能够产生IL-10。在TAMs和小鼠巨噬细胞系RAW264.7中观察到了Il10ra和Il10rb的滞后现象(图6F)。综上所述,这些发现表明TAMs在介导DB1的抗肿瘤效果中发挥着关键作用,并通过TLR4和IL-10R介导的信号通路促进TME中有益的IL-10产生。同样,使用组织芯片分析多种人类肿瘤类型中TAMs上的IL-10RA水平,发现27种肿瘤类型中有24种在肿瘤组织中IL-10Rhi巨噬细胞的频率高于正常组织(图6G),这表明在临床实践中,细菌可以利用实体瘤中的IL-10Rhi巨噬细胞产生IL-10,从而激活人类的IL-10Rhi CD8+ T细胞。
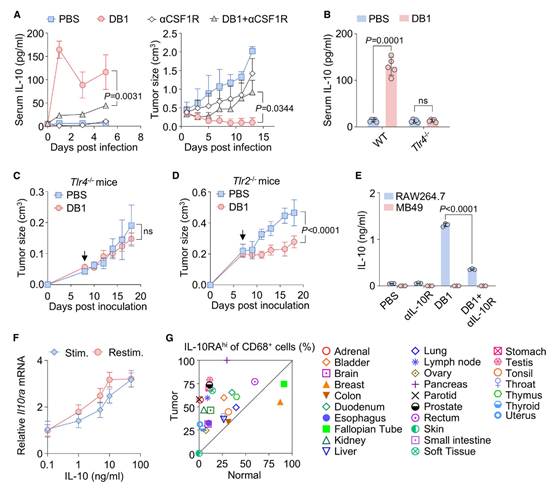
图6:DB1刺激的TAMs产生IL-10以及TAMs中IL-10R的滞后现象
5 IL-10R滞后现象促进细菌逃避TAN的吞噬作用
为了研究肿瘤内中性粒细胞与DB1之间的相互作用,作者对DB1和中性粒细胞的空间分布进行了可视化。此前报道的中性粒细胞的环状结构明显环绕着定殖在肿瘤核心的DB1细胞(图7A,左侧)。然而,这种环状结构形成背后的机制仍然不明。几项先前的研究报告称,IL-10的产生会损害中性粒细胞向细菌感染组织的募集。作者假设由DB1刺激产生的IL-10降低了中性粒细胞的迁移能力,从而使DB1能够逃避中性粒细胞的吞噬作用,并促进肿瘤中环状结构的形成。与预期相符,当作者对小鼠进行IL-10中和时,环状结构消失了(图7A,右侧)。通过体外中性粒细胞迁移实验进一步验证了这一假设,在该实验中,当中性粒细胞向DB1迁移时,向培养基中添加IL-10会显著减少中性粒细胞的迁移,而这种效应可以通过IL-10R抗体消除(图7B),这表明TANs上预先存在的IL-10R对于DB1在TME中的逃避至关重要。
另外,TANs中也存在IL-10R滞后现象(图7C)。作者进一步使用组织芯片分析了来自不同类型人类肿瘤的肿瘤内中性粒细胞上的IL-10RA水平,发现16种肿瘤类型中有11种在肿瘤组织中IL-10RAhi中性粒细胞的频率高于其正常对应组织(图7D),这表明细菌可以利用实体瘤中的IL-10Rhi中性粒细胞,通过IL-10/IL-10R信号通路逃避它们的吞噬作用。
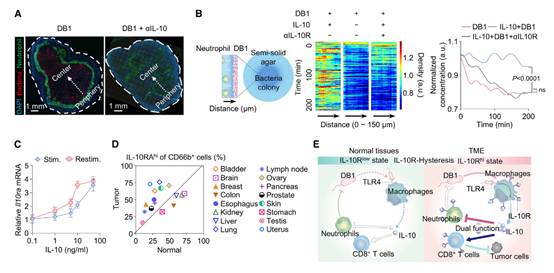
图7:TANs的IL-10R滞后现象及中性粒细胞环的形成
结论:
综上所述,本研究揭示了DB1通过利用IL-10R的滞后性,既能够逃避免疫系统的清除,又能够激活抗肿瘤免疫反应。这种机制为细菌免疫疗法提供了一种新的理论基础,推进了对TME内复杂相互作用的理解。
实验方法:
小鼠肿瘤模型,流式,scRNA-seq,ATAC-seq,CUT&Tag-seq,细胞培养,ELISA,CTL,qPCR,ChIP-qPCR,免疫荧光
参考文献:
Chang Z, Guo X, Li X, Wang Y, Zang Z, Pei S, Lu W, Li Y, Huang JD, Xiao Y, Liu C. Bacterial immunotherapy leveraging IL-10R hysteresis for both phagocytosis evasion and tumor immunity revitalization. Cell. 2025 Feb 20:S0092-8674(25)00158-8. doi: 10.1016/j.cell.2025.02.002. Epub ahead of print. PMID: 40037354.






