KLF5-糖尿病伤口愈合的靶点
脂肪来源干细胞(ADSCs)已被证明可以通过促进新血管生成来加速糖尿病性伤口愈合,尽管其背后的机制尚未完全了解。本研究旨在探讨ADSCs是否通过影响内皮祖细胞(EPCs)的功能来增强糖尿病性伤口愈合。我们构建了一个包含75个基因的新血管生成相关特征签名(NRS)。GO和KEGG分析揭示,NRS主要参与血管发育和受体-配体活性。确定了七个枢纽基因(CD34、CXCL12、FGF7、FGF18、FGF1、TEK、KIT)并进行验证。在糖尿病小鼠模型中,ADSCs中的CXCL12敲减降低了它们促进伤口愈合和血管新生的能力。与正常组织相比,糖尿病溃疡患者和糖尿病小鼠伤口组织的KLF5表达较低,而ADSCs治疗显著增加了糖尿病小鼠伤口中的KLF5表达。双荧光素酶报告分析确认KLF5是CXCL12的上游转录因子。此外,ADSCs中敲减KLF5损害了它们对糖尿病伤口愈合的治疗效果。在体外,添加外源性CXCL12重组蛋白在ADSCs中沉默KLF5后,在高糖环境下恢复了EPCs的增殖、迁移和血管生成能力。我们的发现强调了KLF5在增强ADSCs中CXCL12转录的关键作用,从而促进EPC介导的血管新生并改善糖尿病伤口愈合。此外,KLF5作为一个有前景的治疗靶点,有望加速糖尿病伤口的组织修复。本文于2025年3月发表于“Cellular & Molecular Biology Letters”(IF=9.2)上。
技术路线
结果:
1)ADSCs促进糖尿病小鼠伤口新生血管和加速修复的潜在机制
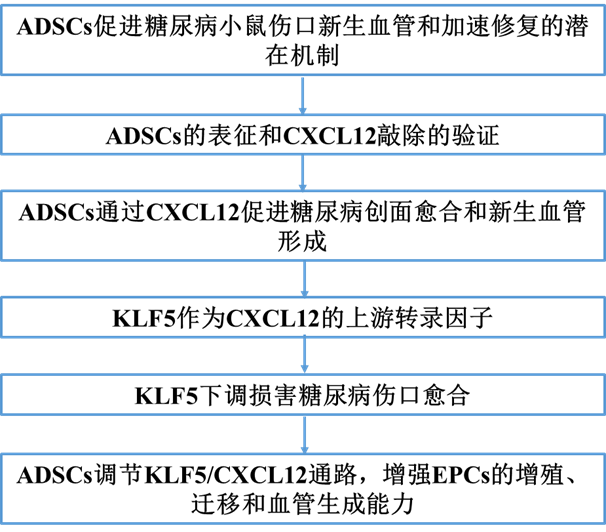
为了探索ADSCs在糖尿病伤口修复中促进血管新生的潜在机制,我们使用高通量转录组测序分析了在高糖(HG)和低糖(LG)条件下处理人ADSCs 48小时后的mRNA表达变化。共鉴定出80个上调和269个下调的mRNAs,如火山图和热图所示(图1A,B)。从GeneCards数据库中检索到包含4830个基因的与血管新生相关的基因。通过将349个DEGs与血管新生相关基因相交,确定了75个共享基因以构建新血管生成相关特征签名(NRS)(图1C)。GO富集分析(图1D)和KEGG通路分析(图1E)用以检查NRS与特定的生物学过程(BP)、细胞组分(CC)和分子功能(MF)及通路的关系。分析结果显示,NRS涉及与缺氧反应和氧气水平降低相关的BP。CC和MF与含有胶原蛋白的细胞外基质相关,并参与生长因子活性、糖胺聚糖结合和跨膜受体蛋白激酶活性。KEGG通路分析表明,在如下通路中显著富集:PI3K-Akt、MAPK、钙信号传导、Ras信号传导、肌动蛋白细胞骨架的调节和Rap1信号通路。为了探索蛋白质相互作用,我们使用STRING数据库构建了NRS的蛋白质-蛋白质相互作用(PPI)网络,结果是一个包含46个节点和116条边的网络,通过Cytoscape进行可视化(图1F)。在cytoHubba插件中使用五种算法筛选出了前十个枢纽基因。通过取所有算法中前十个基因的交集,确定了七个枢纽基因(CD34、CXCL12、FGF7、FGF18、FGF1、TEK和KIT)(图1G)。免疫荧光染色显示,与正常皮肤相比,糖尿病溃疡患者的伤口组织中的CXCL12表达显著减少(图1H)。特别是CXCL12,由于其潜在的重要性,被选为进一步初步研究的对象。
2)ADSCs的表征和CXCL12敲除的验证
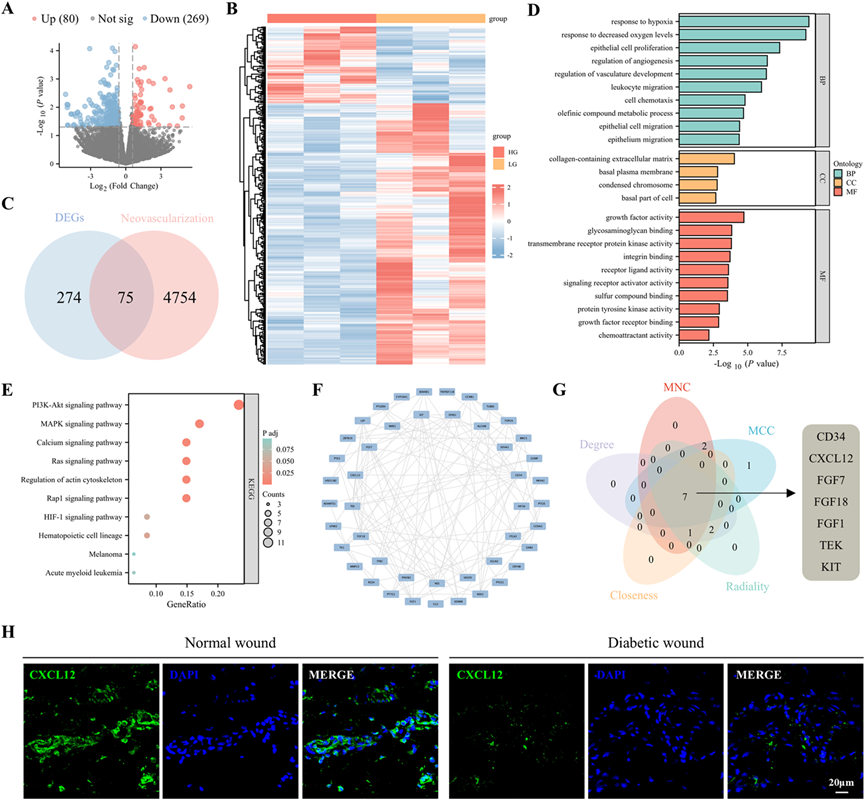
ADSCs在单层中以成纤维细胞样的形态生长良好(图2A)。它们的分化潜能通过油红O对脂肪细胞的阳性染色(图2B)、阿利辛蓝对软骨细胞的阳性染色(图2C)和茜素红对骨细胞的阳性染色(图2D)得到确认。流式细胞术分析表明,ADSCs表达间充质干细胞标志物CD29(98.58%)和CD90(98.30%),并且造血细胞标志物CD34(2.67%)和CD45(0.69%)的表达最小,确认了ADSCs的成功分离(图2E)。为了在实验期间保持细胞的一致性,使用了第3至第6代(P3–P6)的ADSCs。为了进一步研究CXCL12的生物效应,用靶向CXCL12的慢病毒shRNA转染ADSCs。通过RT-qPCR、western blot和ELISA验证了敲减效率,这些方法都表明ADSCs中CXCL12的mRNA和蛋白质水平显著降低(图2F–I)。
3)ADSCs通过CXCL12促进糖尿病创面愈合和新生血管形成
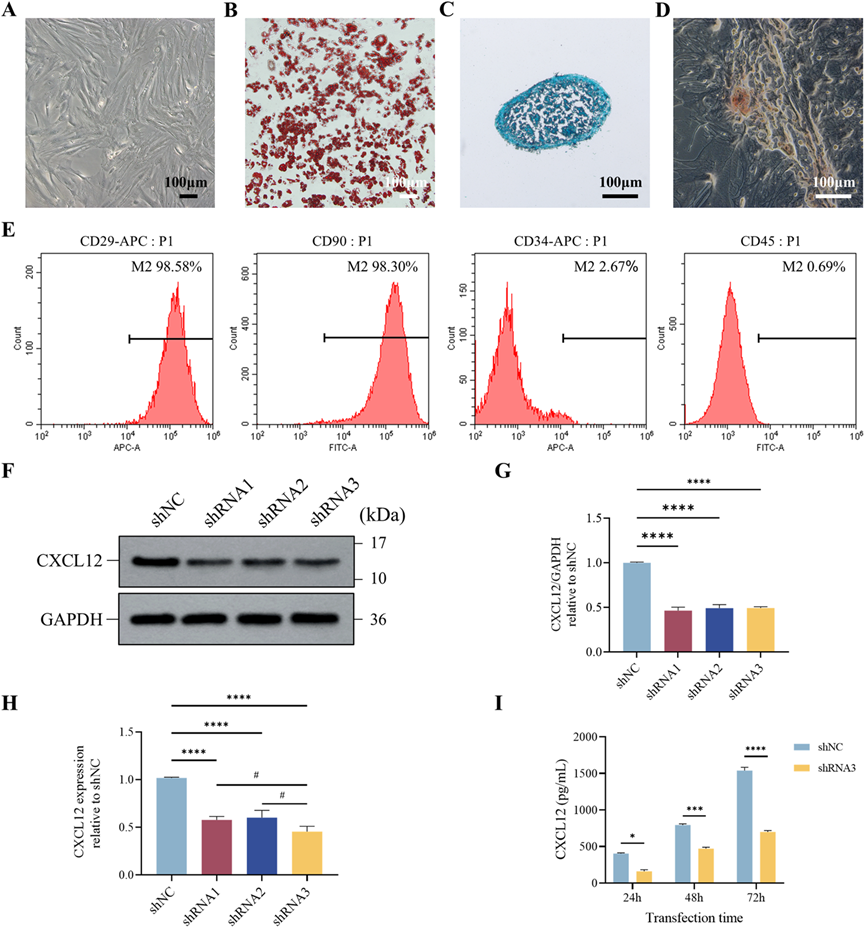
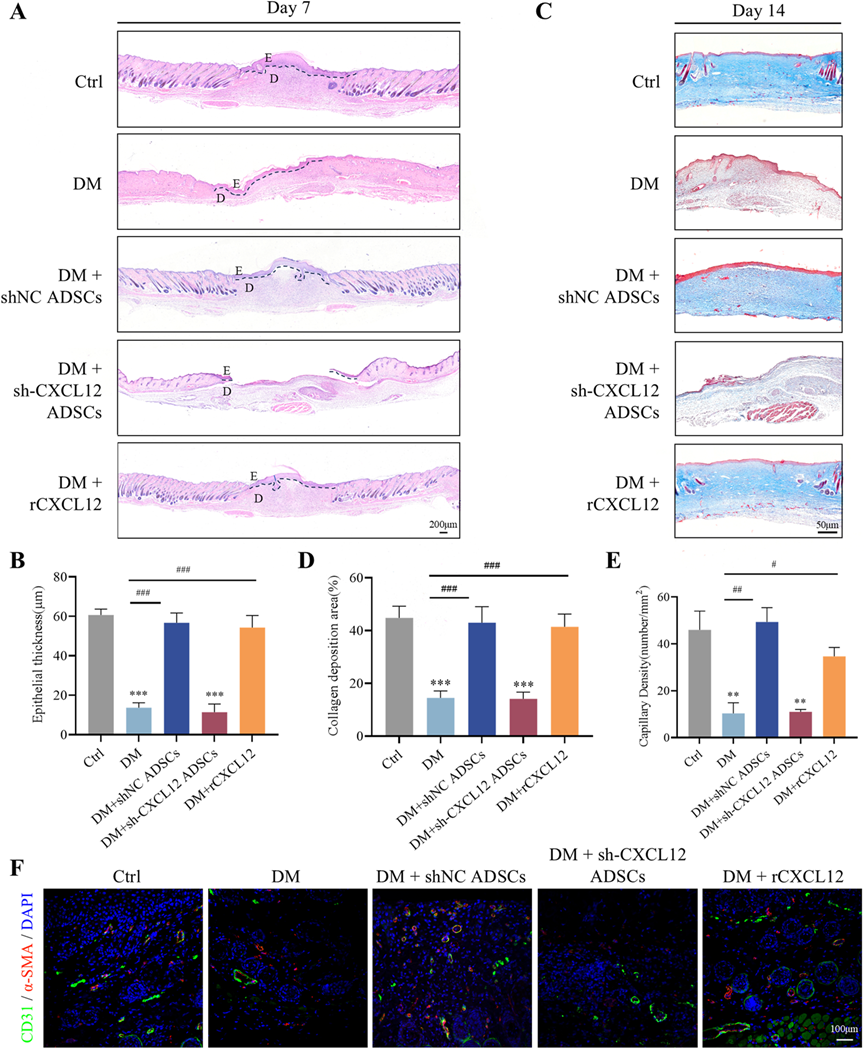
成功建立了糖尿病小鼠模型,每个小鼠背部创建了一个圆形的全层皮肤缺损伤口,如图3A所示。结果显示,与对照组相比,接受shNC ADSCs或重组CXCL12(rCXCL12)治疗的小鼠伤口愈合显著加速。然而,下调CXCL12表达抑制了ADSCs对伤口愈合的治疗效果(图3B–D)。HE染色(图4A, B)和Masson三色染色(图4C, D)表明,用shNC ADSCs或rCXCL12治疗显著增加了糖尿病小鼠受损组织的上皮厚度并增强了胶原蛋白沉积。相比之下,用sh-CXCL12 ADSCs治疗的组在上皮化和伤口床的胶原蛋白排列方面显著减少。CD31和α-SMA的免疫染色(图4E, F)表明,在shNC ADSCs和rCXCL12组中血管生成增强,而CXCL12沉默逆转了shNC ADSCs的促血管生成作用。这些结果提示,ADSCs主要通过CXCL12显著刺激伤口愈合,改善重新上皮化,增加胶原蛋白沉积,并在糖尿病伤口中促进新血管生成。
4)KLF5作为CXCL12的上游转录因子
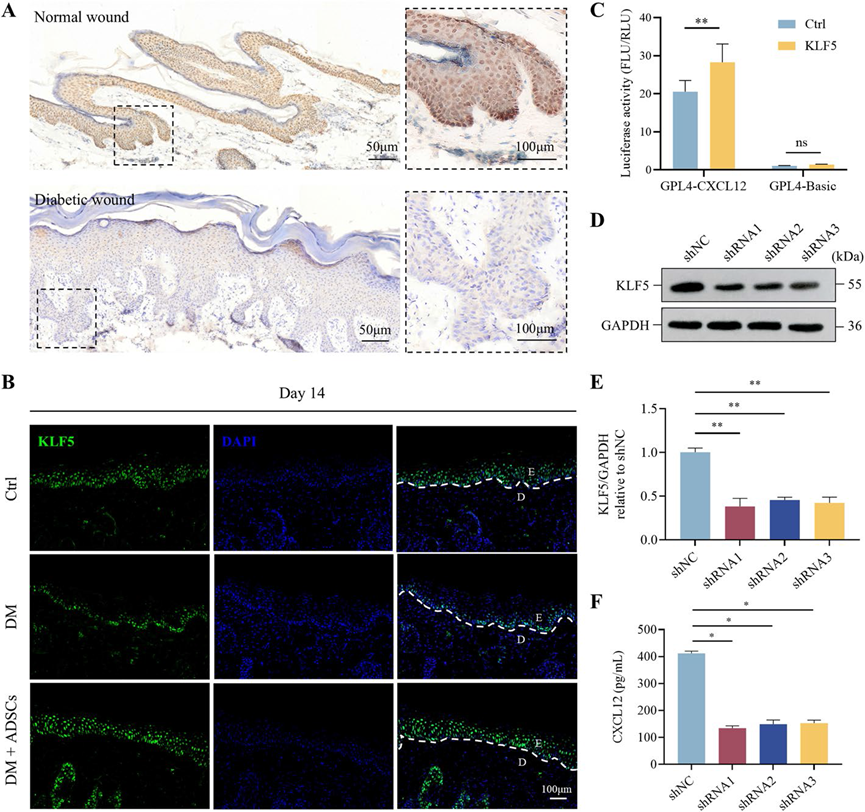
为了阐明ADSCs中的CXCL12促进糖尿病伤口愈合的机制,我们研究了其上游调控分子。使用JASPAR数据库预测了CXCL12的潜在上游转录因子,揭示了几种候选分子:KLF5、NFKB1、CREB1、RELA、STAT3、E2F1、PPARG、TFAP2C和TFAP2A。由于KLF5可能涉及糖尿病伤口愈合,我们重点关注了KLF5。免疫组化染色证实,糖尿病溃疡患者和糖尿病小鼠的伤口组织中KLF5表达较低(图5A, B)。值得注意的是,在ADSC治疗后,糖尿病小鼠伤口组织中的KLF5表达显著增加(图5B)。使用JASPAR数据库,我们筛选了CXCL12的启动子区域,并在CXCL12 5' UTR上游的1399 bp区域内鉴定出79个潜在的KLF5结合位点。为了确定KLF5是否通过启动子结合调节CXCL12的转录,进行了双荧光素酶报告基因分析。KLF5的过表达导致荧光素酶活性增加,表明CXCL12启动子被激活(图5C)。通过分别用sh-KLF5和shNC慢病毒转染细胞,生成了稳定的KLF5敲减和对照ADSCs。Western blot分析确认了敲减效率(图5D, E)。ELISA测量结果显示,与对照相比,KLF5敲减ADSCs中的CXCL12表达显著降低(图5F)。这些结果提示KLF5直接结合到CXCL12的启动子上并激活其分泌。
5)KLF5下调损害糖尿病伤口愈合
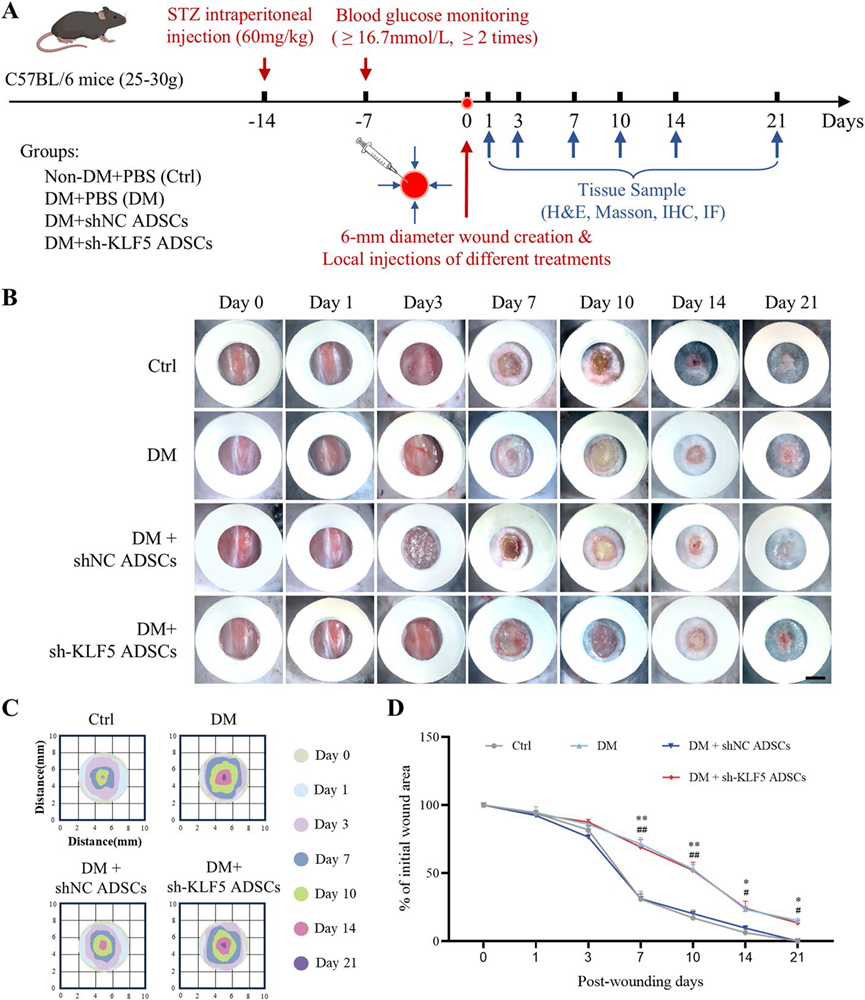
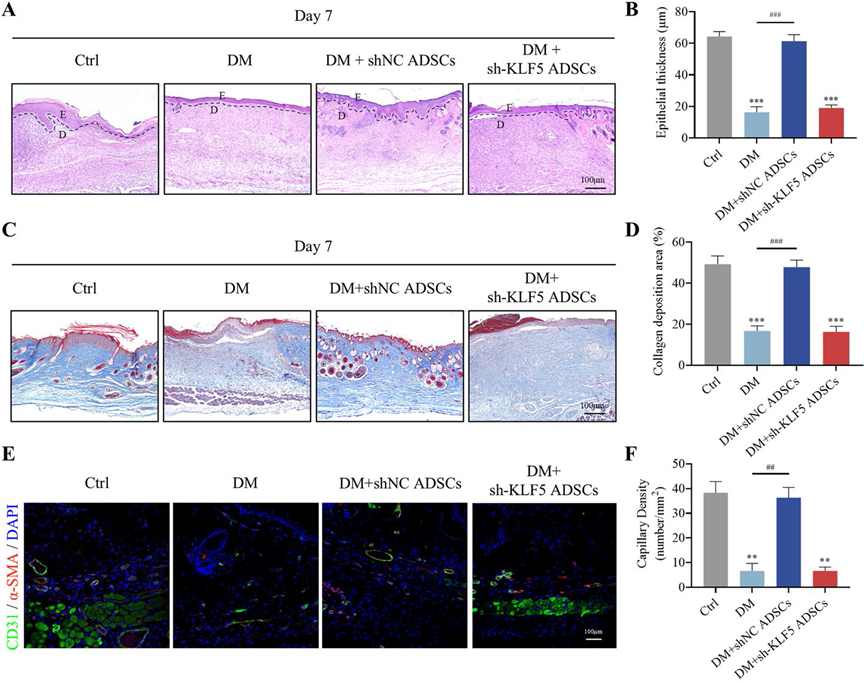
为了评估KLF5在ADSCs治疗效果中的作用,我们建立了一个糖尿病小鼠伤口模型并应用了不同的治疗方案(图6A)。与shNC ADSCs组相比,接受sh-KLF5 ADSCs治疗的小组伤口愈合率显著降低,表明KLF5敲减抑制了ADSC介导的糖尿病小鼠伤口愈合(图6B–D)。HE染色显示,sh-KLF5 ADSCs组的伤口上皮化明显减少,类似于DM组(图7A, B)。Masson三色染色显示,与shNC ADSCs组相比,sh-KLF5 ADSCs组的胶原沉积减少且排列紊乱(图7C, D)。此外,通过CD31和α-SMA的免疫荧光染色确认,与shNC ADSCs组相比,sh-KLF5 ADSCs组伤口区域的血管新生显著减少(图7E, F)。这些发现强调了KLF5在ADSCs对糖尿病伤口愈合的治疗效果中的关键作用。
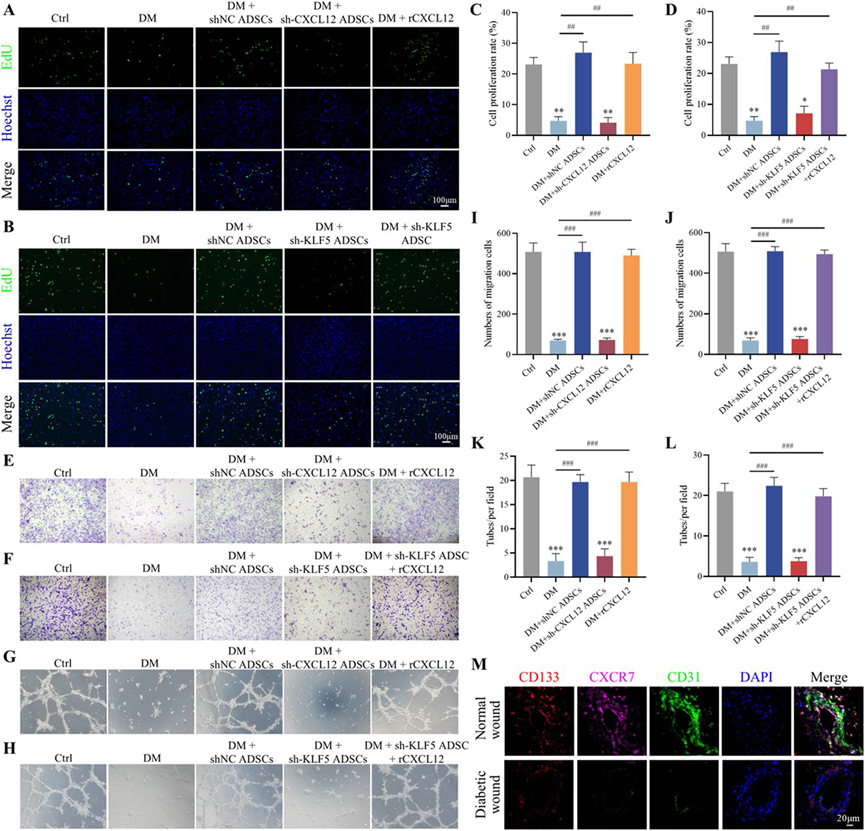
6)ADSCs调节KLF5/CXCL12通路,增强EPCs的增殖、迁移和血管生成能力
为了研究ADSCs对EPCs细胞功能的影响,我们建立了一个体外HG模型。EdU实验表明,与shNC ADSCs或rCXCL12共培养24小时后,与DM组相比,EPCs的增殖能力显著提高。当ADSCs中的KLF5或CXCL12表达被下调时,这种增强作用被抑制。值得注意的是,在ADSCs中敲减KLF5后添加rCXCL12恢复了EPCs的增殖能力(图8A–D)。EPCs的迁移和成血管能力也观察到了类似趋势。Transwell迁移实验和管形成实验显示,当与sh-KLF5 ADSCs共培养时,rCXCL12显著增加了EPCs的迁移和成血管能力(图8E–L)。免疫荧光染色揭示,与正常对照组相比,糖尿病患者的EPCs表面标志物CD133的表达略有降低。相比之下,CXCR7和内皮细胞标志物CD31在糖尿病溃疡患者的伤口组织中的水平显著低于正常皮肤。在正常对照组中,CXCR7阳性细胞被发现与CD133阳性细胞高度共定位(图8M)。CXCR7和CD31的减少表明糖尿病溃疡伤口组织中的内皮细胞数量减少,这可能阻碍EPC的分化并损害血管新生过程。糖尿病患者EPCs表面CXCR7表达的减少可能有助于这些影响。
结论:
局部应用ADSCs显著增强了糖尿病伤口的愈合,其中KLF5通过上调CXCL12促进血管新生,发挥了关键作用。CXCL12表达的增加刺激了EPC的增殖、迁移和成血管能力,这些对于有效的伤口修复都至关重要。这些发现为开发针对KLF5/CXCL12途径的新治疗策略,以改善糖尿病伤口的治疗提供了宝贵的见解。
实验方法:
RNA测序,ELISA,Western blot,RT‑qPCR,细胞增殖实验,Transwell,管形成实验,免疫组化,免疫荧光,荧光素酶报告基因实验。
参考文献:
Xie Y, Ni X, Wan X, Xu N, Chen L, Lin C, Zheng X, Cai B, Lin Q, Ke R, Huang T, Hu X, Wang B, Shan X. KLF5 enhances CXCL12 transcription in adipose-derived stem cells to promote endothelial progenitor cells neovascularization and accelerate diabetic wound healing. Cell Mol Biol Lett. 2025 Mar 4;30(1):24. doi: 10.1186/s11658-025-00702-0.






